广州市化学培优课程三稿原理题广雅 钟国华.docx
《广州市化学培优课程三稿原理题广雅 钟国华.docx》由会员分享,可在线阅读,更多相关《广州市化学培优课程三稿原理题广雅 钟国华.docx(14页珍藏版)》请在冰豆网上搜索。
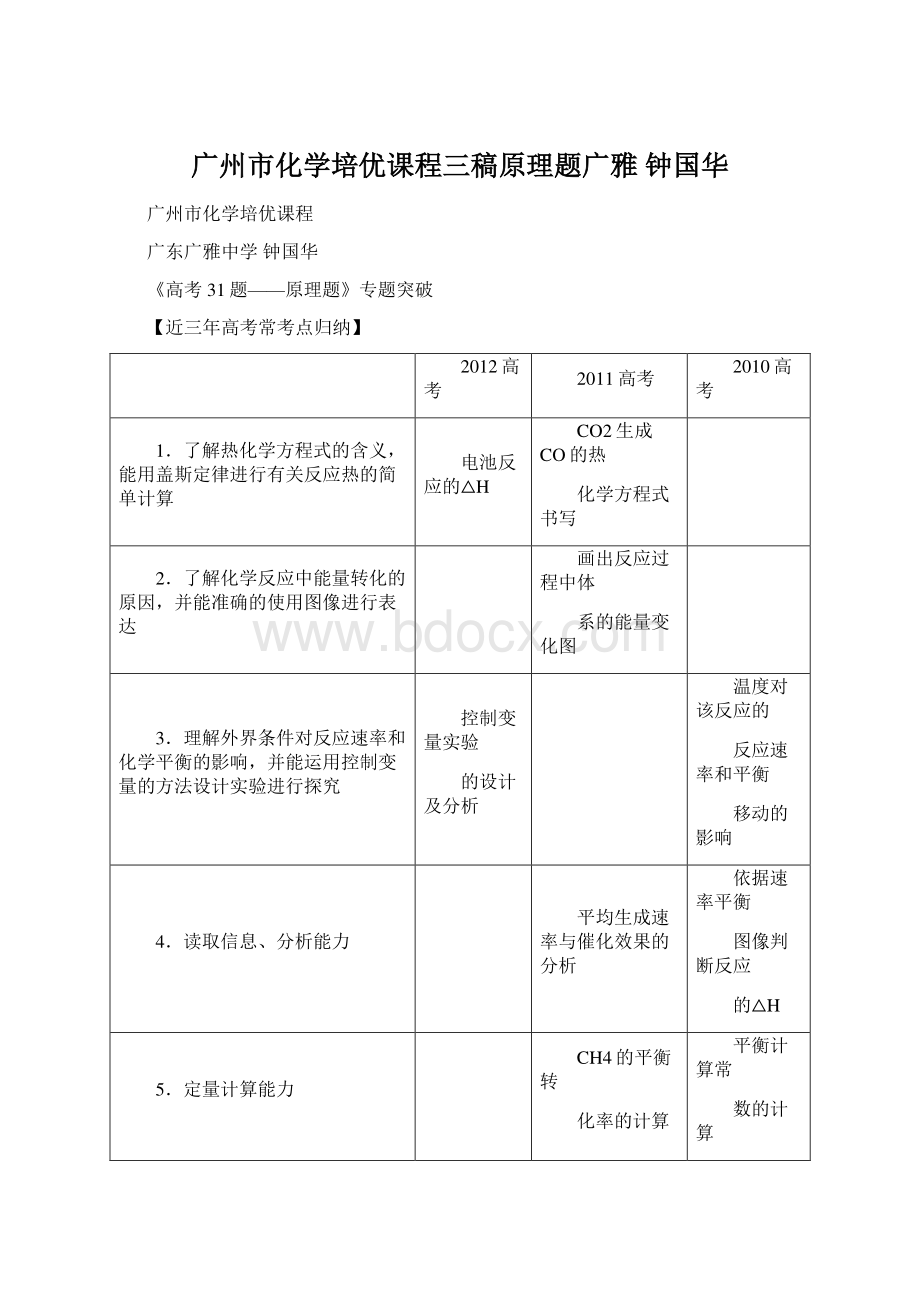
广州市化学培优课程三稿原理题广雅广州市化学培优课程三稿原理题广雅钟国华钟国华广州市化学培优课程广东广雅中学钟国华高考31题原理题专题突破【近三年高考常考点归纳】2012高考2011高考2010高考1了解热化学方程式的含义,能用盖斯定律进行有关反应热的简单计算电池反应的HCO2生成CO的热化学方程式书写2了解化学反应中能量转化的原因,并能准确的使用图像进行表达画出反应过程中体系的能量变化图3理解外界条件对反应速率和化学平衡的影响,并能运用控制变量的方法设计实验进行探究控制变量实验的设计及分析温度对该反应的反应速率和平衡移动的影响4读取信息、分析能力平均生成速率与催化效果的分析依据速率平衡图像判断反应的H5定量计算能力CH4的平衡转化率的计算平衡计算常数的计算6了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式碘电极电池方程式书写7掌握氧化还原反应的配平,及氧化还原滴定的定量测定方法氧化还原滴定及定量计算B2H6与水反应的方程式书写纵观近三年高考题,化学反应原理题主要涉及热化学、电化学、化学反应速率及化学平衡移动等四块内容。
以下是可能具体考察到的知识点。
1热化学
(1)热化学方程式的书写
(2)盖斯定律的应用(3)了解化学反应中能量转化的原因,并能准确的使用图像进行表达。
画出反应过程中体系的能量变化图2电化学
(1)原电池和电解池的工作原理和相关基本概念
(2)电极方程式的书写3化学反应速率理论
(1)化学反应速率计算
(2)利用化学反应速率影响因素解决实际问题工业生产条件选择控制变量法设计实验速率变化规律的解释(3)作图:
v-t图、c-t图4化学平衡移动原理
(1)K、H、T变化关系
(2)工业生产条件的选择(3)平衡常数相关计算三行式直接计算K利用K为桥梁计算转化率、产率多重平衡相关计算(4)原理解释利用Qc和K进行反应进行(或平衡移动)方向的判断利用平衡移动原理解释实际问题(5)读图读表描述规律并做出解释(6)作图:
v-t图、c-t图专题一:
电极方程式的书写【解题步骤】1确定对应电极材料,得电子还是失电子。
2确定该电极附近的离子种类,并按照放电顺序得出具体反应的离子。
3确定放电的物质或离子的存在形态(价态、离子共存)4按照“电子得失守恒电荷守恒元素守恒”的思路直接写出方程式。
【例1】(2012全国节选)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为。
【例2】碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。
以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。
另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为_【练习】肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:
N2(g)+2O2(g)=N2O4
(1)H1=-19.5kJmol-1N2H4
(1)+O2(g)=N2(g)+2H2O(g)H2=-534.2kJmol-1
(1)写出肼和N2O4反应的热化学方程式;
(2)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为。
专题二:
读图读表描述规律【解题关键】【设问类型】实验目的:
结论规律:
【题型特点】【答题模板】【答题误区】【例1】(2010广州一模节选)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图12。
CO转化率随温度变化的规律是。
【例2】(2008广州一模节选)原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。
实验数据见下表:
CO2%-CO%-H2%(体积分数)03070228704267082270201070反应温度/253550253550253550253550253550转化率(%)CH3OH.9.81.06.50.78.39.03.16.57.73.44.4.02.02.6CH4.8.8.8由上表数据可得出多个结论。
结论一:
在一定条件下,反应温度越高,碳转化率_。
结论二:
_。
【例3】(2011广州一模节选)苯乙烯(C6H5CH=CH2)是生产塑料的重要单体,其制备原理是:
C6H5C2H5(g)C6H5CH=CH2(g)+H2(g)H=+125kJ/mol
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。
C6H5C2H5平衡转化率与水蒸气的用量、体系总压强关系如下图。
由该图可得出:
结论一:
其他条件不变,水蒸气用量越大,平衡转化率越;结论二:
(3)加入稀释剂能影响C6H5C2H5平衡转化率的原因是:
(4)某些工艺中,在反应的中途加入某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高C6H5C2H5的平衡转化率。
试解释其原因:
【例4】(2009广州二模)乙酸乙酯是重要的化工原料,沸点约77。
其水解反应方程式为:
CH3COOC2H5+H2OCH3COOH+C2H5OH酸和碱均可用作该反应的催化剂。
某兴趣小组对NaOH溶液催化乙酸乙酯水解进行了探究。
实验步骤:
向试管中加入8mLNaOH溶液,再加入2mL乙酸乙酯,用直尺量出乙酸乙酯的高度。
再把试管放入70的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度。
再迅速放回水浴中继续加热,如此反复进行。
改变NaOH溶液浓度,重复实验。
数据记录:
乙酸乙酯水解后剩余的高度/min组别C(NaOH)/molL-1时间/min01234567810.510.09.08.07.57.06.56.56.56.521.010.08.57.06.05.04.54.54.54.532.010.08.06.04.53.02.01.51.51.5回答下列问题:
(1)完成上述对比实验时,每组实验都必须控制不变的因素有、。
(2)分析上述数据,得到乙酸乙酯水解速率的结论是:
NaOH溶液浓度越大,水解速率越_。
【练习1】(2007广东)“碘钟”实验中,3IS2O82I32SO42的反应速率可以用I3与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。
某学习小组在20进行实验,得到的数据如下表:
实验编号c(I)/molL10.0400.0800.0800.1600.120c(S2O82)/molL10.0400.0400.0800.0200.040t/s88.044.022.044.0t2回答下列问题:
(1)该实验的目的是。
(4)通过分析比较上表数据,得到的结论是。
【练习2】(2012广东节选)碘在科研与生活中有重要作用,某兴趣小组用0.50molL1KI、0.2%淀粉溶液、0.20molL1K2S2O8、0.10molL1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:
S2O82+2I=2SO42+I2(慢)I2+2S2O32=2I+S4O62(快)
(1)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号体积V/mLK2S2O8溶液水KI溶液Na2S2O3溶液淀粉溶液10.00.04.04.02.09.01.04.04.02.08.0Vx4.04.02.0表中Vx=_mL,理由是_。
(2)已知某条件下,浓度c(S2O82)反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82)反应时间t的变化曲线示意图(进行相应的标注)。
图13专题三:
化学平衡
(一)化学平衡相关计算1三行式常规计算【注意事项】规范(设、三行式表格、表达式、带单位代入数据、科学计数法)陷阱(体积的处理、方程式的方向)2多重反应平衡常数计算【解题技巧】列式分析给出的平衡常数与待算的平衡常数、离子浓度的关系。
【例1】(2012广东节选)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:
CaSO4(s)+CO32CaCO3(s)+SO42已知298K时,Ksp(CaCO3)=2.80109,Ksp(CaSO3)=4.90105,求此温度下该反应的平衡常数K(计算结果保留三位的效数字)。
【例2】已知973K时下述反应的K:
SO2(g)+1/2O2(g)SO3(g)K1=20NO2(g)NO(g)+1/2O2(g)K2=0.012求反应SO2(g)+NO2(g)SO3(g)+NO(g)的平衡常数K。
【例3】25时,取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液(过量)中,充分搅拌。
若反应后测得溶液的pH=4,求算此时溶液中的S2浓度。
(已知:
常温时CuS、Cu(OH)2的Ksp分别为8.81036、2.21020)
(二)平衡移动方向的判断【解题提示】1哪种情况使用Qc与K进行比较判断2【答题模式】【例1】(2008广州一模)甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)CH3OH(g)H0。
在一定条件下,上述反应在一密闭容器中达到平衡。
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是_(填字母)。
A升高温度B增大压强C通入COD通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡_(填字母)。
A向正反应方向移动B向逆反应方向移动C不移动作出此判断的理由是_。
【例2】专题二【例3】(3)(三)利用平衡移动原理解释问题【答题模板】【例题1】羟基磷灰石Ca5(PO4)3OH是牙齿所含的矿物质,当糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。
结合沉淀溶解平衡的移动原理,分析其原因。
【例题2】碱式硫酸铁Fe(OH)SO4对水中的悬浮物、有机物、硫化物、重金属等都能絮凝,工业上常用硫酸亚铁法制备,工艺流程如下图所示:
已知:
Fe3+沉淀完全时的pH=3.1,Fe2+沉淀完全时的pH=9.7加入硫酸的作用是控制体系的pH值,若硫酸加入量过低,则反应体系酸度太低,容易生成_沉淀;若硫酸加入量过高,不利于产品形成,试从平衡移动的角度分析原因是_。
【例题3】(2012一模节选)母液“除杂”后,欲得到(NH4)2SO4粗产品,操作步骤依次为真空蒸发浓缩、冷却结晶、。
浓缩时若温度过高,产品中将混有NH4HSO4,运用化学平衡移动原理解释其原因【例题4】专题二【例3】(4)【练习】往氯化铁溶液中滴加几滴KSCN溶液,现象为:
,再往混合液中加入足量的铁粉,并振荡,现象为:
,请用平衡移动原理解释第二个现象产生的原因:
【归纳】课本几个重要的平衡体系专题四:
作图【画图关键】
(一)定量图【例1】(2009全国)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
根据左表中数据,在右图中画出Z的物质的量(n)随时间(t)变化的曲线:
t/minX/molY/molZ/mol01.001.000.0010.900.800.2030.750.500.5050.650.300.7090.550.100.90140.550.100.90
(二)定性图【例1】反应过程的能量变化图。
(08广东高考、2011广东高考)【例2】一定条件下:
CO(g)+2H2(g)CH3OH(g)H0(3)其他条件不变,请在“图2”中画出温度为T2(且T2T1)时,CO的平衡转化率与H2和CO的起始组成比n(H2)/n(CO)的关系曲线。
【例3】专题二【练习】2012广东高考【例4】已知:
I2+2Na2S2O3=Na2S4O6+2NaI,H0,这是吸热反应,同时温度过高使NH3H2O分解NH3挥发,两个因素均使平衡向右移动,溶液酸性增强生成NH4HSO4。
【例4】反应体系中存在平衡C6H5C2H5(g)C6H5CH=CH2(g)+H2(g),加入O2后,2H2+O2=2H2O,c(H2)减小,同时该反应放热使体系温度升高,两种因素均使平衡向正反应方向移动,从而影响C6H5C2H5的平衡转化率。
【练习】溶液变红;溶液由红色变为浅绿色;溶液中存在平衡Fe3+3SCN-Fe(SCN)3,加入铁粉后,2Fe3+Fe=3Fe2+,c(Fe3+)减小,平衡逆向移动,由于铁粉过量,Fe(SCN)3基本分解完全并转化为Fe2+,因此溶液变为浅绿色。
专题四