北京市一零一中学高中化学竞赛 第12讲 副族元素及其化合物.docx
《北京市一零一中学高中化学竞赛 第12讲 副族元素及其化合物.docx》由会员分享,可在线阅读,更多相关《北京市一零一中学高中化学竞赛 第12讲 副族元素及其化合物.docx(34页珍藏版)》请在冰豆网上搜索。
北京市一零一中学高中化学竞赛第12讲副族元素及其化合物
第12讲副族元素及其化合物
【竞赛要求】
钛、钒、铬、锰、铁、钴、镍、铜、银、金、锌、汞、钼、钨。
过渡元素氧化态。
氧化物和氢氧化物的酸碱性和两性。
水溶液中的常见离子的颜色、化学性质、定性检出(不使用特殊试剂)和分离。
制备单质的一般方法。
【知识梳理】
一、通论
d区元素是指
B~
族元素,ds区元素是指
B、
B族元素。
d区元素的外围电子构型是(n-1)d1~10ns1~2(Pd例外),ds区元素的外围电子构型是(n-1)d10ns1~2。
它们分布在第4、5、6周期之中,而我们主要讨论第4周期的d区和ds区元素。
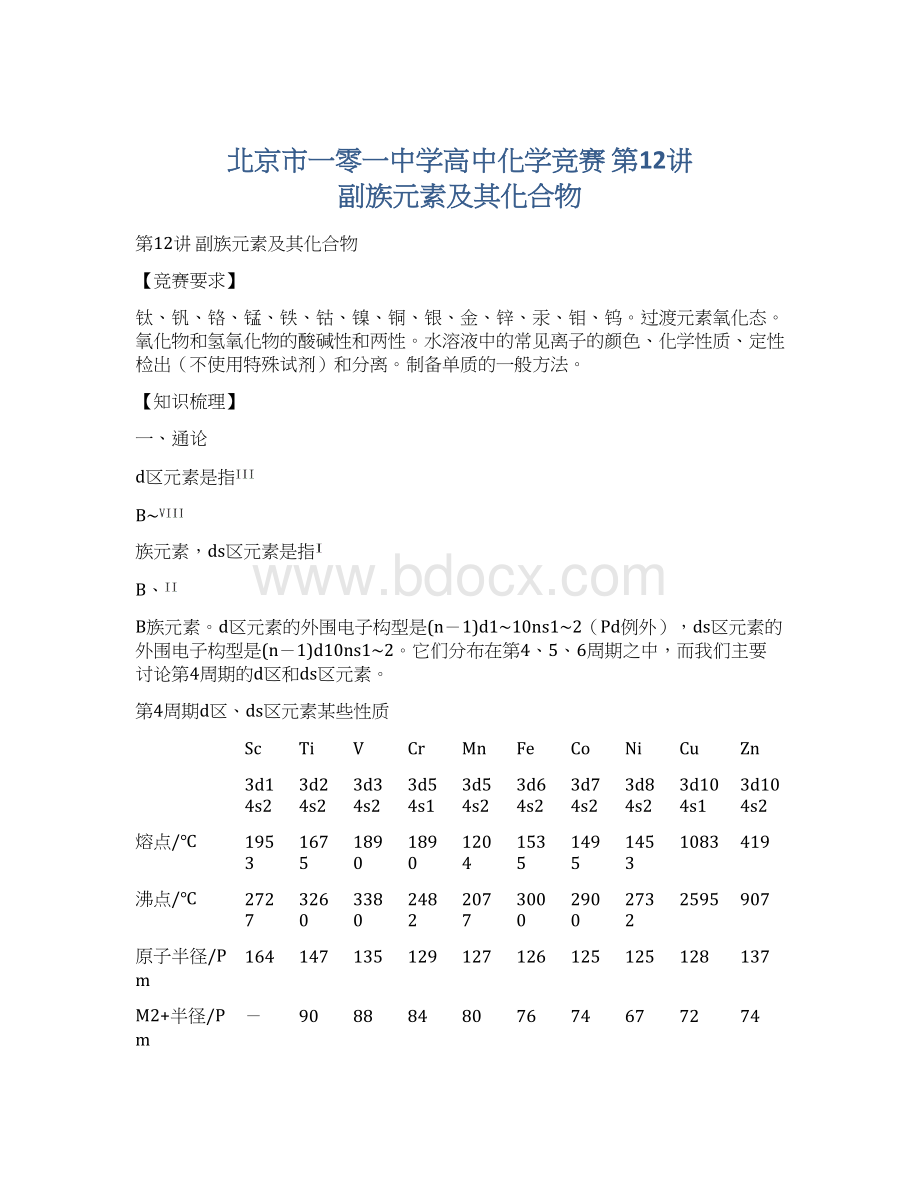
第4周期d区、ds区元素某些性质
Sc
3d14s2
Ti
3d24s2
V
3d34s2
Cr
3d54s1
Mn
3d54s2
Fe
3d64s2
Co
3d74s2
Ni
3d84s2
Cu
3d104s1
Zn
3d104s2
熔点/℃
1953
1675
1890
1890
1204
1535
1495
1453
1083
419
沸点/℃
2727
3260
3380
2482
2077
3000
2900
2732
2595
907
原子半径/Pm
164
147
135
129
127
126
125
125
128
137
M2+半径/Pm
-
90
88
84
80
76
74
67
72
74
I1kJ·mol-1
631
658
650
652.8
717.4
759.4
758
736.7
745.5
906.4
室温密度/gcm-3
2.99
4.5
5.96
7.20
7.20
7.86
8.9
8.90
8.92
7.14
氧化态
3
–1,0,2
3,4
–1,0,2
3,4,5
–2,–1,0
2,3,4
5,6
–1,0,1
2,3,4
5,6,7
0,2,3
4,5,6
0,2
3,4
0,2
3,(4)*
1,2,
3
(1),
2
*()内为不稳定氧化态。
同一周期的d区或ds区元素有许多相似性,如金属性递变不明显、原子半径、电离势等随原子序数增加虽有变化,但不显著,都反映出d区或ds区元素从左至右的水平相似性。
d区或ds区元素有许多共同的性质:
(1)它们都是金属,因为它们最外层都只有1~2个电子。
它们的硬度大,熔、沸点较高。
第4周期d区元素都是比较活泼的金属,题目能置换酸中的氢;而第5、6周期的d区元素较不活泼,它们很难和酸作用。
(2)除少数例外,它们都存在多种氧化态,且相邻两个氧化态的差值为1或2,如Mn,它有–1,0,1,2,3,4,5,6,7;而p区元素相邻两氧化态间的差值常是2,如Cl,它有–1,0,1,3,5,7等氧化态。
最高氧化态和族号相等,但
族除外。
第4周期d区元素最高氧化态的化合物一般不稳定;而第5、6周期d区元素最高氧化态的化合物则比较稳定,且最高氧化态化合物主要以氧化物、含氧酸或氟化物的形式存在,如WO3、WF6、MnO
、FeO
、CrO
等,最低氧化态的化合物主要以配合物形式存在,如[Cr(CO)5]2–
(3)它们的水合离子和酸根离子常呈现一定的颜色。
这些离子的颜色同它们的离子存在未成对的d电子发生跃迁有关。
某些d去元素水合离子的颜色
电子构型
未成对电子数
阳离子
水合离子颜色
3d0
0
0
Sc3+
Ti4+
无色
无色
3d1
1
1
Ti3+
V4+
紫色
蓝色
3d2
2
V3+
绿色
3d3
3
3
V2+
Cr3+
紫色
紫色
3d4
4
4
Mn3+
Cr2+
紫色
蓝色
3d5
5
5
Mn2+
Fe3+
肉色
浅紫色
3d6
4
Fe2+
绿色
3d7
3
Co2+
粉红色
3d8
2
Ni2+
绿色
3d9
1
Cu2+
蓝色
3d10
0
Zn2+
无色
常见酸根离子的颜色有:
CrO
(黄色)、Cr2O
(橙色)、MnO
(绿色)、MnO
(紫红色)。
(4)它们的原子或离子形成配合物的倾向都较大。
因为它们的电子构型具有接受配体孤电子对的条件。
以上这些性质都和它们的电子层结构有关。
二、d区元素
(一)钛副族
1、钛副族元素的基本性质
钛副族元素原子的价电子层结构为(n-1)d2ns2,所以钛、锆和铪的最稳定氧化态是+4,其次是+3,+2氧化态则比较少见。
在个别配位化合物中,钛还可以呈低氧化态0和–l。
锆、铪生成低氧化态的趋势比钛小。
它们的M(Ⅳ)化合物主要以共价键结合。
在水溶液中主要以MO2+形式存在,并且容易水解。
由于镧系收缩,铪的离子半径与锆接近,因此它们的化学性质极相似,造成锆和铪分离上的困难。
2、钛及其化合物
(1)钛
钛是活泼的金属,在高温下能直接与绝大多数非金属元素反应。
在室温下,钛不与无机酸反应,但能溶于浓、热的盐酸和硫酸中:
2Ti+6HCl(浓)
2TiCl3+3H2↑2Ti+3H2SO4(浓)
2Ti2(SO4)3+3H2↑
钛易溶于氢氟酸或含有氟离子的酸中:
Ti+6HF
TiF
+2H++2H2↑
(2)二氧化钛
二氧化钛在自然界以金红石为最重要,不溶于水,也不溶于稀酸,但能溶于氢氟酸和热的浓硫酸中:
TiO2+6HF=H2[TiF6]+2H2OTiO2+2H2SO4=2Ti(SO4)2+2H2OTiO2+H2SO4=2TiOSO4+H2O
(3)四氯化钛
四氯化钛是钛的一种重要卤化物,以它为原料,可以制备一系列钛化合物和金属钛。
它在水中或潮湿空气中都极易水解将它暴露在空气中会发烟:
TiCl4+2H2O=TiO2+4HCl
(4)钛(Ⅳ)的配位化合物
钛(Ⅳ)能够与许多配合剂形成配合物,如[TiF6]2-、[TiCl6]2-、[TiO(H2O2)]2+等,其中与H2O2的配合物较重要。
利用这个反应可进行钛的比色分析,加入氨水则生成黄色的过氧钛酸H4TiO6沉淀,这是定性检出钛的灵敏方法。
(二)钒副族
1、钒副族元素基本性质
钒副族包括钒、铌、钽三个元素,它们的价电子层结构为(n-1)d3ns2,5个价电子都可以参加成键,因此最高氧化态为+5,相当于d0的结构,为钒族元素最稳定的一种氧化态。
按V、Nb、Ta顺序稳定性依次增强,而低氧化态的稳定性依次减弱。
铌钽由于半径相近,性质非常相似。
2、钒及其化合物
(1)钒
金属钒容易呈钝态,因此在常温下活泼性较低。
块状钒在常温下不与空气、水、苛性碱作用,也不与非氧化性的酸作用,但溶于氢氟酸,也溶于强氧化性的酸(如硝酸和王水)中。
在高温下,钒与大多数非金属元素反应,并可与熔融苛性碱发生反应。
(2)五氧化二钒
V2O5可通过加热分解偏钒酸铵或三氯氧化钒的水解而制得:
2NH4VO3
V2O5+2NH3+H2O2VOCl3+3H2O=V2O5+6HCl
在工业上用氯化焙烧法处理钒铅矿,提取五氧化二钒。
V2O5比TiO2具有较强的酸性和较强的氧化性,它主要显酸性,易溶于碱:
V2O5+6NaOH=2Na3VO4+3H2O
也能溶解在强酸中(pH<1)生成VO2+离子。
V2O5是较强的氧化剂:
V2O5+6HCl=2VOCl2+Cl2+3H2O
(3)钒酸盐和多钒酸盐
钒酸盐有偏钒酸盐MVO3、正钒酸盐M3VO4和多钒酸盐(M4V2O7、M3V3O9)等。
只有当溶液中钒的总浓度非常稀(低于10-4mol·L-1)且溶液呈强碱性(pH>13)时,单体的钒酸根才能在溶液中稳定存在;当pH下降,溶液中钒的总浓度小于10-4mol·L-1时,溶液中以酸式钒酸根离子形式存在,如HVO
、H2VO
;当溶液中钒的总浓度大于10-4mol·L-1时,溶液中存在一系列聚合物种(多钒酸盐)如V2O
、V3O
、V4O
、V10O
等。
(三)铬副族
1、铬副族的基本性质
周期系第
B族包括铬、钼、钨三个元素。
铬和钼的价电子层结构为(n-1)d5ns1,钨为(n-1)d4ns2。
它们的最高氧化态为+6,都具有d区元素多种氧化态的特征。
它们的最高氧化态按Cr、Mo、W的顺序稳定性增强,而低氧化态的稳定性则相反。
2、铬及其化合物
(1)铬
铬比较活泼,能溶于稀HCl、H2SO4,起初生成蓝色Cr2+溶液,而后为空气所氧化成绿色的Cr3+溶液:
Cr+2HCl=CrCl2+H2↑4CrCl2+4HCl+O2=4CrCl3+2H2O
铬在冷、浓HNO3中钝化。
(2)铬(III)的化合物
向Cr3+溶液中逐滴加入2mol·dm–3NaOH,则生成灰绿色Cr(OH)3沉淀。
Cr(OH)3具有两性:
Cr(OH)3+3H+=Cr3++3H2OCr(OH)3+OH-=Cr(OH)
(亮绿色)
铬(III)的配合物配位数都是6(少数例外),其单核配合物的空间构型为八面体,Cr3+离子提供6个空轨道,形成六个d2sp3杂化轨道。
(3)铬酸、铬酸盐和重铬酸盐
若向黄色CrO
溶液中加酸,溶液变为橙色Cr2O
(重铬酸根)液;反之,向橙色Cr2O
溶液中加碱,又变为CrO
黄色液:
2CrO
(黄色)+2H+
Cr2O
(橙色)+H2OK=1.2×1014
H2CrO4是一个较强酸(
=4.1,
=3.2×10-7),只存在于水溶液中。
氯化铬酰CrO2Cl2是血红色液体,遇水易分解:
CrO2Cl2+2H2O=H2CrO4+2HCl
常见的难溶铬酸盐有Ag2CrO4(砖红色)、PbCrO4(黄色)、BaCrO4(黄色)和SrCrO4(黄色)等,它们均溶于强酸生成M2+和Cr2O
。
K2Cr2O7是常用的强氧化剂(
=1.33V)饱和K2Cr2O7溶液和浓H2SO4混合液用作实验室的洗液。
在碱性溶液中将Cr(OH)
氧化为CrO
,要比在酸性溶液将Cr3+氧化为Cr2O
容易得多。
而将Cr(
)转化为Cr(
),则常在酸性溶液中进行。
3、钼和钨的重要化合物
(1)钼、钨的氧化物
MoO3、WO3和CrO3不同,它们不溶于水,仅能溶于氨水和强碱溶液生成相应的合氧酸盐。
(2)钼、钨的含氧酸及其盐
钼酸、钨酸与铬酸不同,它们是难溶酸,酸性、氧化性都较弱,钼和钨的含氧酸盐只有铵、钠、钾、铷、锂、镁、银和铊(I)的盐溶于水,其余的含氧酸盐都难溶于水。
氧化性很弱,在酸性溶液中只能用强还原剂才能将它们还原到+3氧化态。
(四)锰副族
1、锰副族的基本性质
ⅦB族包括锰、锝和铼三个元素。
其中只有锰及其化合物有很大实用价值。
同其它副族元素性质的递变规律一样,从Mn到Re高氧化态趋向稳定。
低氧化态则相反,以Mn2+为最稳定。
2、锰及其化合物
(1)锰
锰是活泼金属,在空气中表面生成一层氧化物保护膜。
锰在水中,因表面生成氢氧化锰沉淀而阻止反应继续进行。
锰和强酸反应生成Mn(
)盐和氢气。
但和冷浓H2SO4反应很慢(钝化)。
(2)锰(
)的化合物
在酸性介质中Mn2+很稳定。
但在碱性介质中Mn(
)极易氧化成Mn(
)化合物。
Mn(OH)2为白色难溶物,Ksp=4.0×10-14,极易被空