第四章电化学.docx
《第四章电化学.docx》由会员分享,可在线阅读,更多相关《第四章电化学.docx(24页珍藏版)》请在冰豆网上搜索。
第四章电化学
第四章电化学
一、原电池原理
1.原电池的概念和实质
(1)概念:
将 转化为 的装置。
(2)实质:
利用能自发进行的 反应把化学能转化为电能。
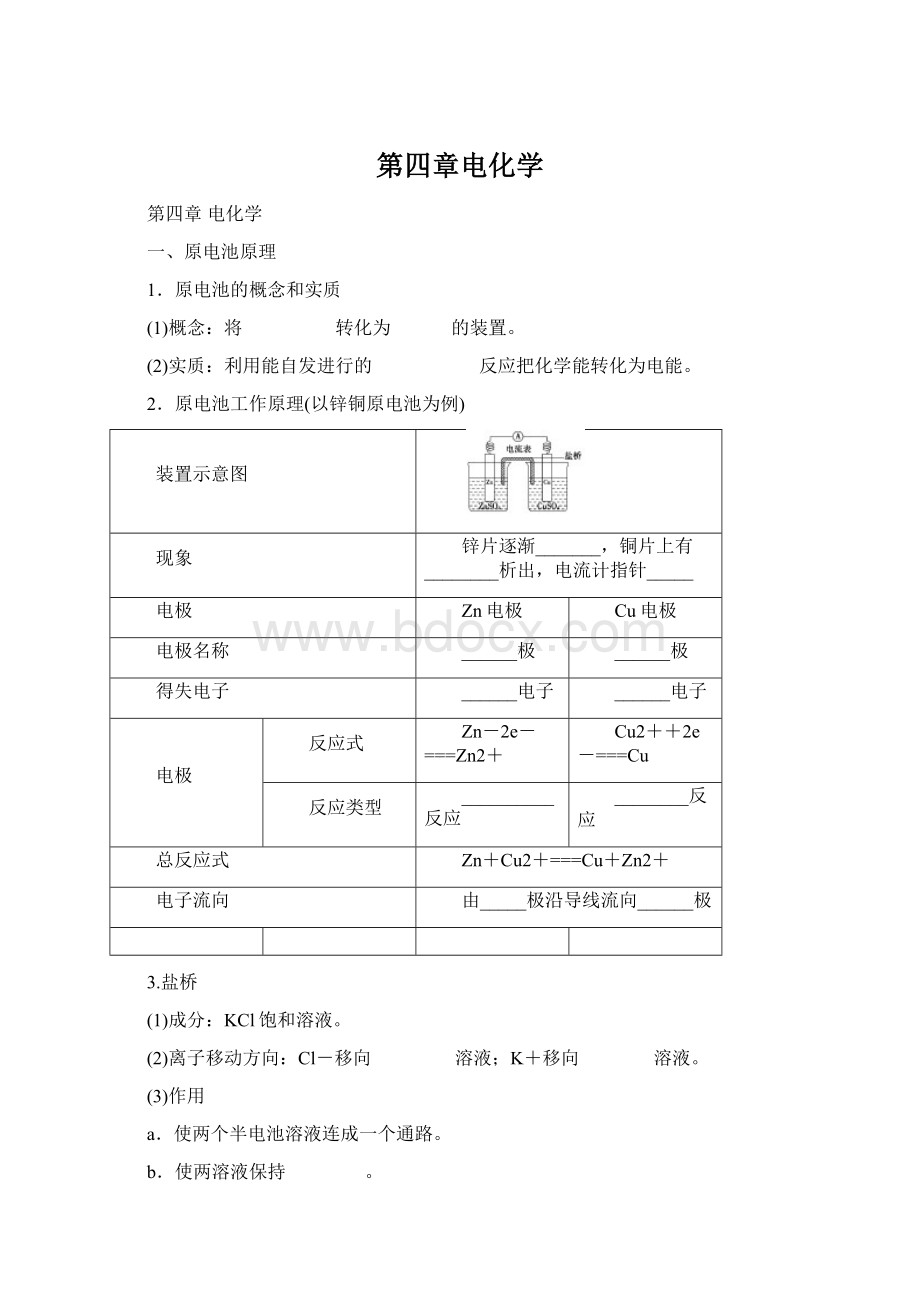
2.原电池工作原理(以锌铜原电池为例)
装置示意图
现象
锌片逐渐_______,铜片上有________析出,电流计指针_____
电极
Zn电极
Cu电极
电极名称
______极
______极
得失电子
______电子
______电子
电极
反应式
Zn-2e-===Zn2+
Cu2++2e-===Cu
反应类型
__________反应
________反应
总反应式
Zn+Cu2+===Cu+Zn2+
电子流向
由_____极沿导线流向______极
3.盐桥
(1)成分:
KCl饱和溶液。
(2)离子移动方向:
Cl-移向 溶液;K+移向 溶液。
(3)作用
a.使两个半电池溶液连成一个通路。
b.使两溶液保持 。
(4)取出盐桥,通路被切断,电流计指针回到 点。
二、原电池的设计
1.依据
理论上,能自发进行的 均能设计成原电池。
2.实际设计时应注意以下几个方面
(1)外电路:
负极( 的物质)
正极( )
(2)内电路:
将两极浸入 溶液中,并通过 离子的定向运动而形成内电路。
(3)闭合回路
三.原电池正负极的判断方法
负极
正极
电极材料
较____的金属
较______金属或非金属
电子流向
电子流_____的一极
电子流_____的一极
离子移动方向
____离子移向的一极
_____离子移向的一极
反应类型
发生______反应的一极
发生还原反应的一极
电极质量变化
电极质量_____的一极
电极质量_____的一极
气体产生
产生气体的一极(通常为H2)
pH变化
pH增大的一极(析氢或吸氧的电极中)
【特别提示】 根据电极材料的活泼性来判断正负极,要注意电解质溶液对原电池正负极的影响。
例如,①Mg、Al、NaOH溶液构成的原电池,Al为负极;②Fe(或Al)、Cu、浓HNO3构成的原电池,Cu为负极。
例。
有如图所示的两个原电池装置,下列说法不正确的是( )
A.A池中负极的电极反应为Mg-2e-===Mg2+
B.Mg在A池中为负极,在B池中为正极
C.B池中电子的流向:
Mg→Al
D.原电池工作一段时间后,A池溶液的pH会增大
四.原电池原理的应用
1.加快_____________反应的速率
例如实验室用锌与稀H2SO4反应制H2,用粗锌时产生H2的速率会更快;在稀H2SO4中加入少量CuSO4溶液,同样也会加快产生H2的速率。
前者形成的原电池是锌稀H2SO4杂质金属,后者形成的原电池是锌稀H2SO4铜(铜单质是锌与Cu2+反应生成的)。
2.比较____________活动性强弱
例如:
有两种金属a和b,用导线连接后插入到稀H2SO4中,观察到a极溶解,b极上有气泡产生。
根据电极现象判断出a是负极,b是正极,由原电池原理可知,金属活动性a>b。
3.设计______________
构成原电池的基本条件,也是进行原电池设计的基本依据。
(1)根据电池反应写出电极反应式。
(2)电极材料的选择:
电池的电极必须导电。
一般电池中的负极必须能够与电解质溶液反应,容易失去电子,因此负极一般是活泼的金属材料。
正极和负极之间只有产生电势差,电子才能定向移动,所以正极和负极不能用同一种材料。
两个电极的构成分为四种情况:
①活动性不同的两种金属。
例如,铜锌原电池中,锌板作电池的负极,铜板作电池的正极。
②金属和非金属。
例如,锌锰干电池中,锌片作电池的负极,石墨棒作电池的正极。
③金属和化合物。
例如,铅蓄电池中,铅板作电池的负极,二氧化铅作电池的正极。
④惰性电极。
例如,氢氧燃料电池中,两电极均可用Pt。
(3)电解质溶液的选择:
电解质溶液是为负极提供放电的物质,因此电解质溶液一般要能够与负极发生反应。
但若是两个半反应分别在两个烧杯中进行,则负极中的电解质溶液应有与电极材料相同的阳离子。
例如:
在锌、铜和稀硫酸构成的原电池中,锌极应置于ZnSO4、ZnCl2、Zn(NO3)2等溶液中;正极材料置于稀硫酸中,稀硫酸还可以换成盐酸。
(4)形成闭合回路。
五.化学电源
一、)化学电池
1.化学电池是将 变成 的装置。
2.判断电池优劣的主要标准
(1)比能量:
即单位质量或单位体积所能 的多少,单位(W·h)/kg或(W·h)/L。
(2)比功率:
即单位质量或单位体积所能 的多少,单位W/kg或W/L。
(3)电池的 的长短。
二、)一次电池
一次电池的电解质溶液制成胶状,不流动,也叫做 。
活性物质消耗到一定程度,就不能使用了。
1.碱性锌锰电池
(1)基本构造:
负极:
,正极:
,电解质是:
。
(2)工作原理
负极:
_______________________;正极:
________________________;
总反应:
___________________________。
2.锌银电池
(1)基本构造:
负极:
,正极:
,电解质:
。
(2)工作原理:
负极:
___________________;正极:
_____________________;
总反应:
____________________。
3.锂电池
(1)电极材料
负极:
;正极:
、CuO、FeS2等。
(2)特点
、 、工作温度宽,可储存时间长。
三、)二次电池
二次电池放电后可以再充电使活性物质获得再生,又称 电池或 电池。
1.铅蓄电池的构造
负极:
,正极:
,电解质溶液:
溶液。
2.工作原理
(1)放电时
负极:
_______________________;正极:
_______________________;
总反应:
______________________。
放电后,H2SO4浓度_____,pH_____。
(2)充电时
铅蓄电池的充电反应是放电反应的逆过程。
阴极:
____________________;阳极:
_______________________;
总反应:
_______________________。
充电后,H2SO4浓度____,pH值____。
上述充放电反应可写成一个可逆反应方程式:
Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(l)
四)、燃料电池
1.燃料电池的工作原理
(1)连续地将 和 的化学能直接转换成电能。
(2)电极材料本身不参加氧化还原反应,只是一个催化转化元件。
(3)工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排除。
2.氢氧燃料电池
(1)构造:
以H2为燃料,O2为氧化剂,铂作电极,使用酸性电解质。
在负极室通入 ,在正极室通入 。
(2)工作原理:
负极:
__________________;正极:
______________________;
总反应:
H2+
O2=H2O。
3.燃料电池的优点
(1)能量转化率_____;
(2)污染____。
五)、废旧电池的处理
废弃电池中含有 金属和 等有害物质,随意丢弃,对 环境和 危害极大,应回收利用。
六).电极反应式的书写
1.根据给出的两个电极反应式写总反应式
书写时注意使两个电极反应式得失电子数相等后相加两式,消去反应物和生成物中相同的物质即可。
注意:
若反应式同侧出现不共存的离子,如H+和OH-、Pb2+和SO
,要写成反应后的物质,如H2O和PbSO4。
2.根据装置书写电极反应式
(1)先分析题目给定的图示装置,确定原电池的正负极上的反应物质。
(2)电极反应式的书写
①负极:
活泼金属或H2失去电子生成阳离子;若电解质溶液中的阴离子与生成的阳离子不共存,则该阴离子应写入负极反应式。
如铅蓄电池,负极:
Pb+SO
-2e-===PbSO4。
②正极:
阳离子得到电子生成单质或O2得到电子,若反应物是O2,则有以下规律:
电解质是碱性或中性:
__________________电解质是酸性:
___________________
(3)正负电极反应式相加得到电池反应的总反应方程式。
3.给出总反应式,写电极反应式
(1)根据给出的化学方程式或根据题意,确定原电池的正负极,弄清正、负极上发生反应的物质。
还原剂作负极或在负极上反应,氧化剂在正极上反应。
如将:
2FeCl3+Cu===2FeCl2+CuCl2设计成原电池时电极反应式的写法。
①写出总反应的离子方程式:
__________________________。
②用双线桥把总反应分成氧化反应和还原反应两部分:
③氧化反应在负极发生,还原反应在正极发生:
负极:
_____________________,正极:
______________________。
(2)弱电解质、气体或难溶物均以分子表示,其余以离子符号表示。
(3)注意电解质溶液的成分,对正极、负极反应产物的影响,正、负极产物可根据题意或据化学方程式确定。
碱性介质的电极反应中不能出现H+,酸性介质的电极反应中不能出现OH-,如:
氢氧燃料电池
①碱溶液作电解质溶液时,电极反应为
正极:
__________________________负极:
___________________________
②酸溶液作电解质溶液,则电极反应为:
正极:
____________________________负极:
____________________________
③高温下固体熔融盐作电解质时,也可能:
正极:
______________________________负极:
____________________________
(4)写电极反应式时要保证电荷守恒、元素守恒,可在电极反应式一端根据需要添加H+或OH-或H2O。
例。
固体氧化物燃料电池是由美国西屋公司研制开发的,它以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。
该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。
下列判断正确的是( )
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的正极
C.a极对应的电极反应:
O2+2H2O+4e-===4OH-
D.该电池的总反应:
2H2+O2
2H2O
六.电解池
一)、电解原理
1.电解
使电流通过而在两个电极上引起
的过程。
2.电解池
(1)定义:
将转化为的装置。
(2)构成
①。
②溶液或熔融。
③两个电极
阴极:
与电源相连的电极,发生反应;
阳极:
与电源相连的电极,发生反应。
④形成。
(3)装置
(4)电极反应式
阴极
Cu2++2e-===Cu,发生反应
阳极
2Cl--2e-===Cl2,发生反应
总反应
Cu2++2Cl-
Cu+Cl2↑
(5)电子流向
电源
电解池,电解池
原电池。
(6)离子移动方向,
阴离子(OH-、Cl-)―→阳极,阳离子(Cu2+、H+)―→阴极。
二)电极产物的判断
1.阳极产物的判断
阴离子放电顺序:
即:
活性阳极(金属)>无氧酸根离子>OH->含氧酸根离子。
在溶液中只考虑此部分
2.阴极产物的判断
与电极材料无关,直接根据阳离子放电顺序进行判断。
阳离子放电顺序:
【特别提示】 在溶液中含氧酸根离子不放电,常指最高价(中心原子)含氧酸根不放电,但非最高价(中心原子)含氧酸根的放电能力比OH-的强,如SO
、MnO
等。
三)电解离子方程式的书写
1.必须在短线上标明通电或电解。
2.只是电解质被分解,电解化学方程式中只写电解质及分解产物。
如:
电解CuCl2溶液:
Cu2++2Cl-
Cu+Cl2↑
3.只有水被分解,只写水分解即可。
如:
2H2O
2H2↑+O2↑
4.电解质、水同时被分解,则都要写进方程式,凡是水电离的H+或OH-放电时,在写电解的离子方程式时必须写水(弱电解质)如:
电解饱和食盐水:
_______________
____________
5.书写步骤
(1)判断阴、阳极,并分析电极材料的性质,尤其是阳极材料。
(2)分析电解质溶液中的离子类别,明确离子的来源及放电顺序。
(3)写出阴、阳极的电极反应式。
(4)根据电子得失守恒及原子守恒写出电解的总反应。
例.从SO
、Cl-、H+、Cu2+中选出合适的离子组成电解质,采用碳棒作电极对其水溶液进行电解:
(1)若使电解质含量减少但水量不变,可采用的电解质是________(写化学式或反应式,下同)。
(2)若使电解质和水量都减小,可采用的电解质是________,其阳极的电极反应为:
_________________________________,
其总反应方程式为:
________________________________
(3)若两极分别放出H2和O2,可采用的电解质是____________。
(4)若使两极分别放出气体,且体积比为1∶1,可采用的电解质是________,其阴极电极反应为___________________________。
七电解原理的应用
一)、氯碱工业
1.实验探究
在U形管中放入饱和食盐水,并在两极滴入酚酞试液,用惰性电极通电电解一段时间:
(1)在阳极比易电子,电极产物是,可用检验;
在阴极比易电子,电极产物是。
(2)极附近溶液变红色,原因是(从水的电离平衡解释),使浓度逐渐增大。
2.电极反应式
阳极:
2Cl--2e-===Cl2↑,发生反应;
阴极:
2H++2e-===H2↑,发生发生。
3.总反应的化学方程式:
2NaCl+2H2O
2NaOH+Cl2↑+H2↑。
离子方程式:
2Cl-+2H2O
Cl2↑+H2↑+2OH-。
二)、电镀
电镀是应用原理在某些金属表面镀上一薄层其他金属或合金的方法。
1.电镀池的构成
(1)阳极材料:
金属;
(2)阴极材料:
金属;
(3)电镀液:
含金属离子的溶液;
(4)外加电源:
直流电源。
2.电镀目的:
使金属增强能力,增加和。
3.实例:
在金属铁上镀铜
(1)铁接电源的极作极,
电极反应:
Cu2++2e-===Cu。
(2)铜接电源的极作极,电极反应
Cu-2e-===Cu2+。
(3)可选用溶液作电镀液。
三)、电解精炼铜
1.粗铜(含Fe、Zn、Ag、Au等杂质)
作极,主要反应有:
____________;__________________;_____________________.
2.精铜作极:
电极反应式为Cu2++2e-===Cu。
3.可选用溶液作电解液。
4.特点:
阳极粗铜中的铜(以及比铜活泼的锌、铁、镍等)被氧化,阴极被还原;其他留在溶液中,而比铜活泼性弱的等金属沉积在阳极下面,形成阳极泥。
电解液的浓度会逐渐。
四)、电冶金
1.金属冶炼:
金属冶炼就是使矿石中的金属离子电子,从它们的化合物中还原出来,其实质可表示为:
Mn++ne-===M。
2.电冶金
(1)电解熔融的氯化钠
阳极反应:
________________;阴极反应:
_________________;
总反应:
2NaCl(熔融)
2Na+Cl2↑。
(2)电解熔融的氧化铝冶炼金属铝
阴极反应:
___________________;阳极反应:
_____________________;
总反应:
_______________________。
五).电解计算
1.有关电解的计算通常是求电解后产物的质量、气体的体积,某元素的化合价以及溶液的pH、物质的量浓度等。
2.解答此类题的依据是根据电解方程式或电极反应式,应用阴、阳两极得失电子守恒进行有关的计算。
也可利用物质的量的相当量关系(常由电子得失守恒得出)求解,如H2~Cl2~
O2~Cu~2Ag~2H+~2OH-。
特别提示
(1)对阴极放H2生碱型,电路中每通过1mol电子,溶液中就生成1molOH-,对阳极放O2生酸型,电路中每通过1mol电子,阳极溶液就生成1molH+。
例1、用两支惰性电极插入500mLAgNO3溶液中,通电电解。
当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是( )
A.27mg B.54mg
C.108mgD.216mg
2.在100mLH2SO4和CuSO4的混合溶液中,用石墨作电极电解,两极均收集到2.24L气体(标准状况下),则原混合溶液中Cu2+的物质的量浓度为( )
A.1mol·L-1B.2mol·L-1
C.3mol·L-1D.4mol·L-1
3.某学生为达到制取并较长时间保存Fe(OH)2的目的,设计如下两个实验装置:
(1)欲使试管B中产生Fe(OH)2白色沉淀,则试管A中加入的药品是( )
A.FeO和稀硫酸B.铁锈和稀硫酸
C.铁粉和稀硫酸D.铁粉和稀硝酸
(2)在试管A中加入药品后,应继续进行的操作是____________。
(3)使用装置①进行实验,试管B中的空气不易排尽,其原因是____________________。
(4)装置②是电解池,欲在烧杯内产生Fe(OH)2白色沉淀,则阳极材料应是( )
A.石墨B.铁
C.铜D.铂
(5)装置②中的电解质溶液可以选用( )
A.NaCl溶液B.Na2SO4溶液
C.FeCl3溶液D.稀硫酸
(6)装置②中发生反应的化学方程式是________________。
(7)装置②中苯的作用是_________________________________
八.金属的电化学腐蚀与防护
一)、金属的电化学腐蚀
1.金属腐蚀
(1)概念:
金属或合金与周围的气体或液体物质发生反应而引起损耗的现象。
(2)实质:
金属腐蚀的本质是金属原子电子,发生反应。
(3)分类:
一般有化学腐蚀和电化学腐蚀两种,其中腐蚀是金属腐蚀的主要原因。
2.化学腐蚀
金属跟接触到的(如O2、Cl2、SO3等)或
液体等直接发生化学反应而引起的腐蚀,化学腐蚀的速度随温度升高而。
3.电化学腐蚀
(1)概念:
不纯的金属跟溶液接触时,会发生原电池反应,比较活泼的金属电子而被。
(2)实质:
在潮湿的空气里,钢铁的表面形成了一层电解质溶液的薄膜,它跟钢铁里的铁和少量的碳恰好构成了原电池。
其中,Fe是极,碳是极。
(3)析氢腐蚀和吸氧腐蚀
①析氢腐蚀:
金属表面的电解质溶液性较强,腐蚀过程中有放出。
负极反应:
_________;
正极反应:
________________。
总反应:
_____________________
②吸氧腐蚀:
钢铁表面吸附的水膜或呈性时,参加电极反应,发生吸氧腐蚀。
电极反应如下:
图
(2)
负极:
;正极:
;
总反应:
。
生成的Fe(OH)2继续与空气中的O2作用,生成Fe(OH)3,反应如下:
___________
Fe(OH)3脱去一部分水生成Fe2O3·xH2O,即铁锈的主要成分,铁锈疏松地覆盖在钢铁表面,不能阻止钢铁腐蚀。
特别提示 金属的电化学腐蚀主要是吸氧腐蚀。
4.钢铁生锈原理的实验探究
(1)实验目的:
。
(2)实验步骤:
将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,放入如图
(2)所示的具支试管中。
几分钟后,观察导管中水柱的变化。
二)金属腐蚀快慢的判断以及金属的防护
1.金属腐蚀快慢的判断方法
(1)在同一电解质溶液中:
电解池原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
(2)同一种金属在相同浓度不同介质中腐蚀由快到慢的顺序为:
强电解质溶液>弱电解质溶液>非电解质溶液。
(3)有无保护措施的腐蚀快慢顺序:
无保护措施的金属腐蚀>有一定保护措施的金属腐蚀>牺牲阳极的阴极保护法引起的金属腐蚀>有外加电流的阴极保护法引起的金属腐蚀。
(4)对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
2.金属的防护方法
(1)改变金属的内部结构
例如:
把铬、镍等加入普通钢里制成的不锈钢,就大大地增加了钢铁对各种腐蚀的抵抗力。
(2)在金属表面覆盖保护层
在金属表面覆盖致密的保护层,从而使金属制品跟周围物质隔离开来,覆盖保护层的方法有以下几种:
①在表面涂抹油脂、油漆等。
②用电镀、热镀、喷镀的方法,在金属表面镀上一层不易被腐蚀的金属,如在钢铁表面镀锌、锡、铬、镍等。
③用化学方法使金属表面生成一层致密而稳定的氧化膜。
例如,工业上常借一些溶液的氧化作用,在机器零件、精密仪器、枪炮等钢铁制件的表面上形成一层致密的黑色的四氧化三铁薄膜。
(3)电化学保护法
①牺牲阳极的阴极保护法
将还原性较强的金属作为保护极与被保护金属相连构成原电池,还原性较强的金属将作为负极发生氧化反应而被损耗,被保护金属作为正极就可以避免被腐蚀。
这种保护法牺牲了阳极保护了阴极。
如
②外加电流的阴极保护法
将被保护金属与外加直流电源的负极相连让其成为阴极,而将外加直流电源的正极接到惰性电极上,让其成为阳极。
章末检测
一、单项选择题(16×3分=48分)
1.下列图示中关于铜电极的连接错误的是( )
2.在理论上不能用于设计成原电池的化学反应是( )
A.4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH<0
B.CH3CH2OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH<0
C.Al(OH)3(s)+NaOH(aq)===NaAlO2(aq)+2H2O① ΔH<0
D.H2(g)+Cl2(g)=