试剂试液的管理文件.docx
《试剂试液的管理文件.docx》由会员分享,可在线阅读,更多相关《试剂试液的管理文件.docx(8页珍藏版)》请在冰豆网上搜索。
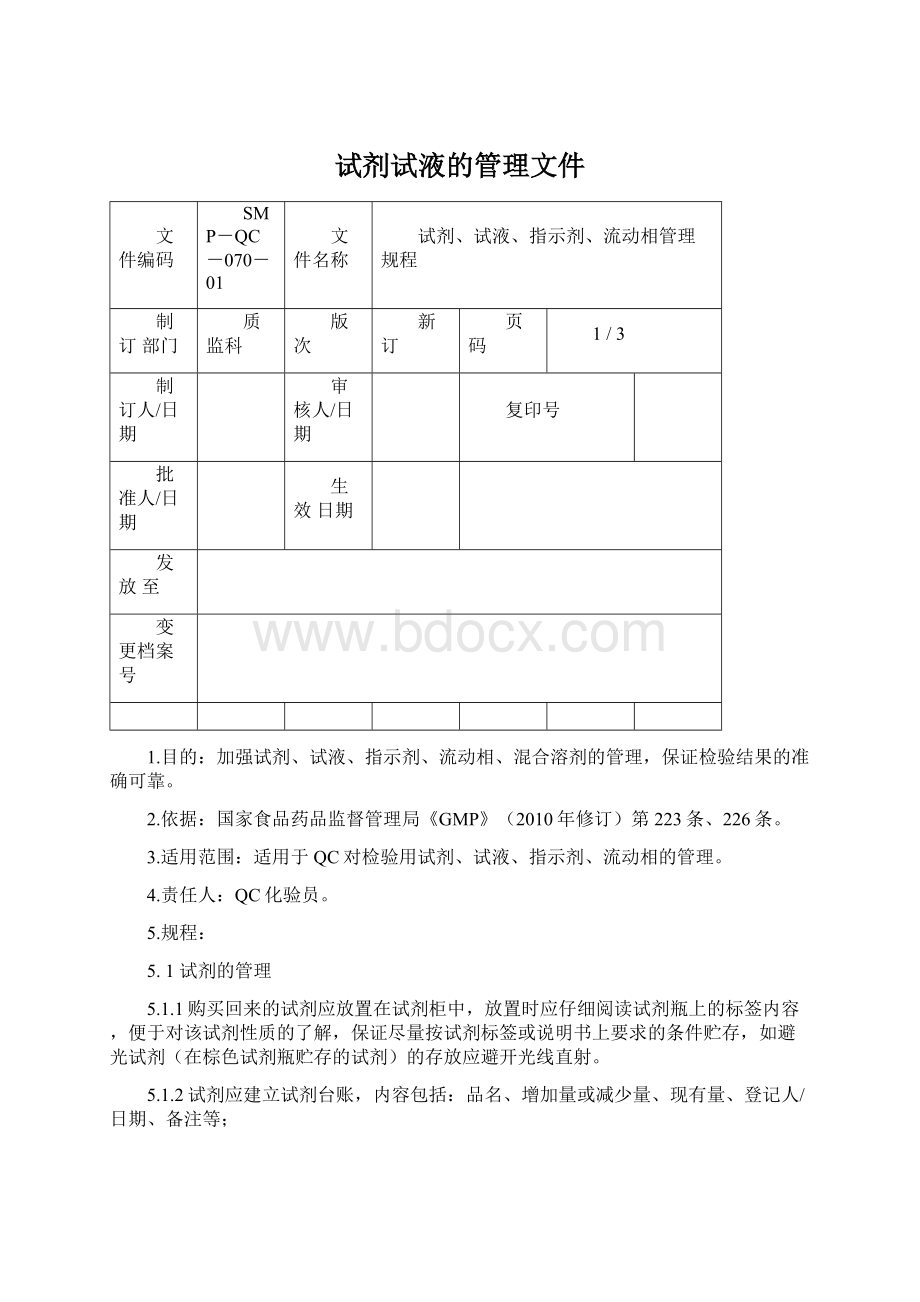
试剂试液的管理文件
文件编码
SMP-QC-070-01
文件名称
试剂、试液、指示剂、流动相管理规程
制订部门
质监科
版次
新订
页码
1/3
制订人/日期
审核人/日期
复印号
批准人/日期
生效日期
发放至
变更档案号
1.目的:
加强试剂、试液、指示剂、流动相、混合溶剂的管理,保证检验结果的准确可靠。
2.依据:
国家食品药品监督管理局《GMP》(2010年修订)第223条、226条。
3.适用范围:
适用于QC对检验用试剂、试液、指示剂、流动相的管理。
4.责任人:
QC化验员。
5.规程:
5.1试剂的管理
5.1.1购买回来的试剂应放置在试剂柜中,放置时应仔细阅读试剂瓶上的标签内容,便于对该试剂性质的了解,保证尽量按试剂标签或说明书上要求的条件贮存,如避光试剂(在棕色试剂瓶贮存的试剂)的存放应避开光线直射。
5.1.2试剂应建立试剂台账,内容包括:
品名、增加量或减少量、现有量、登记人/日期、备注等;
品名应与试剂标签上的一致,数量以单元包装进行登记,当单元包装数量增加或减少时应进行登记,现存量为增加或减少后的数量。
5.1.3试剂应根据其性质摆放,固体试剂与液体试剂应分开存放;强氧化剂与强还原剂应分开存放
放,强酸与强碱试剂应分开存放等。
5.1.4为保证原试剂不被污染,使用固体试剂时,应用洁净的牛角匙或不锈钢匙从瓶中取用,液体试剂可用洁净的量筒量取,不可用吸管直接插入原试剂瓶中吸取。
凡取出的试剂不允许再倒回原试剂瓶中,取用完毕后要及时盖紧瓶塞。
5.1.5试剂开口时应于试剂瓶标签的左上方贴上绿色开口标签,标明开口日期、开口人、有效期至。
5.1.6试剂开口后有内塞的不要将内塞丢弃,用后加内塞、外盖密封保存,防止潮解或挥发。
5.2试液、指示剂的管理
5.2.1检验用试液、指示剂的配制一般用分析纯试剂。
5.2.2试液、指示剂的配制应有记录,记录中应标明品名、配制编号、配制日期、有效期、温度/相对湿度、方法依据、配制方法、配制人、复核人,所用到的试剂名称(包括纯化水)、生产厂家及批号、效期。
5.2.3试液、指示剂瓶上应贴标签,注明品名、试剂名称、配制编号、配制日期、有效期至、填写人,其位置以瓶底部为基线贴签,如需要简单说明的内容,可在品名后写明。
5.2.4配制好的试液、指示剂应存放于合适的容器内,如见光易分解的应存放于棕色瓶中,试液存
文件编码
SMP-QC-070-01
文件名称
试剂、试液、指示剂、流动相管理规程
页码
2/3
放在细口瓶中,液体指示剂存放在滴瓶中,固体指示剂存放在广口瓶中,强碱性溶液存放在塑料瓶中,有特殊要求的也应按规定存放。
5.3流动相的管理:
5.3.1HPLC流动相所用的试剂是色谱纯,至少用分析纯,系统用水作流动相时,必须用新鲜的纯化水或超纯水。
TLC流动相所用的试剂一般是分析纯试剂。
5.3.2流动相配制应有记录,记录中标明配制编号、配制日期、有效期至、温度/相对湿度、方法依据、配制方法、配制人、复核人,所用到的试剂名称(包括纯化水)、生产厂家及批号、有效期至。
5.3.3流动相瓶上应贴标签,注明品名、试剂名称、配比、配制编号、配制日期、有效期至、填写人。
标签贴于瓶上,其位置以瓶底部为基线贴签。
5.3.4用于TLC检测用的流动相应存放在棕色细口瓶中,其它用的流动相应存放在细口瓶或液体试剂瓶中。
瓶子应加盖密封保存,防止挥发。
有特殊要求的按规定存放。
5.3.5其它要求
5.3.5.1HPLC流动相所用的各试剂分别用同系的0.45um的微孔滤膜过滤,将已过滤的试剂分别按规定配制,摇匀,于超声波中脱气15分钟。
5.3.5.2HPLC流动相按药典标准规定的配比制备好后,如需调节流动相配比,应记录调配过程。
5.3.5.3HPLC流动相更换时,两种易混合的溶剂可以直接更换,不互溶的必须使用一种中间试剂进行过渡。
5.3.5.4TLC流动相依据药典标准及验证方法,按规定的试剂比例量取配制。
5.4检验时样品溶液的管理:
检验时样品溶液的制备,应按所对应的检验操作规程或文件规定的方法配制,在进行多个样品进行检测时,应在溶液瓶上合适的位置粘贴样品标识,至少包括品名、批号、平行号等,防止混淆、差错。
5.5有效期的规定:
5.5.1试剂的有效期:
厂家明确规定有有效期的按厂家规定的有效期执行。
5.5.1试液、指示剂有效期:
除另有规定外,
★物理、化学性质等比较稳定的有效期为12个月。
★物理、化学性质等比较容易发生变化的试液、指示剂,根据目前使用的试液、指示剂如用乙醇作溶剂配制的试液和指示剂、用于非水滴定用的结晶紫指示剂、氨试液、硝酸银试液、碘试液、氢氧化钙试液等有效期为6个月。
★标准缓冲液有效期为3个月。
★淀粉指示剂临用前新配。
★微生物用的消毒剂如75%乙醇、0.1%新洁尔灭、3%~5%来苏水有效期为1周。
文件编码
SMP-QC-070-01
文件名称
试剂、试液、指示剂、流动相管理规程
页码
3/3
5.5.2纯化水用于检验用配制试剂、试液的有效期为7天,以纯化水的生产日期算起。
5.5.2流动相和HPLC冲洗柱的有效期为15天,含盐流动相当天配制和使用(24小时内有效)。
5.5.4检验时样品溶液的有效期:
除有稳定数据支持外,样品溶液制备后应及时进行检验,以当天制备当天检验为宜。
5.5.5检验用试纸的有效期或保质期:
以厂家标签上的为准。
开口后的试纸应用夹链袋密封保护,避免酸碱、有机溶剂挥发气体对试纸产生负面影响。
5.5.6对于特殊的试剂、试液等根据实际情况进行评估后确定其有效期。
5.6配制编号的管理
配制编号由“四位年号+两位月号+三位流水号”组成,如2012年9月配制的第21个试液的配制编号即为20120921。
5.7注意事项
5.7.1所用试剂为易挥发、有毒性的试剂,使用时应增强保护意识,保持室内通风,确保安全。
5.7.2使用后的流动相、试剂、试液、指示剂等废液,按类分别收集、处理。
5.7.3在放置过程中如发现试剂、试液等有结晶析出(饱和溶液除外)、沉淀产生、颜色发生改变等异常情况应停止使用。
5.8标签的管理
标签的内容、格式及大小见该文件的附录3.
6.附件:
SMP-QC-070-01附录1流动相配制记录新订
SMP-QC-070-01附录2指示剂、试液配制记录新订
SMP-QC-070-01附录3标签样张新订
SMP-QC-070-01附录4试剂接收、管理台帐新订
流动相配制记录
编号:
SMP-QC-070-01附录1版次:
新订
配制编号
配制日期
有效期至
室温/相对湿度
检验品种
所用试剂
配制方法如下:
序号
名称
批号
生产厂家
加
混合均匀,超声脱气15分钟,即得。
1
2
3
4
5
6
7
8
9
10
11
配制人:
复核人:
试液配制记录
编号:
SMP-QC-070-01附录2版次:
新订
品名
配制编号
配制日期
有效期至
依据
配制方法如下:
配制人:
复核人:
所用试剂名称
批号
生产厂家
品名
配制编号
有效期至
配制日期
依据:
配制方法如下:
配制人:
复核人:
所用试剂名称
批号
生产厂家
试剂、指示剂、试液、流动相标签样张
编号:
SMP-QC-070-01附录3版次:
新订
试液、指示剂、流动相标签
规格:
横长约4cm,竖长约5cm
品名:
配制编号:
配制日期:
有效期至:
填写人:
流动相
试剂名称:
配比:
配制编号:
配制日期:
有效期至:
填写人:
试剂台账
编号:
SMP-QC-070-01附录4版次:
新订
品名
规格
批号
级别
数量
登记人
登记日期
备注
试剂领用记录
编号:
SMP-QC-070-01附录5版次:
新订
品名
规格
批号
级别
领用日期
领用数量
领用人
备注
试剂台账
海南制药厂有限公司制药一厂
试剂领用记录
海南制药厂有限公司制药一厂