高中化学硫及其化合物知识点总结.docx
《高中化学硫及其化合物知识点总结.docx》由会员分享,可在线阅读,更多相关《高中化学硫及其化合物知识点总结.docx(25页珍藏版)》请在冰豆网上搜索。
高中化学硫及其化合物知识点总结
高中化学硫及其化合物知识点总结
一、选择题
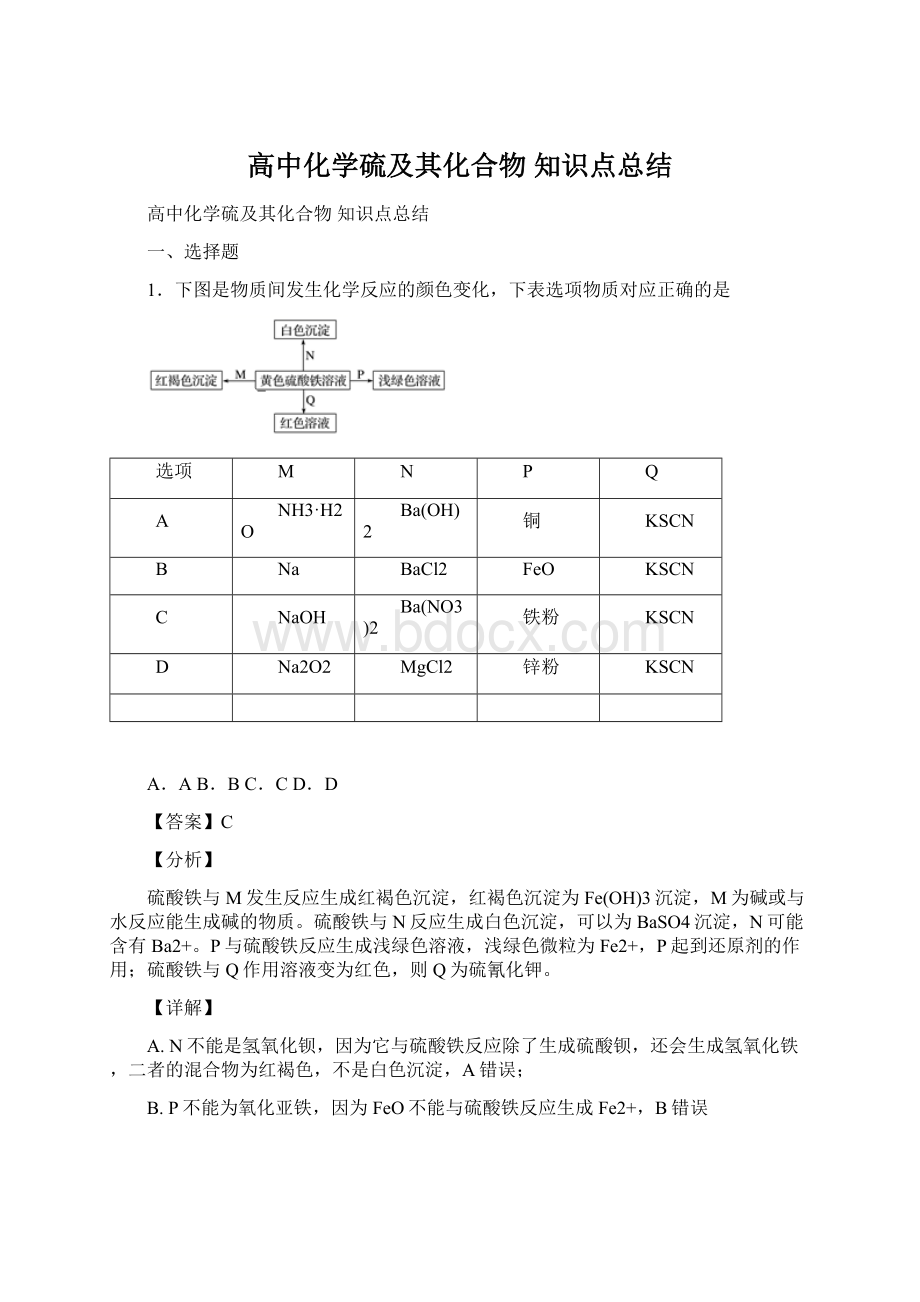
1.下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
选项
M
N
P
Q
A
NH3·H2O
Ba(OH)2
铜
KSCN
B
Na
BaCl2
FeO
KSCN
C
NaOH
Ba(NO3)2
铁粉
KSCN
D
Na2O2
MgCl2
锌粉
KSCN
A.AB.BC.CD.D
【答案】C
【分析】
硫酸铁与M发生反应生成红褐色沉淀,红褐色沉淀为Fe(OH)3沉淀,M为碱或与水反应能生成碱的物质。
硫酸铁与N反应生成白色沉淀,可以为BaSO4沉淀,N可能含有Ba2+。
P与硫酸铁反应生成浅绿色溶液,浅绿色微粒为Fe2+,P起到还原剂的作用;硫酸铁与Q作用溶液变为红色,则Q为硫氰化钾。
【详解】
A.N不能是氢氧化钡,因为它与硫酸铁反应除了生成硫酸钡,还会生成氢氧化铁,二者的混合物为红褐色,不是白色沉淀,A错误;
B.P不能为氧化亚铁,因为FeO不能与硫酸铁反应生成Fe2+,B错误
C.M若为NaOH,与硫酸铁反应生成Fe(OH)3红褐色沉淀;N若为硝酸钡,与硫酸铁反应生成BaSO4白色沉淀;P若为铁粉,还原+3价的Fe3+为+2价的Fe2+,C正确;
D.N不能为氯化镁,它不能与硫酸铁反应生成白色沉淀,D错误;
故合理选项是C。
【点睛】
本题考查了有关铁元素的化学反应,注意各种物质之间的化学反应及常见物质的颜色及溶解性。
2.下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项
陈述Ⅰ
陈述Ⅱ
A
Fe3+有氧化性
FeCl3溶液可用于回收废旧电路板中的铜
B
SiO2有导电性
SiO2可用于制备光导纤维
C
SO2有漂白性
SO2可使溴水褪色
D
浓硫酸有强氧化性
浓硫酸可用于干燥H2和CO
A.AB.BC.CD.D
【答案】A
【详解】
A.由于Fe3+有氧化性,可以与铜反应,故FeCl3溶液可用于回收废旧电路板中的铜,A正确;
B.二氧化硅没有导电性,其可作光导纤维是由于其对光的创导,B错误;
C.SO2可使溴水褪色是因为其还原性,C错误;
D.浓硫酸具有吸水性,故浓硫酸可用于干燥H2和CO,D错误;
故答案选A。
3.下列四种有色溶液与SO2气体作用,其实质相同的是()
①酸性高锰酸钾溶液;②品红溶液;③溴水;④滴有酚酞的氢氧化钠溶液;
A.②③B.①③C.①④D.②④
【答案】B
【详解】
①酸性高锰酸钾溶液与二氧化硫反应发生氧化还原反应,体现二氧化硫的还原性;
②品红溶液与二氧化硫发生非氧化还原反应生成无色的物质,体现二氧化硫的漂白性;
③溴水与二氧化硫反应发生氧化还原反应,体现二氧化硫的还原性;
④滴有酚酞的氢氧化钠溶液与二氧化硫反应生成亚硫酸钠和水,体现二氧化硫的酸性;
综上所述,①③反应原理相同,答案为B。
4.如图是硫酸试剂瓶标签上的部分内容。
据此下列说法中正确的是( )
硫酸 化学纯(CP)(500mL)
品名:
硫酸
化学式:
H2SO4
相对分子质量:
98
密度:
1.84g·cm-3
质量分数:
98%
A.该硫酸的物质的量浓度18.0mol·L-1
B.1molZn与足量的该硫酸反应能产生22.4LH2
C.配制230mL4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗
【答案】C
【详解】
A.该硫酸的物质的量浓度为==18.4mol/L,故A错误;
B.18.4mol/L的硫酸为浓硫酸,浓硫酸与Zn反应生成二氧化硫,不会生成氢气,故B错误;
C.配制230mL4.6mol·L-1的稀硫酸需要选取250mL容量瓶,设需浓硫酸的体积为V,根据稀释定律,稀释前后溶质硫酸的物质的量不变,则250mL×4.6mol•L-1=V×18.4mol/L,解得V=62.5mL,故C正确;
D.NaOH溶液具有强腐蚀性,会腐蚀皮肤,若不小心将该硫酸溅到皮肤上,应该用水冲洗后,再用稀的碳酸氢钠溶液涂抹,故D错误;
故选C。
5.下列说法正确的是
A.新制氯水能使品红溶液褪色,说明Cl2具有漂白性
B.富含硫单质的矿物在工业上可用于制造硫酸
C.硫粉在过量的纯氧中燃烧可以生成大量的SO3
D.常温时将Fe片放入浓硫酸,无明显现象是因为Fe和浓硫酸不反应
【答案】B
【详解】
A.新制氯水能使品红溶液褪色,只能说明氯水中某种成分具有漂白性,不能肯定Cl2表现出漂白性,A错误;
B.富含硫单质的矿物,比如硫磺粉,在工业上可用于制造硫酸,B正确;
C.硫粉在过量的纯氧中燃烧可以生成大量的SO2,但不能直接生成SO3,C错误;
D.常温时将Fe片放入浓硫酸,无明显现象是因为Fe和浓硫酸反应,生成的钝化膜阻止了反应的进行,D错误。
故选B。
6.下列反应中,硫酸既表现了氧化性又表现了酸性的是( )
A.2H2SO4(浓)+CuCuSO4+2H2O+SO2↑
B.2H2SO4(浓)+CCO2↑+2H2O+2SO2↑
C.H2SO4(浓)+NaNO3NaHSO4+HNO3↑
D.H2SO4+Na2SO3===Na2SO4+H2O+SO2↑
【答案】A
【详解】
A.在2H2SO4(浓)+CuCuSO4+2H2O+SO2↑中,硫元素的化合价部分降低,部分不变,则浓硫酸既表现强氧化性又表现酸性,故A正确;
B.在2H2SO4(浓)+CCO2↑+2H2O+2SO2↑中,硫元素的化合价全部降低,则浓硫酸只表现强氧化性,故B错误;
C.在H2SO4(浓)+NaNO3NaHSO4+HNO3↑中,硫元素化合价没有改变,体现浓硫酸是难挥发性酸,故C错误;
D.在H2SO4+Na2SO3===Na2SO4+H2O+SO2↑中,硫元素化合价没有改变,体现浓硫酸是强酸,故D错误;
故答案为A。
【点睛】
结合反应原理,依据元素化合价的变化,准确判断浓硫酸的性质是解题关键,浓硫酸在化学反应中,若硫元素的化合价降低(有二氧化硫生成),浓硫酸表现强氧化性;若硫元素的化合价不变(仍为+6价,以硫酸根形式存在),浓硫酸表现酸性。
7.下列关于金属的说法正确的是( )
A.金属单质在氧化还原反应中常作还原剂
B.金属在加热条件下都易与氧气反应
C.加热条件下铜与硫蒸气反应生成硫化铜
D.铁丝能在氯气中燃烧生成氯化亚铁
【答案】A
【详解】
A、金属元素的最低价为0价,金属单质在氧化还原反应中化合价升高,作还原剂,故A正确;
B、金、铂等不活泼金属在加热条件不易与氧气反应,故B错误;
C、硫的氧化性弱,加热条件下铜与硫蒸气反应生成硫化亚铜,故C错误;
D、氯气的氧化性强,铁丝能在氯气中燃烧生成氯化铁,故D错误。
8.下列有关实验操作、现象和解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
将水蒸气通过灼热的铁粉
粉末变红
铁与水在高温下发生反应
B
将Na投入到CuSO4溶液中
生成气体,并有固体产生
气体是H2,固体是Cu
C
将SO2通入滴有酚酞的氨水中
溶液红色褪去
SO2是酸性氧化物
D
向某溶液中先加入少量BaCl2溶液,再加入足量盐酸
产生白色沉淀
原溶液是硫酸溶液
A.AB.BC.CD.D
【答案】C
【详解】
A.将水蒸气通过灼热的铁粉,反应生成黑色的四氧化三铁固体,说明铁在高温下和水反应,故A错误;
B.将Na投入到CuSO4溶液中,钠先与水反应生成氢氧化钠和氢气,氢氧化钠与硫酸铜反应生成硫酸钠和氢氧化铜沉淀,故B错误
C.二氧化硫是酸性氧化物,能与氢氧化钠反应生成亚硫酸钠或亚硫酸氢钠,碱性减弱,红色褪去,与漂白性无关,体现二氧化硫是酸性氧化物,故正确;
D.先加氯化钡溶液,后加稀盐酸有白色沉淀生成,原溶液中可能存在Ag+,故D错误;
故选:
C。
【点睛】
检验硫酸根离子,先滴加盐酸没有现象,再滴加氯化钡溶液,出现白色沉淀,滴加的顺序不能颠倒。
9.下列关于物质的检验说法不正确的是()
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸沉淀不消失,一定含有
B.观察钾元素焰色反应的操作是:
将铂丝用稀盐酸洗涤后灼烧至火焰为无色,然后再用铂丝蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有
D.待检液加入氯化钡溶液有白色沉淀生成,再加入足量盐酸沉淀消失且产生无色无味的气体,则待检液中一定含有
【答案】A
【详解】
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸沉淀不消失,可能含有,还可能含有SO32-被硝酸氧化成,所以A错误;
B.观察钾元素焰色反应的操作是:
将铂丝用稀盐酸洗涤后灼烧至火焰为无色,然后再用铂丝蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察,如果火焰呈紫色,说明含有钾元素,故正确;
C.加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,说明有NH3产生,则原溶液中一定含有,故C正确;
D.待检液加入氯化钡溶液有白色沉淀生成,再加入足量盐酸沉淀消失且产生无色无味的CO2气体,则待检液中一定含有,故D正确;
答案:
A。
【点睛】
根据离子鉴别方法进行分析。
要鉴别先加入稀盐酸排除干扰离子;要鉴别选择强碱和湿润的红色石蕊试纸;要鉴别需加入氯化钡溶液有白色沉淀生成,再加入足量盐酸沉淀消失且产生无色无味的气体。
10.下列说法正确的是
A.可用澄清石灰水鉴别二氧化硫和二氧化碳
B.将二氧化硫通入氯化钡溶液中无明显现象,不断振荡,溶液变浑浊
C.工业上或实验室用亚硫酸钠固体与稀硫酸反应制备二氧化硫
D.二氧化硫能使含酚酞的氢氧化钠溶液褪色,体现了其漂白性
【答案】C
【详解】
A.二氧化硫和二氧化碳均为酸性氧化物,均可使石灰水变浑浊,现象相同,不能鉴别,故A错误;
B.二氧化硫与氯化钡溶液不反应,振荡,溶液不会变浑浊,故B错误;
C.亚硫酸钠与稀硫酸反应生成硫酸钠、二氧化硫和水,则实验室用亚硫酸钠与稀硫酸反应制备二氧化硫,故C正确;
D.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了酸性氧化物的性质,与漂白性无关,故D错误;
故选:
C。
11.CuSO4•5H2O在不同温度下分解情况不同,取5.00g该晶体在密闭容器中进行实验,测得分解后剩余固体质量与温度关系如图,下列说法不正确的是()
A.113℃分解得到的固体产物为CuSO4•H2O
B.温度低于650℃时的分解反应,均不属于氧化还原反应
C.650℃时的气态产物冷却至室温,可得组成为n(H2SO4):
n(H2O)=1:
4的硫酸溶液
D.1000℃分解得到的固体产物为CuO
【答案】D
【分析】
n(CuSO4•5H2O)==0.02mol,CuSO4•5H2O完全失去结晶水时,所得CuSO4的质量为0.02mol×160g/mol=3.20g,由图中可知,刚好位于温度在258~650℃之间,说明在此之前,胆矾受热分解,只失去结晶水;650~1000℃之间,固体质量为1.60g,其中Cu元素的质量为0.02mol×64g/mol=1.28g,则氧元素质量为1.60g-1.28g=0.32g,物质的量为=0.02mol,此固体为CuO;1000℃之后,固体质量为1.44g,其中Cu元素质量为1.28g,则氧元素质量为1.44g-1.28g=0.16g,物质的量为=0.01mol,此固体为Cu2O。
【详解】
A.113℃时,固体质量为3.5