高考化学知识点化学反应与能量变化.docx
《高考化学知识点化学反应与能量变化.docx》由会员分享,可在线阅读,更多相关《高考化学知识点化学反应与能量变化.docx(11页珍藏版)》请在冰豆网上搜索。
高考化学知识点化学反应与能量变化
高考化学知识点:
化学反应与能量变化
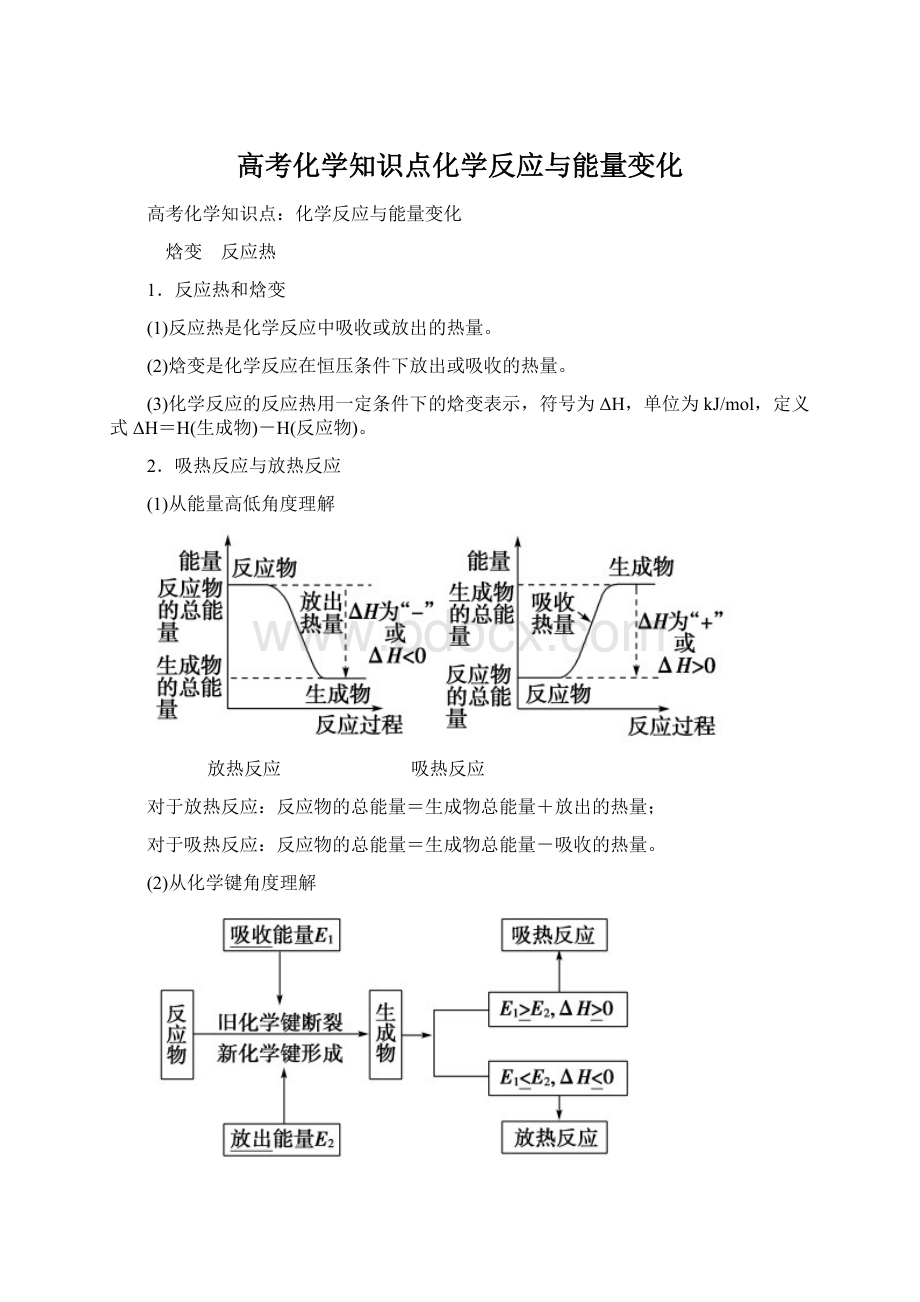
焓变 反应热
1.反应热和焓变
(1)反应热是化学反应中吸收或放出的热量。
(2)焓变是化学反应在恒压条件下放出或吸收的热量。
(3)化学反应的反应热用一定条件下的焓变表示,符号为ΔH,单位为kJ/mol,定义式ΔH=H(生成物)-H(反应物)。
2.吸热反应与放热反应
(1)从能量高低角度理解
放热反应 吸热反应
对于放热反应:
反应物的总能量=生成物总能量+放出的热量;
对于吸热反应:
反应物的总能量=生成物总能量-吸收的热量。
(2)从化学键角度理解
热化学方程式
1.定义
表示参加反应物质的量和反应热的关系的化学方程式。
2.意义
热化学方程式不仅能够表明化学反应中的物质变化,也能表明化学反应中的能量变化。
如2H2(g)+O2(g)===2H2O(l) ΔH=-571.6kJ·mol-1:
表示在25℃、101kPa条件下,2_mol_H2(g)和1_mol_O2(g)生成2_mol_H2O(l)时放出571.6_kJ的热量。
3.热化学方程式中化学计量数只表示物质的物质的量,化学计量数增大1倍则反应热也增大1倍。
1.易误诊断(正确的打“√”,错误的打“×”)。
(1)伴随着能量变化的物质变化都是化学变化( )
(2)化学变化中的能量变化都是化学能和热能间的相互转化( )
(3)C(石墨,s)===C(金刚石,s) ΔH>0,说明石墨比金刚石稳定( )
(4)2H2O(l)===2H2(g)+O2(g)的焓变ΔH>0( )
(5)所有的燃烧反应都是放热反应,所以不需要加热就能进行( )
(6)反应物的总能量低于生成物的总能量时,一定不能发生反应( )
(7)H2(g)+
O2(g)===H2O(l) ΔH1和2H2(g)+O2(g)===2H2O(l) ΔH2中的ΔH1=ΔH2( )
(8)H2(g)+
O2(g)===H2O(g) ΔH1和H2O(g)===H2(g)+
O2(g) ΔH2中的ΔH1=ΔH2( )
【答案】
(1)×
(2)× (3)√ (4)√ (5)× (6)× (7)× (8)×
2.
(1)1molCO气体完全燃烧生成CO2气体,放出283kJ的热量,其热化学方程式为__________________。
(2)1gH2气体完全燃烧生成液态水放出143kJ热量,其热化学方程式为__________________________。
(3)已知H2(g)+
O2(g)===H2O(l)
ΔH=-285.8kJ/mol,
则①2H2(g)+O2(g)===2H2O(l)的ΔH=________,
②H2O(l)===H2(g)+
O2(g)的ΔH=________。
【答案】
(1)CO(g)+
O2(g)===CO2(g)
ΔH=-283kJ/mol
(2)H2(g)+
O2(g)===H2O(l) ΔH=-286kJ/mol
(3)①-571.6kJ/mol ②+285.8kJ/mol
2个物质能量与反应吸、放热之间的关系:
(1)E反应物>E生成物,放热反应,ΔH<0。
(2)E反应物<E生成物,吸热反应,ΔH>0。
3点热化学方程式书写、判断的注意事项:
(1)注意标明物质的聚集状态。
(2)注意ΔH的符号与单位。
(3)注意ΔH的数值与计量数是否对应。
4种放热反应:
(1)大多数化合反应
(2)所有的燃烧反应
(3)酸碱中和反应
(4)金属与酸的反应
4种吸热反应:
(1)大多数分解反应
(2)盐的水解
(3)Ba(OH)2·8H2O与NH4Cl的反应
(4)C和CO2、C和H2O(g)的反应
焓变及其基本计算
1.焓变的原因
类型
比较
放热反应
吸热反应
反应物总能量与生成物总能量的相对大小
E反应物>E生成物
E反应物<E生成物
与化学键的关系
生成物分子成键时释放出的总能量大于反应物分子断键时吸收的总能量
生成物分子成键时释放出的总能量小于反应物分子断键时吸收的总能量
ΔH的符号
ΔH<0(“-”号)
ΔH>0(“+”号)
反应过程图示
2.焓变的基本计算
(1)根据物质具有的能量来计算
ΔH=E(总生成物)-E(总反应物)=H(生成物)-H(反应物)
(2)根据化学键来计算
ΔH=反应物的键能总和-生成物的键能总和
=反应物断键吸收的总能量-生成物成键放出的总能量
(1)催化剂可以降低反应物的活化能,但不影响反应焓变ΔH。
(2)比较反应物和生成物的相对稳定性,能量越低越稳定
(3)物质能量越低,物质的键能越大,越稳定。
(2013·北京高考节选)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
(1)写出该反应的热化学方程式:
__________________________________。
(2)随温度升高,该反应化学平衡常数的变化趋势是________。
【解析】 反应物断裂化学键所需要吸收的总能量减去生成物形成化学键释放的总能量即为焓变:
ΔH=[(945+498)-2×630]kJ·mol-1;因反应为吸热反应,温度升高,该化学平衡常数增大。
【答案】
(1)N2(g)+O2(g)===2NO(g)
ΔH=+183kJ·mol-1
(2)增大
考向1 焓变和反应热的理解
1.(2013·山东高考)对于反应CO(g)+H2O(g)
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下( )
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
【解析】 A项,加入催化剂,改变了反应物和生成物的活化能,从而改变反应的途径,但反应的ΔH只与反应物、生成物的总能量有关,并不发生改变。
B项,该反应前后气体的总物质的量不变,改变压强,平衡不发生移动,因此反应放出的热量不变。
C项,升高温度,反应速率加快,平衡逆向移动,反应放出的热量减少。
D项,原电池反应中,化学能主要转化为电能,因此反应放出的热量将减少。
【答案】 B
考向2 能量图示的理解
2.(2012·大纲全国卷)反应A+B―→C(ΔH<0)分两步进行:
①A+B―→X(ΔH>0),②X―→C(ΔH<0)。
下列示意图中,能正确表示总反应过程中能量变化的是( )
【解析】 根据反应物和生成物能量的高低来分析、解决问题。
化学反应都伴随能量变化,当反应物的总能量高于生成物的总能量时,该反应为放热反应;当反应物的总能量低于生成物的总能量时,该反应为吸热反应。
反应①的ΔH>0,为吸热反应,故可排除A项和C项。
反应②的ΔH<0,为放热反应,B项错误,故选D。
【答案】 D
考向3 从化学键角度进行ΔH的有关计算
3.(2012·重庆高考)肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。
已知断裂1mol化学键所需的能量(kJ):
NN为942、OO为500、NN为154,则断裂1molNH键所需的能量(kJ)是( )
A.194 B.391 C.516 D.658
【解析】 由题图可知ΔH3=-(ΔH2-ΔH1)=
-[-2752kJ·mol-1-(-534kJ·mol-1)]=+2218kJ·mol-1,断裂1molNH键所需能量=(2218kJ-500kJ-154kJ)×
=391kJ。
【答案】 B
热化学方程式的书写与判断
1.“四步”书写热化学方程式
写方程―→标状态―→注条件(温度压强)―→定焓变ΔH。
2.书写与判断应注意的问题
(1)注意ΔH的符号和单位
ΔH只能写在标有反应物和生成物状态的化学方程式的右边。
若为放热反应,ΔH为“-”;若为吸热反应,ΔH为“+”。
ΔH的单位一般为kJ·mol-1。
(2)注意反应条件
反应热ΔH与测定条件(温度、压强等)有关。
因此书写热化学方程式时应注明ΔH的测定条件。
绝大多数ΔH是在25℃、101325Pa下测定的,可不注明温度和压强。
(3)注意物质的聚集状态
反应物和产物的聚集状态不同,反应热ΔH不同。
因此,必须注明物质的聚集状态。
(4)注意化学方程式的化学计量数
①热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数。
因此化学计量数可以是整数,也可以是分数。
②热化学方程式中的反应热是表示反应物完全反应时的热量变化,与反应是否可逆无关。
方程式中化学式前面的化学计量数必须与ΔH相对应,即化学计量数与ΔH成正比。
当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
(2014·模拟题组合)下列热化学方程式或叙述正确的是________。
A.1mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642kJ的热量:
N2H4(l)+O2(g)===N2(g)+2H2O(g)
ΔH=+642kJ·mol-1
B.12g石墨转化为CO时,放出110.5kJ的热量:
2C(石墨,s)+O2(g)===2CO(g) ΔH=-110.5kJ·mol-1
C.已知H2(g)+
O2(g)===H2O(l) ΔH=-286kJ/mol,则2H2O(l)===2H2(g)+O2(g)的ΔH=+572kJ/mol
D.由C、S形成的液态化合物CS20.2mol在O2中完全燃烧,生成两种气态氧化物,25℃时放出热量215kJ,该反应的热化学方程式为CS2(l)+3O2(g)===CO2(g)+2SO2(g) ΔH=-1075kJ/mol
E.已知N2(g)+3H2(g)
2NH3(g) ΔH=-92.4kJ/mol,则在一定条件下向密闭容器中充入0.5molN2(g)和1.5molH2(g)充分反应放出46.2kJ的热量
【解析】 A项,放热反应,ΔH<0,错误;B项,12gC的物质的量为1mol,ΔH=-221.0kJ/mol,不正确;C项,已知反应为放热,则其逆反应为吸热,ΔH为“+”,ΔH与化学计量数成正比,正确;D项,1molCS2(l)放出的热量为
=1075kJ,正确;E项,该反应为可逆反应,0.5molN2与1.5molH2反应不能生成1molNH3,故放出的热量小于46.2kJ,错误。
【答案】 CD
判断热化学方程式的“五审”
考向1 热化学方程式的含义
4.(2014·北京通州摸底)已知:
H2(g)+F2(g)===2HF(g) ΔH=-270kJ/mol。
下列说法正确的是( )
A.在相同条件下,1molH2(g)与1molF2(g)的能量总和大于2molHF(g)的能量
B.1molH2(g)与1molF2(g)反应生成2mol液态HF放出的热量小于270kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用下图来表示
【解析】 B项,物质由气态变为液态时要放热,所以当生成2mol液态HF时,放出的热量大于270kJ;C项,正反应是放热反应,逆反应就是吸热反应;D项,放热反应中反应物的总能量大,生成物的总能量小,而图表示的正好相反。
【答案】 A
考向2 热化学方程式的正误判断
5.实验测得:
101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ的热量;1molCH4完全燃烧生成液态水和CO2,放出890.3kJ的热量。
下列热化学方程式的书写正确的是( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=+890.3kJ·mol-1
②CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3kJ·mol-1
③CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-890.3kJ·mol-1
④2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6kJ·mol-1
A.② B.②④
C.②③④D.①②③④
【解析】 写热化学方程式时要重点注意其与普通化学方程式不同的几点:
(1)产物的稳定状态,H2O为液态,C的稳定化合物为CO2;
(2)单位是kJ·mol-1,不是kJ;(3)数值,ΔH的数值要与方程式中计量系数保持一致;(4)符号,吸热用“+”,放热用“-”。
仅②④符合要求。
【答案】 B
ΔH与键能关系的解题指导
(2012·北京高考,节选)已知反应A:
4HCl+O2
2Cl2+2H2O
ⅰ.反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ.
①H2O的电子式是________。
②反应A的热化学方程式是______________________________________。
③断开1molHO键与断开1molHCl键所需能量相差约为________kJ,H2O中HO键比HCl中HCl键(填“强”或“弱”)________。
审题指导
信息①:
4molHCl被氧化放出115.6kJ的热量⇒ΔH=-115.6kJ/mol
信息②:
ΔH=断键吸收的总能量-成键放出的总能量=-115.6kJ/mol⇒(4EH—Cl+EO=O)-(2ECl—Cl+2×2EO—H)=-115.6kJ/mol⇒EH—Cl-EO—H=
(-115.6-EO=O+2ECl—Cl)=-32kJ/mol⇒H—O键比H—Cl强
评分细则
①
(写为H2O,H—O—H,H∶O∶H均不给分)
②4HCl(g)+O2(g)
2Cl2(g)+2H2O(g) ΔH=-115.6kJ/mol(写为HCl(g)+
O2(g)=
Cl2(g)+
H2O(g) ΔH=-28.9kJ/mol也给分。
不注明状态或注错状态,漏掉“-”,单位错,均不给分)
③32(写31.9也给分) 强
思维建模
ΔH=反应物断键吸收的总能量-生成物成键放出的总能量