0510酶4 第五节 酶活性的调节.docx
《0510酶4 第五节 酶活性的调节.docx》由会员分享,可在线阅读,更多相关《0510酶4 第五节 酶活性的调节.docx(15页珍藏版)》请在冰豆网上搜索。
0510酶4第五节酶活性的调节
第五节酶活性的调节和重要调节酶
一.别构调节(allostericregulation)和别构酶
1.别构调节实例:
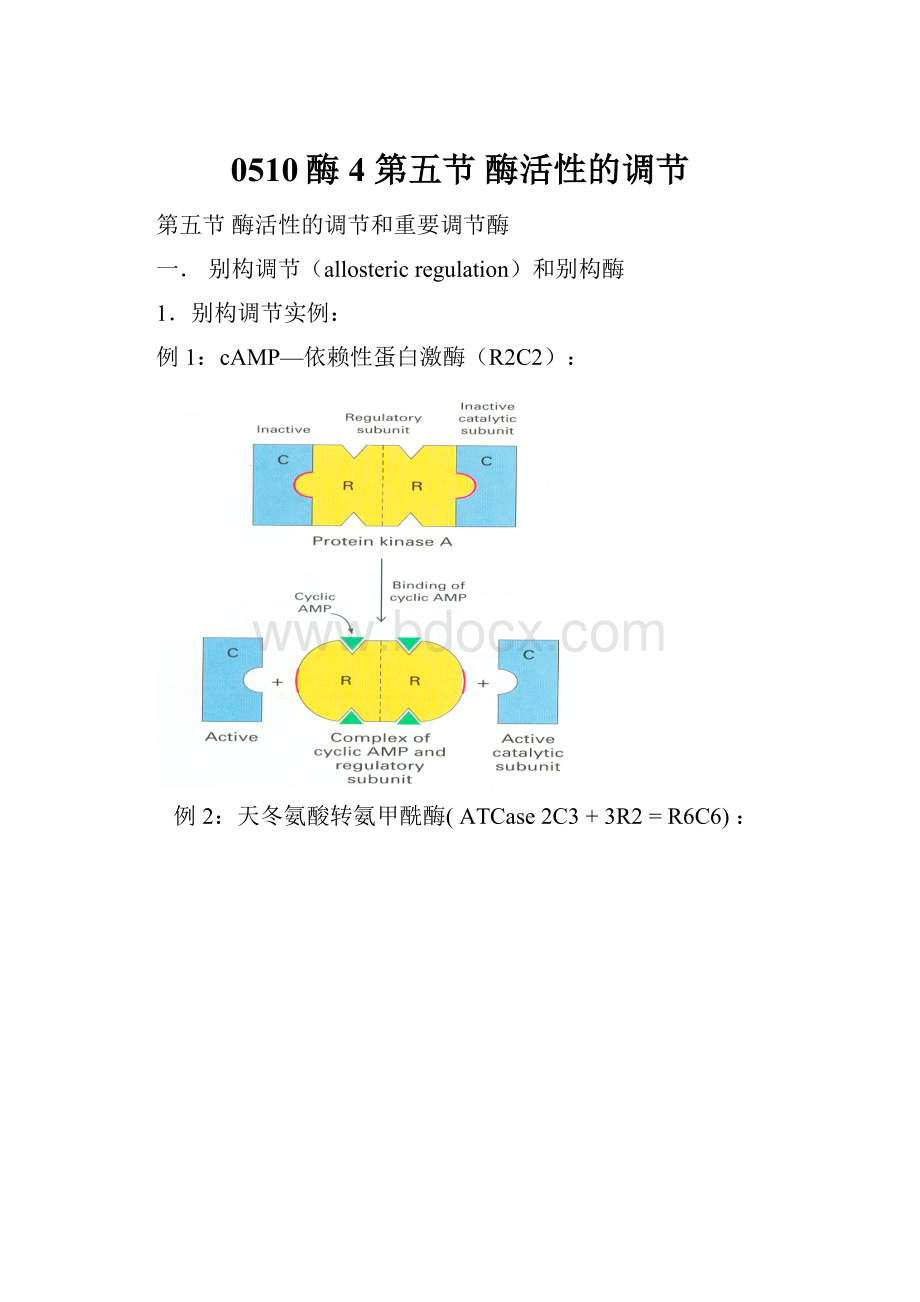
例1:
cAMP—依赖性蛋白激酶(R2C2):
例2:
天冬氨酸转氨甲酰酶(ATCase2C3+3R2=R6C6):
(1)催化的反应:
(2)调节:
A.ATP是激活剂
B.CTP是抑制剂(反馈抑制)
C.天冬氨酸是激活剂
D.PALA是双底物类似物,强抑制剂
PALA结合在ATCase催化部位上的方式
(3)ATCase动力学曲线:
2.基本概念:
(1)调节酶:
除底物外,活性可通过其他方式(如共价修饰等)或被其他生物分子调节的酶为调节酶。
酶的调节方式主要有别构调节和共价调节。
(2)别构调节:
当一些小分子物质与酶的某一特定部位可逆的、非共价结合后,引起酶的构象变化,从而导致酶活性的变化,这种调节方式称为别构调节。
这些小分子物质称为调节剂(效应剂、别构剂),别构剂与酶结合的部位称别构中心或调节部位。
(3)别构酶:
能进行别构调节的酶为别构酶,别构酶除活性中心外还有别构中心。
别构酶一般为寡聚体,含2个或多个亚基。
活性中心和别构中心可能存在于同一亚基的不同部位上或存在于不同亚基上。
存在别构中心的亚基称调节亚基,别构中心负责调节酶促反应速度。
别构酶的活性中心负责对底物的结合与催化,存在活性中心的亚基称催化亚基。
(4)别构激活剂(正效应物):
效应物与酶的结合使酶活性升高者,称为别构激活剂或正效应物。
(5)别构抑制剂(负效应物):
效应物与酶的结合使酶活性降低者,称为别构抑制剂或负效应物。
(6)别构效应(allostericeffect):
效应分子与别构酶的别构中心或调节亚基结合后,诱导或稳定了酶分子的某种构象,使酶活性中心或催化亚基与底物的结合和催化活性受到影响,从而调节酶的反应速度,此效应称为别构效应。
别构效应包括同促效应和异促效应。
(7)同促效应(homotropiceffect):
当效应分子与酶别构中心结合后,有(不)利于同种后续分子的结合为正(负)同促效应。
酶活性部位和调节部位是相同的(底物也是调节剂),该效应剂为正(负)同促效应剂(positivehomotropiceffectorornegativehomotropiceffector)。
(8)异促效应(hetertropiceffect):
当效应分子与酶别构中心结合后,有(不)利于不同后续分子与酶的结合,此为正(负)异促效应。
酶活性部位与调节部位不同,该效应剂为正(负)异促效应剂(positivehetertropiceffectorornegativehetertropiceffector)。
(9)协同效应:
调节部位和活性部位虽然在空间上是分开的,但这两个部位通过构象的变化可相互影响,这种影响统称为协同效应。
协同效应可发生在同一亚基的不同部位之间或不同亚基之间。
增加了酶与底物的亲合力为正协同效应,降低了酶与底物的亲合力为负协同效应。
3.别构酶的动力学曲线为S-形曲线
4.别构调节的机理
(1)序变模型(KoshlandNemethyFilmer,KNF模型1966)
要点:
A.当效应物不存在时,别构酶只有一种构象,紧张态(tense,T态),对底物亲合力小。
只有当效应物与别构酶结合后,才诱导紧张态向松弛态(relaxedR态)转变,R态对底物亲和力高。
B.别构酶的构象是以顺序变化的方式进行,而不是齐步变化,存在T—R过渡态。
C.亚基间的作用可以是正协同效应,也可以是负协同效应。
(2)齐变模型(concertedmodel)1965年MonodWymanChangeux提出,故亦称MWC模型
要点如下:
A.别构酶一般是寡聚酶,含有确定数目的亚基,各亚基占有相等的地位,因此别构酶都有一个对称轴。
B.每种别构酶的所有亚基,或者全部呈不利于结合底物的T态,或者是全部都有利于结合底物的R态。
这两种状态间的互变对于每一个亚基都是相同的,不存在T-R过渡态。
C.当别构酶从一种构象转变为另一种构象时,分子的对称性保持不变。
(3)别构激活剂和别构抑制剂对别构酶的影响:
二.酶的可逆共价调节(共价修饰)
1.什么是酶的共价调节
在酶分子的某一特定部位共价结合某一特定基团,使酶分子在有活性和无活性之间变化。
共价调节的逆反应需在另一种酶的催化下进行。
2.共价调节的类型
3.蛋白质的磷酸化和脱磷酸化调节(1992年EdmondFisher,EdwinKrebs)
例:
糖原磷酸化酶的调节(别构调节和共价调节)
(1)催化的反应:
(2)调节:
ATP和葡萄糖-6-P:
负效应物
AMP:
正效应物
磷酸化/脱磷酸化调节,磷酸化位点:
Ser14
(3)酶分子的结构(两个相同二聚体)
(4)反应动力学曲线
(5)糖原磷酸化酶共价调节和别构调节的协同机制
三.同工酶(isozymers)
1.什么是同工酶:
同工酶是指同一种属中,由不同基因或等位基因编码的多肽链所组成的单体、纯聚体或杂合体,能催化相同的化学反应,但其蛋白质分子结构、理化性质和免疫性能等方面都存在着明显差异的一组酶。
2.乳酸脱氢酶(lactatedehydrogenaseLDH)
(1)催化的反应
(2)结构特征及分布(2种亚基4聚体,5种同工酶)
(3)生理意义心肌:
LDH1(H4)对NADKm值小
骨骼肌:
LDH5(M4)对丙酮酸Km值小
1.肌酸激酶(creatinephosphatekinaseCPK)
催化的反应:
肌酸+ATP→肌酸磷酸+ADP
结构:
2种亚基2聚体,三种同工酶MM,MB,BB
分布:
肌酸激酶同工酶在人体组织中的分布
肌酸激酶(CPK)
骨骼肌
心脏
脑
肝
胃
肾
总活力(IU/g)
1900-3000
380
160
4
125
18
MM
100
76
-
90
3
10
MB
-
22
-
6
2
-
BB
-
1
100
4
95
90
四.抗体酶(abzymes)
抗体酶本质上是免疫球蛋白,但在易变区被赋予了酶的属性,所以又称“催化性抗体”。
抗体酶是将抗体的多样性和酶分子的巨大催化能力结合在一起的蛋白质分子设计的新方法。
制备:
用过渡态的类似物作为半抗原免疫动物获得有催化活性的抗体(因为催化作用的实质是专一结合的相互作用形成过渡态)。