晓昀化学 高三化学复习学案氯及其化合物.docx
《晓昀化学 高三化学复习学案氯及其化合物.docx》由会员分享,可在线阅读,更多相关《晓昀化学 高三化学复习学案氯及其化合物.docx(16页珍藏版)》请在冰豆网上搜索。
晓昀化学高三化学复习学案氯及其化合物
高三化学复习:
氯及其化合物
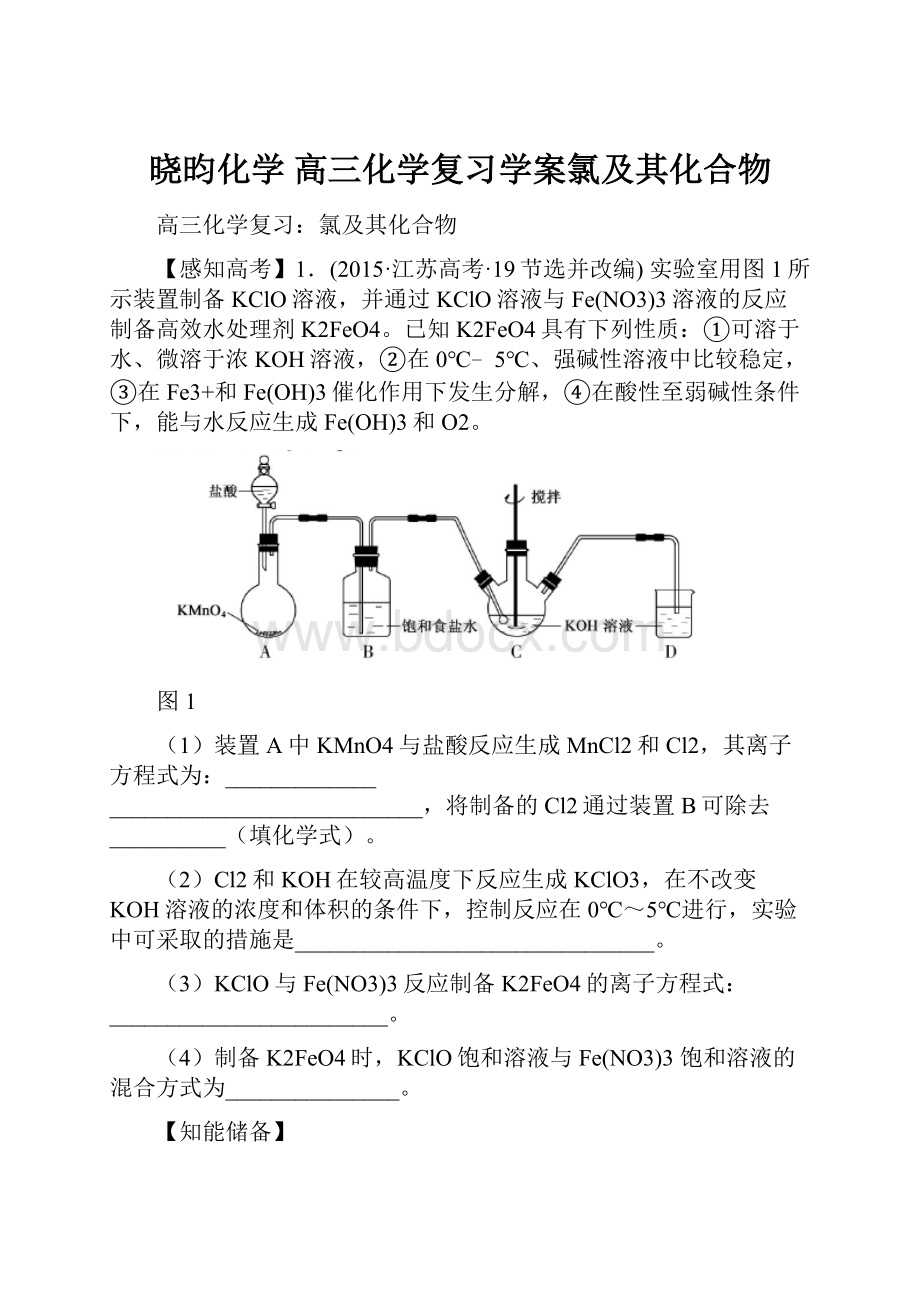
【感知高考】1.(2015·江苏高考·19节选并改编)实验室用图1所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4。
已知K2FeO4具有下列性质:
①可溶于水、微溶于浓KOH溶液,②在0℃﹣5℃、强碱性溶液中比较稳定,③在Fe3+和Fe(OH)3催化作用下发生分解,④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
图1
(1)装置A中KMnO4与盐酸反应生成MnCl2和Cl2,其离子方程式为:
_____________
___________________________,将制备的Cl2通过装置B可除去__________(填化学式)。
(2)Cl2和KOH在较高温度下反应生成KClO3,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是_______________________________。
(3)KClO与Fe(NO3)3反应制备K2FeO4的离子方程式:
________________________。
(4)制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液的混合方式为_______________。
【知能储备】
1.氯气的制法:
①MnO2+HCl(浓)__________________________________,______制法
②KMnO4+HCl(浓)__________________________________,______制法
③KClO3+HCl(浓)__________________________________,______制法
④K2Cr2O7+HCl(浓)__________________________________,______制法
⑤电解饱和食盐水__________________________________,______制法
2.①Cl2的除杂:
先用________除去_____,选装置___,___口进气;
再用________除去_____,选装置___,___口进气。
②Cl2的收集:
装置____,____口进气;或装置____,____口进气。
③Cl2的尾气吸收:
______溶液,离子方程式:
__________________________________。
图2图3图4图5图6
3.①氯气与碱的反应:
______________________________________________________。
②漂白粉的生产原料:
______________,主要成分:
________________,有效成分:
________;
③漂白粉溶液显____性,原因用离子方程式可表示为:
_______________________________;
④漂白及消毒的原理(以下写方程式)_____________________________________________。
⑤漂白粉溶液中滴加稀盐酸____________________________________________________。
⑥漂白粉溶液中通足量CO2气体________________________________________________。
⑦漂白粉保存不善会失效,原因是________________________________________________。
思考:
漂白粉溶液中加浓盐酸可能发生的反应:
_____________________________________。
【牛刀小试】判断下列说法是否正确:
①()图7装置可用于实验室制备少量Cl2。
②()图8装置可用于实验室制备少量纯净干燥的氯气。
③()KMnO4溶液可用盐酸或硫酸酸化。
图7
图8
④()
该装置可除去Cl2中少量HCl
⑤()
该装置可验证氧化性:
ClO->Cl2>Fe3+
【感知高考】2(2014·江苏高考·13)在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是()
A.氯水的颜色呈浅绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
【知能储备】
5.氯气与水的反应:
①离子方程式______________________________,平衡常数表达式________________。
②新制氯水的成分_______________________________________,保存方法_____________,原因是__________________________。
③为由新制氯水获得较高浓度的次氯酸溶液,可向氯水中加入__________。
A.NaOHB.Na2CO3C.NaHCO3D.CaCO3
已知:
HClOK1=2.95×10-8H2CO3K1=4.3×10-7K2=5.6×10-11
6.氯气的强氧化性:
①与单质化合,写出产物化学式:
铁_____、铜_____、硅_____、氢气_____……
②与还原性化合物反应:
用Na2SO3溶液处理工业废水中的游离氯
____________________________________________________。
③向溴化亚铁溶液中通过量氯气______________________________________________。
7.几种物质的检验:
①Cl2_______________________________;
②I2_______________________________;
③Cl-_______________________________;
④Br-______________________________________________________________;
______________________________________________________________。
⑤I-______________________________________________________________;
______________________________________________________________;
______________________________________________________________。
【牛刀小试】判断下列说法是否正确:
①()F2、Cl2、Br2、I2单质均能使湿润的淀粉KI试纸变蓝,均可将铁、铜等金属氧化成较高价态。
②()Cl2可使湿润的淀粉KI试纸变蓝、湿润的pH试纸变红。
③()能使湿润的淀粉KI试纸变蓝的气体一定是Cl2。
④()NaOH、乙烯、苯酚、SO2均能使溴水褪色,说明它们均具有漂白性。
⑤()向溴丙烷中滴加HNO3酸化的AgNO3,可检验溴元素。
⑥()将CH3CH2Br与足量NaOH溶液混合溶液充分加热后冷却,向上层清液滴加AgNO3溶液,若无淡黄色沉淀生成,说明CH3CH2Br与NaOH不反应。
【感知高考】
3(2015上海)氯碱工业以电解精制饱和
食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。
右图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
(1)写出电解饱和食盐水的离子方程式:
_______________________________________。
(2)离子交换膜的作用为:
____________________、
_________________________。
(3)精制饱和食盐水从图中_____位置补充,氢氧化钠溶液从图中_____位置流出。
(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式:
_________________________________________________。
(5)室温下,0.1mol/LNaClO溶液的pH_______0.1mol/LNa2SO3溶液的pH。
(选填“大于”、“小于”或“等于”)浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为_________________________________________。
已知:
H2SO3K1=1.54×10-2K2=1.02×10-7
HClOK1=2.95×10-8
H2CO3K1=4.3×10-7K2=5.6×10-11
【知能储备】
(1)工业上大量生产氯气的方法
(2)由题设情景书写化学方程式的能力
(3)化学反应原理的知识和具体物质的融合
课后练习:
1.(2015安徽卷)下列有关NaClO和NaCl混合溶液的叙述正确的是()
A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存
B.该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:
2Fe2++ClO-+2H+===Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
2.(2015北京卷11)某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是()(已知:
饱和NaClO溶液的pH约为11)
A.该消毒液可用NaOH溶液吸收Cl2制备:
Cl2+2OH-===Cl-+ClO-+H2O
B.该消毒液的pH约为12:
ClO-+H2O
HClO+OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:
2H++Cl-+ClO-=Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:
CH3COOH+ClO-=HClO+CH3COO—
3.(2015四川卷)用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是()
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式
为:
Cl-+2OH--2e-=ClO-+H2O
C.阴极的电极反应式为:
2H2O+2e-=H2↑+2OH-
D.除去CN-的反应:
2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
4.(2015山东卷)下列由实验现象得出的结论正确的是()
操作及现象
结论
A
向AgCl悬浊液中加入NaI溶液时出现黄色沉淀。
Ksp(AgCl)B
向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。
溶液中一定含有Fe2+
C
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色。
Br-还原性强于Cl-
D
加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结。
NH4Cl固体可以升华
5.(2015·天津卷·10)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
完成NaClO3氧化FeCl2的离子方程式:
ClO3-+
Fe2++
______=
Cl-+
Fe3++
________
(1)2MnO4-+16H++10Cl-=5Cl2↑+2Mn2++8H2OHCl
(2)缓慢加入盐酸装置C用冷水浴冷却
(3)3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O
3ClO-+2Fe3++5H2O=2FeO42-+3Cl-+10H+
K2FeO4在0℃﹣5℃、强碱性溶液中比较稳定,
(4)向KClO饱和溶液中缓慢滴加Fe(NO3)3溶液,并不断搅拌。
KClO溶液显_____性,是因为_______________________________;
Fe(NO3)3溶液显_____性,是因为_____________________________。
氯气的制法
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
ClO3-+5Cl-+6H+=3Cl2↑+3H2O
K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O
Cr2O72-+6Cl-+14H+=2Cr3++3Cl2↑+7H2O
2NaCl+2H2O
2NaOH+Cl2↑+H2↑
2Cl-+2H2O
2OH-+Cl2↑+H2↑
氯气与碱的反应
Cl2+2OH-=Cl-+ClO-+H2O
工业生产漂白粉:
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
氯气+石灰乳CaCl2+Ca(ClO)2Ca(ClO)2
碱性ClO-+H2O
HClO+OH-
漂白粉的漂白原理:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
ClO-+H2O
HClO+OH-
漂白粉溶液中滴加稀盐酸:
Ca(ClO)2+2HCl=CaCl2+2HClO可增强漂白性
若二氧化碳过量:
Ca(ClO)2+2CO2+2H2O=Ca(HCO3)2+2HClO
漂白粉失效:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO
2HCl+O2↑
漂白粉溶液遇到浓盐酸和稀盐酸的对比:
Ca(ClO)2+2HCl=CaCl2+2HClO稀盐酸主要体现____性
Ca(ClO)2+4HCl(浓)=CaCl2+Cl2↑+2H2O浓盐酸体现__________性
K=
(P49)
Cl2+H2O
HCl+HClO
Cl2+H2O
H++Cl-+HClO
酸性:
H2CO3>HClO>HCO3-
FeCl3CuCl2SiCl4HCl(____色火焰、白___)
Na2SO3+Cl2+H2O=Na2SO4+2HCl
SO32-+Cl2+H2O=SO42-+2Cl-+2H+
2FeBr2+3Cl2=2FeCl3+2Br2
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
2Fe2++Cl2=2Fe3++2Cl-(忽略了Br-的还原性、Cl2足量)
Cl2:
使湿润的淀粉-KI试纸变蓝
I2:
使淀粉变蓝
Cl-:
取样,滴加HNO3酸化的AgNO3溶液,若产生白色沉淀,说明有Cl-。
Br-:
取样,滴加HNO3酸化的AgNO3溶液,若产生淡黄色沉淀,说明有Br-。
取样,加入少量CCl4后滴加氯水并振荡,若下层溶液变成橙色,说明Br-。
I-:
取样,滴加HNO3酸化的AgNO3溶液,若产生黄色沉淀,说明有I-。
取样,加入少量CCl4后滴加氯水并振荡,若下层溶液变成紫色,说明有I-。
取样,加入少量淀粉溶液后,再滴加氯水并振荡,若溶液变蓝,说明有I-。
F2Cl2Br2I2
单质_____性依次_____,Br2
I2
F-Cl-Br-I-
阴离子_____性依次_____,Br-
I-
I-
I2
2KClO3+H2C2O4+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+2H2O
ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
Cl-稀硝酸AgNO3_____色沉淀Cl-Cl2CCl4
Br-Br-
I-I-
____
____
____
____
1.F2+H2O
2F2+2H2O=4HF+O2
X2+H2O
HXCl+HXO(X2=Cl2、Br2、I2)
2.乙烯+溴水(注明反应类型)
+Br2→
加成反应
3.苯酚溶液+溴水(注明反应类型)
+3Br2→
↓+3HBr取代反应
4.SO2+溴水
SO2+Br2+2H2O=2HBr+H2SO4
SO2+Br2+2H2O=4H++2Br-+SO42-
5.NaOH+溴水
X2+2NaOH=NaX+NaXO+H2O(X2=Cl2、Br2、I2)
6.溴乙烷水解
+NaOH
CH3CH2OH+NaBr
7.溴乙烷消去
+NaOH
↑+NaBr+H2O
8.SO32-水解
SO32-+H2O
HSO3-+OH-
HSO3-+H2O
H2SO3+OH-
(1)2Cl-+2H2O
2OH-+Cl2↑+H2↑
(2)阻止OH-进入阳极室,与Cl2发生副反应:
2NaOH+Cl2=NaCl+NaClO+H2O;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
(3)a;d;
(4)2KClO3+H2C2O4+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+2H2O.
(5)大于;SO32–>CO32–>HCO3–>HSO3–
c()>c()>c()>c()>c()>c()
向右向上
原子半径_____(原子半径最小的是_____)
____电子能力↗(最强的是_____)
电负性_____(最大的是____)
第一电离能_____(ⅡA族、ⅤA族__________)
元素_____性↗
单质_____性↗
__________容易(F2与H2_____化合)
__________稳定(最稳定的是______)
__________酸性↗(最强的是________)