第五章原子结构与分子结构.docx
《第五章原子结构与分子结构.docx》由会员分享,可在线阅读,更多相关《第五章原子结构与分子结构.docx(21页珍藏版)》请在冰豆网上搜索。
第五章原子结构与分子结构
第五章原子结构与分子结构
5.1原子结构
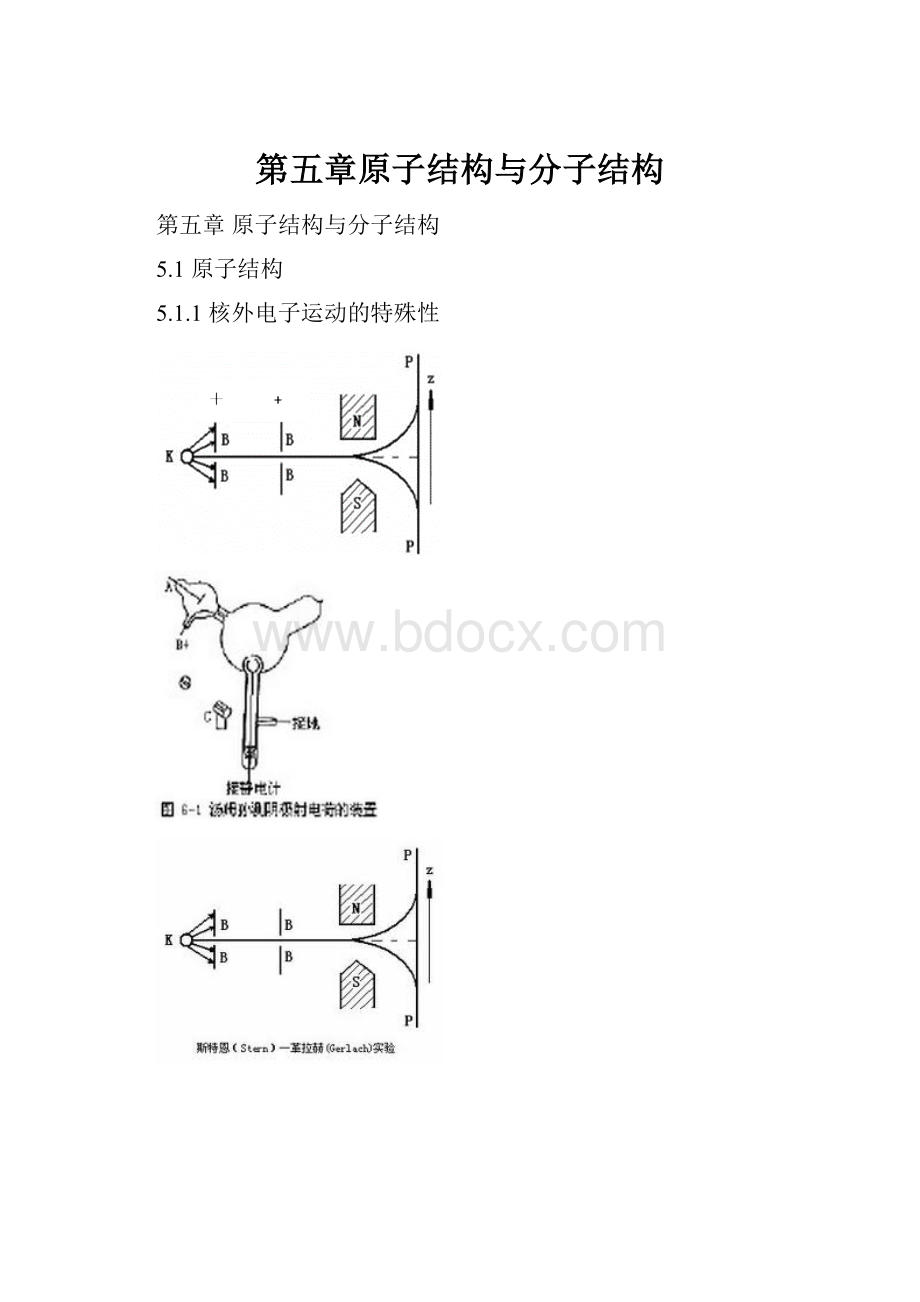
5.1.1核外电子运动的特殊性
上述实验中K为负极,材料可以为金属,也可是气体(H2),B为正极,两级电压很高。
P为屏幕,电子打击后会有显示。
无磁铁时,正对狭缝有电子打击屏幕,有磁铁时,会偏转。
5.1.2 原子结构模型
5.1.3 核外电子运动特点
氢原子发射光谱
――里德堡经验式
―――现在的解释
上述实验现象只能解释为电子从较高能量状态变为稳定的状态(基态),同时释放部分能量――光子的能量。
若电子在核外运动的能量连续,光谱应该连续,否则,电子的能量状态是一定的、不连续变化的。
这就提出了电子在核外的分布按照能级层排列,每一层具有对应的能量――即能量量子化(受光电现象启发)。
电子衍射实验
电子衍射实验表明电子即具有波动性也具有粒子性。
核外点子运动特点:
1)具有不同能量,但不连续变化,而是量子化;
2)具有波粒二象性;
3)高速运动,但不能用经典牛顿力学定律描述,无确定的轨迹,只能用统计的方法来描述,即用出现的概率来描述。
5.1.4 量子力学处理概要
1)用波函数ψ(x,y,z,t)来描述原子(电子和核)的运动状态。
对于基态(稳定状态),运动不随时间变化,此时:
ψ(x,y,z)――稳态波函数;若随时间变化,则:
ψ(x,y,z,t)――含时波函数。
原子运动时,核几乎没有变化,只是电子运动状态的改变,故ψ(x,y,z,t)实际是相当于以核(静止)作参照的电子运动状态。
波函数ψ(x,y,z)(可以是复数)的模ψ(x,y,z)2=
ψ(x,y,z)×ψ(x,y,z)*表示出现在空间(x,y,z)点的概率密度。
2)核外电子运动符合某些规律――相应的运动方程――典型的运动方程之一――薛定格(Schrödinger)方程。
3)量子力学处理的结果
定性(解释)结果
a)按照能量,电子分层排布,用主量子数n表示。
能量由低向高,n分别为1;2;3;4―――;n也大致表示了离核的远近,n越小,离核越近。
之所以说“大致”是因为外层的电子也有可能在内层的空间运动,而不是象球壳一样分布。
b)在每一主能级层(n相同)的电子能量是简并的(所谓简并,就是大致相等,高分辨下有稍微差异),不同能级层的能量不同,体现量子化特征。
c)电子在核外运动有一定的空间与伸展方向―――原子轨道。
电子在原子轨道中运动时,相当于一个带电体的运动―――运动形式之一―――绕核转动,此时具有角动量(矢量),角动量L在x、y、z轴具有分量。
因电子带电,在轨道中运动时也相当于以带电体运动,此时具有磁矩(矢量),磁矩在x、y、z轴方向也具有分量。
原子、分子常在电磁场下(光谱实验等),一般将电磁场的方向规定为z轴方向。
轨道运动具有角动量,就产生相应的磁矩,磁矩在z轴有分量,这一分量与外加磁场会发生相互作用,故常讨论z轴分量。
L的取值也是量子化的,只能取某些值,用l来限定,但l受到n取值影响,有下述关系:
n一定时,l可取的值为:
0;1;2;―――(n-1)。
L在z轴的分量取值也是量子化,由m(磁量子数)来限定,在某一个l值之下,m的取值只能为0;±1;±2;―――±l。
原子轨道在空间有一定的伸展方向(相对于z轴有一定的夹角),而这种夹角决定了就决定了轨道角动量在z轴方向的分量,也就决定了m取值的大小。
由n、l、m决定了波函数的空间形状与伸展方向,即原子轨道ψnlm。
每一类原子轨道是简并的。
原子轨道类别 spdf
空间伸展方向1357
空间伸展方向决定了这类轨道的数目。
P轨道(三个)
d轨道(五个)
f轨道(七个)
电子在轨道中运动时,有两种自旋方式―――顺时针方向与逆时针方向。
自旋也产生角动量,该角动量在磁场方向也有分量,其分量由自旋磁量子数s来决定,s只能为±1/2。
自旋不同时,在磁场与高分辨仪器下电子具有的能量也会产生一定细微差异。
由n、l、m、s四个量子数决定了电子在什么(形状)空间运动、具有的能量的相对高低、角动量的大小取值、自旋方式。
于是多电子原子,核外电子分层排布:
层对应于n=1,2,3,4
又 K,L,M,N层
电子层主要是按照能量高低来分的,也大致是离核的远近距离。
每一层电子(多于2个之后),又分为一些亚层:
层 K L M N
亚层 s s,ps,p,ds,p,d,f
5.1.5 能级交错
在多电子原子中,电子一方面受到核的吸引,另一方面受到其它电子的斥力。
对于多电子原子,核的吸引力是一定的。
屏蔽作用:
电子之间的排斥作用相当于减小了核对电子的引力,这一作用称为屏蔽作用(效应)。
屏蔽作用使电子尽可能远离核的吸引,能量升高。
钻穿作用
由于原子轨道在空间的形状与位置,使得有一些原子轨道有一部分空间伸展到内层,称为原子轨道的钻穿效应,结果是使电子更靠近核,能量更低。
屏蔽效应与钻穿效应使得同一电子层中的各亚层的电子具有不同能级,产生能级交错。
同一电子层:
s多电子原子核外轨道的能级顺序为:
ns→(n-2)f→(n-1)d→np(电子数多之后,该顺序有可能有变化)
轨道能级与电子能量的关系
轨道能级:
指在该轨道上运动的电子都具有某一能量,大于或小于该能量都不在该轨道上运动。
电子能量:
电子的总能量。
5.1.5 核外电子排布
按照量子力学处理结果,核外电子需要服从Pauli(泡利)原理、HundF(洪特)规则能量最低原理。
Pauli原理
核外不可能有两个电子的运动状态完全相同,即不可能有两个电子的四个量子数完全相等。
不论基态与激发态。
基态:
能量最低的状态;
激发态:
能量高于基态能量时的某一状态。
每个轨道最多只能容纳2个电子。
Hund规则
原子在基态时,在等价轨道(简并轨道)上的电子只能自旋状态相同。
全满、全空和半满时能量最低。
若处于非基态,不受Hund规则限制。
等价轨道上的电子自旋状态只能稍微改变能量状态。
能量最低原理
普遍成立与适用的原理:
能量越低越稳定。
故核外电子排布时:
电子层 KLMN
容纳的最多电子数目281832
亚层 spdf
轨道数目1357
最多容纳电子数目261014
核外各原子轨道的能级顺序
ns→(n-2)f→(n-1)d→np
按照能量最低原理,核外电子排布时,按照该顺序排列。
但还需要考虑Pauli原理和Hund规则。
元素
原子序数
核外电子排布
N
7
1s22s2p3
1s22s22p3
Cr
24
1s22s2p63s2p6d54s1
1s22s22p63s23p63d54s1
Fe
26
1s22s2p63s2p6d64s2
Ru
44
1s22s2p63s2p6d104s2p6d75s1
Ni
28
1s22s2p63s2p6d84s2
Pd
46
1s22s2p63s2p6d104s2p6d10
Sc
21
1s22s2p63s2p6d14s2
Y
39
1s22s2p63s2p6d104s2p6d15s2
La
57
1s22s2p63s2p6d104s2p6d105s2p6d16s2
Ce
58
1s22s2p63s2p6d104s2p6d10f15s2p6d16s2
核外电子排布是由光谱实验确定的。
核外电子排布(电子组态):
按照n分层,nsnpnd;
外围电子排布:
按照能量分层,ns(n-2)f(n-1)dnp.
价电子:
参与成键的电子。
若最外层为n层,则一般ns(n-2)f(n-1)dnp为价电子,有例外。
电子组态与元素在周期表中中的位置关系:
最大n决定所处周期;外围电子决定所处的族。
主族元素与副族元素的电子组态有什么关系?
主族元素的内层全满;仅IB、IIB族元素内层全满。
要求掌握前四周期元素的核外电子排布。
5.2元素性质的周期性
5.2.1原子半径
同族元素的原子半径变化:
从上到下,渐渐增大。
?
同周期元素的原子半径:
从左到右,逐渐减少。
共价半径或离子半径变化关系比较复杂,与成键或离子电荷关系很大,但对于同族元素仍可以比较。
5.2.2电离能与电子亲和能
电离能:
处于基态的气态原子失去一个电子所需要的能量,故有第一电离能(I1)、第二电离能(I2)、第三电离能(I3)等之分。
单位:
J/个
J/mol
电离能表示(由原子,也是金属)形成正离子的能力、还原能力。
电离能在周期表中的变化
同一族元素:
随原子序数增加而减小;
同一周期元素:
随原子序数增加而增大(有例外)。
电子亲和能:
基态的气态原子得到一个电子所释放出的能量。
相应有E1、E2、E3等。
单位:
J/个
J/mol
电子亲和能的变化:
同一族元素:
随原子序数增加而降低;
同一周期:
随原子序数而增加。
表示的意义:
原子得电子能力
单质得电子能力
氧化性大小。
元素性质的周期性变化中,主族元素的性质变化比较显著,副族元素的性质变化比较缓慢。
5.2.3 电负性:
分子中原子吸引电子的能力。
电负性越强,越易得到电子,越容易以阴离子形式存在,反之亦然。
电负性在周期表中的变化
同一周期(除惰性气体):
随原子序数增加电负性增加;
同一族元素:
随原子序数增加电负性减小。
5.2.4 元素的金属性与非金属性
典型的金属性,分物理性质与化学性质。
物理性质为:
金属光泽、导电导热性良好、融沸点较高、密度较大、硬度较高、延展性良好等。
化学性质,如失电子转化为金属离子、与水的置换反应等。
常用失电子能力来表示金属性,与电负性有关。
非金属性:
得电子能力,电负性大。
元素(各种原子)的得失电子能力与金属一致,与非金属单质得失电子能力有关不等同,常非金属元素的得失电子能力强,其单质的得失能力强。
5.3离子键
本质:
正负离子的静电引力。
特征:
无方向性和饱和性。
无方向性:
任意方向都存在静电引力;
无饱和性:
正负离子周围尽可能多的吸引异性电荷离子,但不是无限制。
离子键与共价键的关系
电负性差减小
电负性差减小
完全离子键 极性共价键 非极性共价键
实际上不存在完全的离子键,也不存在完全的共价键。
离子半径:
在周期表中的变化规律:
仅对同族元素进行比较。
对角线规则:
坐上与右下元素类似。
对于同一元素:
其阴离子的半径比阳离子半径大很多。
离子晶体
离子化合物在固态时常以离子晶体形式存在。
晶体:
固体,内部粒子(原子、分子、粒子)有规则排列,常以规则外形出现。
与晶体相对应的就是无定形,无规则排列。
若内部粒子为粒子的晶体就是离子晶体。
例如氯化钠晶体
氯化钠晶体的结构单元―――晶胞
氯化钠晶格―――-面心立方晶格(fcc)
硫化锌晶体的结构单元―――晶胞
简单六方晶格(hcp)
晶体是物质存在的一种形式,一种物质可以以晶体形式存在、也可以以无定形存在,也可以以气体形式存在。
5.4共价键
Lewis学说:
1916年(美)Lewis提出:
分子中原子间可通过共享电子对而使每一个原子具有稳定的电子结构.如此构成的分子为共价分子.原子通过共用电子对而形成的化学键为共价键.
Lewis结构式:
八偶体
满足每个原子最外层为8个电子的结构。
缺点:
a.未能阐明共价键的本质和特性;
b.八偶体规则例外很多,例BF3;
c.不能解释某些分子的性质,例O2顺磁性。
现代价键理论
1927年,(德)Heither,London;
本质是由于原子相互接近时轨道重叠(即
轨道),原子通过共用自旋相反的电子对使体系位能下降而成键。
特点:
方向性;饱和性
饱和性指每种元素形成的价键数目一定。
方向性:
满足最大重叠原理。
杂化轨道理论
同一原子中能量相近的不同类型的几个原子轨道的波函数(s,p,d…)可重新组合成等数量的杂化原子轨道。
常用来解释C等原子的成键,如:
s+p→sp杂化轨道 线型
s+2p→sp2杂化轨道 平面型
s+3p→sp3杂化轨道 正四面体
共价键的特征
饱和性:
为什么具有饱和性?
基态原子的核外外围电子成键时,满足最大重叠程度,需按照一定方向接近,使得成键具有数目限制。
这就是饱和性。
方向性:
成键就是原子轨道的重叠,重叠程度越大,降低体系能量越多,而重叠程度大需要按照一定方向接近,这就使得成键具有方向性。
共价键类型:
σ键:
所谓:
“头碰头”方式重叠
π键:
π键
大π键―――
5.5 分子的极性与分子间作用力
偶极子:
一对带等量异电荷的点电荷(相距r)
偶极距:
(负电荷指向正电荷)(单位:
徳拜)
极性键:
不同元素的原子之间形成的共价键。
极性分子:
分子中正负电荷中心不重叠的分子。
在电场作用下,极性分子定向排列。
极性分子具有永久偶极距。
但在电场作用下,其它分子会产生偶极,极性分子会产生附加偶极,这种偶极称为诱导偶极,这种产生附加偶极的作用叫极化作用。
相似相溶(经验总结):
结构相似互相溶解性比较好;
极性溶剂溶解极性溶质比较好;非极性溶剂溶解非极性溶质比较好。
离子化合物、极性分子在水中溶解比较好。
分子之间的作用力
(1)取向力
(2)诱导力
(3)色散力
“瞬间偶极”所产生的作用力。
若原子分子越大,对外层电子的引力越小,越易在电场下发生变形―――越易极化,色散力越大。
分子间作用力的大小影响到聚集状态改变的难易,即熔点、沸点等。
一般,色散力是主要的,只有哪些极性很大的分子取向力才是主要的。
氢键
在H2O、HF、NH3中,H几乎是个裸露的质子,与另一分子中的O(F、N)等存在比较强的静电引力,这种因H存在的分子之间的作用力称为氢键。
氢键的表达:
H2O---H-OH
氢键的方向性:
O---H-O在一条 直线上;
氢键的饱和性:
每一个H(与电负性大的相连)只能形成一个氢键。
氢键是一种分子间的作用力;只影向聚集状态。
一般同族元素的氢化物沸点由上向下升高,但H2O比H2S的沸点高,是因为氢键造成沸点“反常”。
存在氢键时,一般以聚合状态存在(H2O)m、(HF)2。
极化作用:
一般原子无偶极的,非极性分子也无偶极,但在电场下可极化,产生偶极,极性分子也可产生偶极。
离子可看作点电荷,周围有电场,可使其它分子极化。
离子化合物中,阳离子产生电场,阴离子离阳离子核较近,会发生变形(被极化),即阳离子有极化能力。
同样,阴离子也有极化能力。
但阳离子在阴离子场中离阴离子核较远,变形较弱。
故阴离子的极化能力一般较弱。
一般也只考虑阳离子的极化能力。
一般,阳离子的电荷越多、体积越小,极化能力越强。
一般,阳离子较阴离子体积小,变形性也较小,故一般只考虑阴离子的变形性(被极化)。
一般,阴离子的电荷越多,半径越大,变形性越大,越易被极化。
弱阴离子被极化发生变形,就会由离子键向部分共建键过渡,共建成分增加。
如在水中溶解度变小,在有机溶剂中的溶解度增大,熔点下降等。
习题
2;3;6;11;12