无机化学氮族元素及其化合物.docx
《无机化学氮族元素及其化合物.docx》由会员分享,可在线阅读,更多相关《无机化学氮族元素及其化合物.docx(9页珍藏版)》请在冰豆网上搜索。
无机化学氮族元素及其化合物
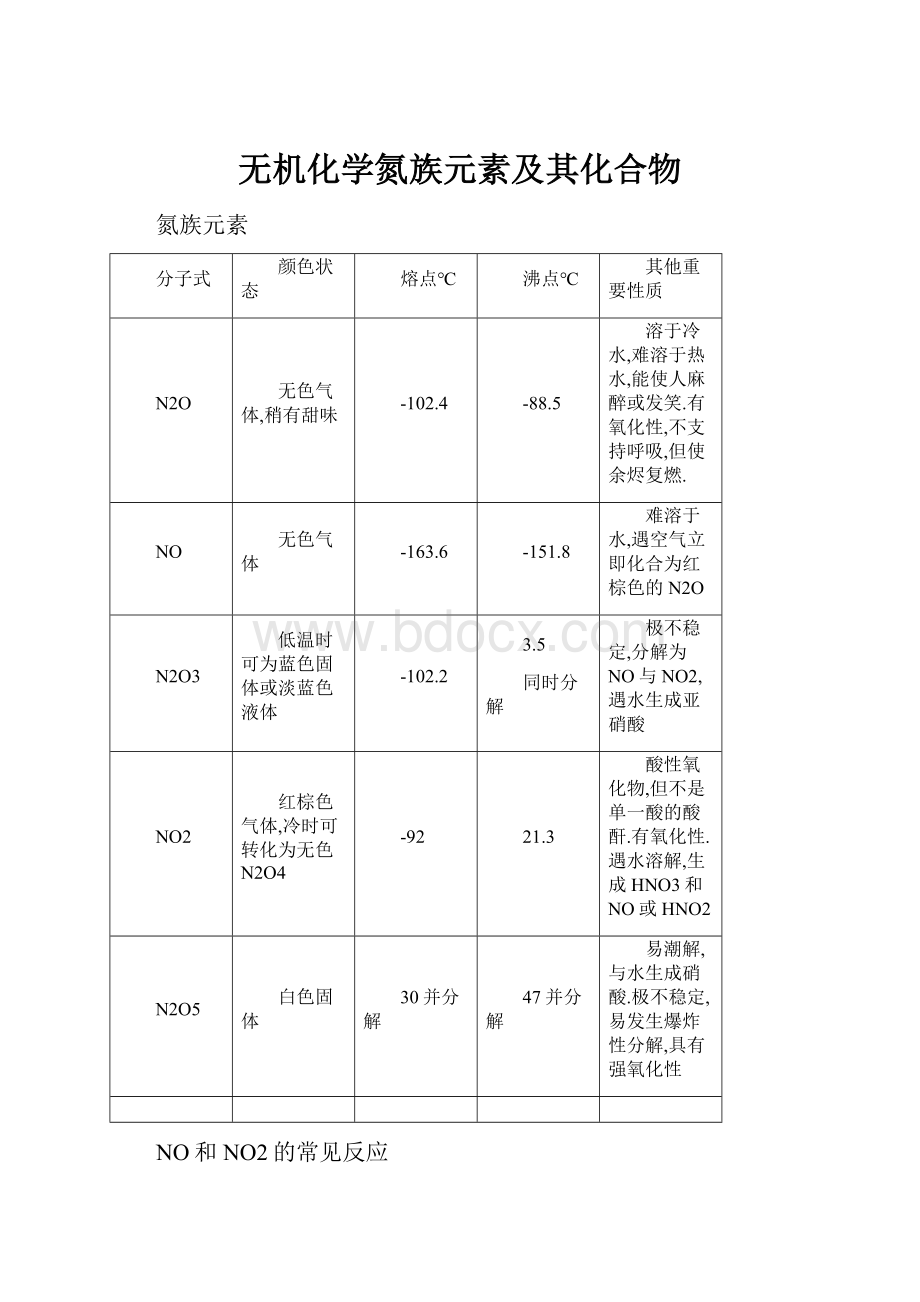
氮族元素
分子式
颜色状态
熔点℃
沸点℃
其他重要性质
N2O
无色气体,稍有甜味
-102.4
-88.5
溶于冷水,难溶于热水,能使人麻醉或发笑.有氧化性,不支持呼吸,但使余烬复燃.
NO
无色气体
-163.6
-151.8
难溶于水,遇空气立即化合为红棕色的N2O
N2O3
低温时可为蓝色固体或淡蓝色液体
-102.2
3.5
同时分解
极不稳定,分解为NO与NO2,遇水生成亚硝酸
NO2
红棕色气体,冷时可转化为无色N2O4
-92
21.3
酸性氧化物,但不是单一酸的酸酐.有氧化性.遇水溶解,生成HNO3和NO或HNO2
N2O5
白色固体
30并分解
47并分解
易潮解,与水生成硝酸.极不稳定,易发生爆炸性分解,具有强氧化性
NO和NO2的常见反应
NO与空气相遇立即被氧化为红棕色的NO2;
2NO+O2==2NO2
这是个放热反应,但反应速率随温度变化很特殊,在温度低时反应快,温度高时却缓慢。
NO2在常温下压缩或在常压下冷却,会有无色的N2O4生成:
2NO2⇌N2O4
3NO2+H2O==2HNO3+NO
4NO2+O2+2H2O==4HNO3
4NO+3O2+2H2O==4HNO3
NO+NO2+O2+H2O==2HNO3
氮的氧化物对大气的污染
1.污染对象:
但的氧化物都是大气的污染物,常见的以NO和NO2为主.它们都能刺激和损害呼吸系统,也伤害植物的生长和发育.NO还易与血红蛋白结合,形成亚硝基血红蛋白而失去输氧能力.NO2跟血红蛋白能生成硝基血红蛋白,同样失去输氧功能.所以,在空气中浓度大时,会导致严重的伤害甚至死亡.在低浓度NO、NO2的空气中时间过长时,可因NO、NO2在肺中生成HNO3和HNO2而发生病变.NO和NO2在湿空气中产生的硝酸,对金属、机械、建筑物等都有明显的腐蚀作用.NO上升到臭氧层,也会对臭氧层产生破坏作用.
2.污染来源:
污染大气的氮的氧化物,主要来源是化工燃料(煤、石油)的燃烧废气.如汽车尾气、喷气飞机尾气和火电厂废气等.未经处理的硝酸厂和某些工厂的废气排放,也会产生较高浓度的氮的氧化物.
3.主要防污染发应:
伦敦和洛杉矶化学烟雾事件.
2CO+2NO==N2+2CO2
6NO+4NH3==5N2+6H2O
6NO2+8NH3==7N2+12H2O
这些催化剂比较昂贵,也容易被含铅汽油的排放物损害.汽车没有处理废气的设备和使用含铅汽油是极不利于环境保护的.
硝酸纯硝酸是无色油状液体,开盖时有烟雾,挥发性酸.
M.p.-42℃,b.p.83℃.密度:
1.5g/cm3,与水任意比互溶.
常见硝酸a%=63%-69.2%c=14-16mol/L.呈棕色(分析原因)发烟硝酸.
化学性质:
强腐蚀性:
能严重损伤金属、橡胶和肌肤,因此不得用胶塞试剂瓶盛放硝酸.
不稳定性:
光或热
4HNO3=====4NO2+O2+2H2O所以,硝酸要避光保存.
强酸性:
在水溶液里完全电离,具有酸的通性.
强氧化性:
浓度越大,氧化性越强.
与金属反应:
在两支试管里分别盛有铜片,向两支试管理再分别加入浓硝酸和稀硝酸.
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
Ag+2HNO3(浓)==AgNO3+NO2↑+H2O
3Ag+4HNO3(稀)==3AgNO3+NO↑+2H2O
硝酸能与除金、铂、钛等外的大多数金属反应.
通常浓硝酸与金属反应时生成NO2,稀硝酸(<6mol/L)则生成NO.
钝化反应:
常温下浓硝酸可使铁、铝、铬(都可呈+3价金属化合物)表面形成具有保护性的氧化膜而钝化.而稀硝酸则与它们反应.
Fe+4HNO3(稀)==Fe(NO3)3+NO+2H2O
王水:
1体积浓硝酸与3体积浓盐酸的混合溶液.可溶解金、铂.
Au+HNO3+4HCl==HAuCl4+NO+2H2O
M+HNO3(12∽14mol/L)↗NO2为主.
M+HNO3(6∽8mol/L)↗NO为主
M+HNO3(约2mol/L)↗N2O为主,M较活泼.
M+HNO3(<2mol/L)↗NH4+为主(M活泼)
M+HNO3还可能有H2产生(M活泼)
与非金属反应:
浓硝酸;需要加热.
C+4HNO3(浓)==CO2↑+4NO2↑+2H2O(实验演示)
H2S+8HNO3(浓)==H2SO4+8NO2↑+4H2O
3H2S+2HNO3(稀)==3S+2NO+4H2O(冷)
SO2+2HNO3(浓)==H2SO4+2NO2
3SO2+2HNO3(稀)+2H2O==3H2SO4+2NO
H2S、SO2以及S2-、SO32-都不能与硝酸共存.
与有机物反应:
生成硝基化合物和硝酸酯.
用途:
军火工业、燃料工业、硝酸盐(硝酸铵和制矿山用硝铵炸药)、硝酸银.
硝酸的制法:
生成硝酸的措施有哪些?
对比优缺点.(三种)
实验室制法:
微热
NaNO3(s)+H2SO4(浓)==NaHSO4+HNO3
1.反应温度
2.反应装置:
3.收集装置:
氨氧化法制硝酸:
4NH3+5O2====4NO+6H2O(氧化炉中)
2NO+O2==2NO2(冷却器中)
3NO2+H2O=2HNO3+NO(吸收塔)
4NO2+O2+2H2O==4HNO3(吸收塔)
过程:
(1)先将液氨蒸发,再将氨气与过量空气混合后通入装有铂、铑合金网的氧化炉中,在800℃左右氨很快被氧化为NO.该反应放热可使铂铑合金网(催化剂)保持赤热状态.
(2)由氧化炉里导出的NO和空气混合气在冷凝器中冷却,NO与O2反应生成NO2.
(3)再将NO2与空气的混合气通入吸收塔.由塔顶喷淋水,水流在塔内填充物迂回流下.塔底导入的NO2和空气的混合气,它们在填充物上迂回向上.这样气流与液流相逆而行使接触面增大,便于气体吸收.
从塔底流出的硝酸含量仅达50%,不能直接用于军工、染料等工业,必须将其制成98%以上的浓硝酸.浓缩的方法主要是将稀硝酸与浓硫酸或硝酸镁混合后,在较低温度下蒸馏而得到浓硝酸,浓硫酸或硝酸镁在处理后再用.
尾气处理:
烧碱吸收氮的氧化物,使其转化为有用的亚硝酸盐(有毒)即”工业盐”.
NO+NO2+2NaOH==2NaNO2+H2O
硝酸盐:
特点:
外观美丽(由金属离子决定);KNO3无色、Cu(NO3)2.6H2O宝石蓝色.
水溶性好
有明显的氧化性,稳定性不好.分解有氧气.
[实验]
1.KNO3的热分解:
2.硝酸铜的热分解并检验气体.
2KNO3==2KNO2+O2
2Cu(NO3)2==2CuO+4NO2+O2
2AgNO3==2Ag+2NO2+O2
检验方法:
硝酸盐溶液经浓缩后,加入浓硫酸和铜屑并加热,可逸出红棕色气体.
磷及其化合物
磷单质:
1.磷的物理性质:
游离态磷有白磷、红磷和黑磷三种同素异型体.
白磷:
分子是由四个磷原子构成的正四面体.键角60°.
白色蜡状,因常带有黄色,有叫黄磷.
难溶于水,易溶于非极性溶剂如CS2.
密度1.8熔点44.1℃,沸点280.5℃,有剧毒(0.1g∽0.06g致命)
着火点40℃所以少量的白磷保存在冷水
红磷:
复杂的大分子,结构尚未完全清除,但已知其结构中有磷原子构成的环和链.
棕红色粉末
密度2.2熔点590℃(43kPa)基本无毒
常压下加热则升华为磷蒸汽,遇冷凝结为白磷
难溶于水和二硫化碳等.
黑磷:
黑色有金属光泽的晶体,它是用白磷在很高压强和较高温度下转化而成的,使用价值不大.
2.化学性质:
磷在氧气中燃烧:
4P+5O2==2P2O5(白烟)(分析P2O5的分子结构)对比白磷和红磷的着火点,.
磷在氯气中燃烧:
白色烟雾(PCl3和PCl5)
PCl3是无色油状液体,可制有机磷农药,也是重要的化学试剂.
2P+3Ca==Ca3P23Zn+2P==Zn3P2
3.磷的用途:
(1)制高纯度的磷酸(白磷)和农药
(2)安全火柴:
火柴头:
硫、硫化锑、磷的硫化物和氧化剂(KClO3)
侧面:
红磷、硫化锑和玻璃粉
原理:
火柴头在侧面磨擦,产生的热量把微量的红磷转化为白磷而立即燃烧,点着火
柴头.如果用合适的配料,把火柴头制得很长,就可制成防风火柴.
磷的氧化物
P2O3+3H2O==2H3PO3(亚磷酸,二元酸)
P2O5+H2O==2HPO3(偏磷酸,有毒)
P2O5+3H2O==2H3PO4(磷酸,三元酸,无毒)
P2O5是吸湿性很强的白色粉末,是常用的强力干燥剂.
P2O3和P2O5的分子结构:
分子式:
P4O6和P4O10
磷酸及其盐
磷酸是无色晶体,易潮解.商品磷酸是85%的水溶液,呈无色粘稠状.
三元中强酸,分三步电离:
H3PO4⇌H++H2PO4-
H2PO4-⇌H++HPO42-
HPO42-⇌H++PO43-
与碱中和时,根据碱的用量差异,可得到不同的盐.(OH-和NH3)
高沸点非氧化性酸:
制取溴化氢和碘化氢.
H3PO4(浓)+KI(固)==KH2PO4+HI↑
用途:
制化肥和提炼某些金属,清凉饮料中加入无毒的磷酸作调味剂.
磷酸盐:
正盐Ca3(PO4)2难溶若将其施入土壤,不能被植物吸收,只有缓慢地在有机物腐败产生的酸性环境下转化为二氢盐后,才能被植物吸收.
一氢盐CaHPO4较难溶.二氢盐Ca(H2PO4)2可溶.
普钙:
Ca(H2PO4)2和CaSO4的混合物.
Ca3(PO4)2+2H2SO4==2CaSO4+Ca(H2PO4)2
重钙:
重过磷酸钙Ca(H2PO4)2肥效
Ca3(PO4)2+3H3PO4==3Ca(H2PO4)2
Ca3(PO4)2+3H2SO4==3CaSO4+2H3PO4(普通磷酸)
使用磷肥切忌与碱性物质混用.否则会生成难溶的磷酸正盐,损失肥效.
Ca(H2PO4)2+2Ca(OH)2===Ca3(PO4)2+4H2O
有些洗衣粉里掺入磷酸钠作为辅助剂.它们水解呈碱性有去污的能力和改善水质的作用.但这种洗衣粉的废水流入水域会引起水中含磷过多,杂藻滋生,即富营养化而造成污染.因此目前已禁止在洗涤剂和洗衣粉中使用磷酸钠类物质.
砷、砒霜和砷化镓
砷:
有三种同素异型体,最稳定的是有金属光泽的灰砷.另外两种如黑砷和黄砷.都有毒.
与溶碱反应,也能被浓硫酸和硝酸氧化.在加热条件下砷与氧化合生成As2O3;与硫化合成As2S3.
砒霜:
As2O3(As4O6).我国古代就知道的剧毒品.
白色粉末,微溶于水,致死量约0.1g.
砒霜用于毒害农田土壤中的有害小动物,业用来制杀虫剂和含砷的药物.
误食砒霜者的胃液里残留的砒霜,可用马许验砷法检出.把胃液残留物与锌、盐酸一起反应,残留的As2O3被还原,生成AsH3(胂,有毒),随氢气导出,可以在管口处将其点燃,在火焰上插入瓷片或蒸发皿,使胂在缺氧条件下分解,生成游离砷,附着在瓷片上成为光亮的灰色砷镜.
砷化镓:
GaAs.黑灰色晶体,熔点:
1238℃,相当稳定.
是优良的半导体材料,其性能比硅、锗更优越.它的性能好且灵敏,还具有‘双能谷导带’,被誉为‘第三代半导体’.可用于制备发光元件、半导体激发器、微波体较应器件、太阳能电池、高速集成电路等.广泛用于计算机、雷达、人造卫星、宇宙飞船等尖端技术中.
用高纯度的砷跟镓作用,即可制得砷化镓.