大学分析化学总复习知识要点.ppt
《大学分析化学总复习知识要点.ppt》由会员分享,可在线阅读,更多相关《大学分析化学总复习知识要点.ppt(19页珍藏版)》请在冰豆网上搜索。
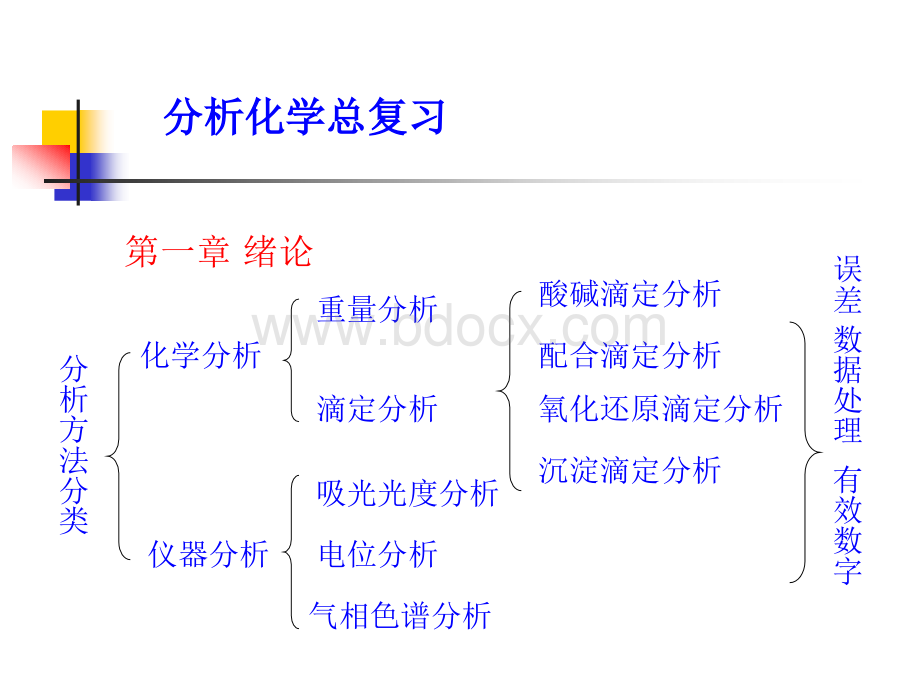
分析化学总复习分析化学总复习第一章绪论分析方法分类化学分析仪器分析重量分析滴定分析吸光光度分析电位分析气相色谱分析酸碱滴定分析配合滴定分析氧化还原滴定分析沉淀滴定分析误差数据处理有效数字第二章误差及其数据处理一、准确度与精密度1、准确度与误差2、精密度与偏差3、准确度与精密度的关系4、误差的分类及其减免方法系统误差随机误差
(1)重复性
(2)单向性(3)基本不变性正态分布:
空白对照回收n5、随机误差服从的规律平均值的置信区间第二章误差及数据处理二、数据处理4d法Grubbs法Q检验法2、平均值与标准值得比较:
t检验法3、两个平均值的比较:
先F检验再t检验法三、有效数字有效数字修约规则计算规则1、可疑值得取舍第三章滴定分析一、几个概念滴定分析、滴定、标准溶液、化学计量点、滴定终点、终点误差二、滴定分析对反应的要求定量、迅速、易于终点检测三、标准溶液1、浓度的表示物质的量浓度C(mol/L)滴定度T(mg/mL)2、配制直接法:
基准物质标定法:
基准物质和标准溶液第四章酸碱滴定法一、酸碱平衡分布分数质子平衡方程的建立二、各种酸碱体系pH的计算:
一元弱酸溶液pH计算公式的推导、近似公式的应用两性溶液pH值得计算三、酸碱指示剂作用原理、指示剂的用量、指示剂的选择原则第四章酸碱滴定法四、酸碱滴定基本原理强碱强酸强碱一元弱酸强碱多元弱酸特点、影响突跃的因素、准确滴定的判断条件五、酸碱滴定法的应用1、混合碱的分析1.双指示剂法2.BaCl2法2.铵盐中氮含量的测定第五章配位滴定法一、配合平衡K、二、EDTA及其配合物EDTA的性质配合物的特点配合比1:
1稳定性高水溶性好、颜色三、副反应及条件稳定常数EDTA的副反应系数Y酸效应系数Y(H)共同离子效应系数Y(M)金属离子的副反应系数M配位效应系数M(L)水解效应系数M(OH)条件稳定常数KlgK=lgKlgY-lgM第五章配位滴定法四、配合滴定基本原理滴定突跃大小影响因素:
c和K五、金属离子指示剂作用原理变色点:
lgKMIn=pMep指示剂的选择:
pMep与pMsp尽量一致六、混合离子的分别滴定单一离子:
lgcK=6误差小于0.1%混合体系:
lgcK=5误差小于1.0%第五章配位滴定法判断条件成立时:
利用控制酸度的办法滴定适宜酸度范围的计算判断条件不成立时:
利用掩蔽法或解蔽法七、配位滴定方式:
1.直接滴定法2.返滴定法3.置换滴定法4.间接滴定法第六章氧化还原滴定法一、氧化还原平衡:
奈斯特方程平衡常数二、氧化还原反应的速度与程度三、氧化还原滴定曲线突跃大小取决于(2-1)四、氧化还原指示剂1.自身指示剂:
高锰酸钾2.专属指示剂:
淀粉3.3.氧化还原指示剂:
二苯胺磺酸钠第六章氧化还原滴定法五、氧化还原滴定法应用1.KMnO4法2.KCr2O7法3.碘量法标准溶液典型应用示例六、氧化还原计算注意写出配平的氧化还原方程式第七章重量分析法和沉淀滴定法一、重量分析沉淀形式要求1.溶解度小2.纯净3.易于转化为称量形式称量形式要求1.组成与化学是一致2.稳定3.M大沉淀溶解度影响因素:
同离子效应酸效应配合效应盐效应温度、溶剂、粒度等第七章重量分析法和沉淀滴定法沉淀纯度的影响因素:
共沉淀,后沉淀沉淀条件的选择:
晶型沉淀稀搅陈化热非晶型沉淀浓热加电解质不陈化重量分析计算:
换算因子F的计算第七章重量分析法和沉淀滴定法二、沉淀滴定法1.摩尔法2.佛尔哈德法3.吸附指示剂法指示剂、介质pH值、标准溶液、测定离子、测定方式第八章电位分析法参比电极:
指示电极:
甘汞电极:
离子选择性电极玻璃膜电极氟离子选择电极电极构造、电极反应、作用原理直接电位法pH的测定氟离子含量的测定电位滴定法饱和甘汞电极第九章吸光光度法一、吸光光度法基本原理1.朗伯-比尔定律;A=kbc适合于平行单色光溶液2.比尔定律的偏离及其原因1.非单色光2.化学原因二、显色反应及其条件的选择M+L=MR条件的选择:
1.显色剂的用量2.酸度3.温度、时间4.副反应第九章吸光光度法三、光度测量条件的选择1.入射光波长的选择:
吸收最大,干扰最少2.A的取值范围:
0.2-0.73.参比溶液的选择四、吸光光度法的其他应用1.示差法:
高含量组分测定参比溶液Cs2.多组分测定:
A的加和性3.酸碱离解常数的测定4.配合物组成及稳定常数的测定第十一章气相色谱分析法一、气相色谱分析的一般知识、分析流程二、气固色谱和气液色谱的分离原理三、色谱分析理论基础1.基本术语2.色谱柱效能1.塔板理论:
H、n2.速率理论:
H=A+B/u+Cu3.分离度R完全分离R=1.5四、气相色谱分析条件选择色谱柱、载气种类及流速、柱温、柱长及内径、进样、气化室温度等第十一章气相色谱分析法五、气相色谱检测器E=Sm1.热导检测器TCD2.氢焰检测器FID工作原理六、气相色谱定性方法1.利用纯物质:
tR、峰增高法2.GC-MC、GC-IR等七、气相色谱定量法m=E/S=fA1.A的测定2.定量校正因子的测定3.几种常用的定量方法1.面积归一法2.内标法3.外标法