精品第四章能量衡算及热数据的估算习题解答.docx
《精品第四章能量衡算及热数据的估算习题解答.docx》由会员分享,可在线阅读,更多相关《精品第四章能量衡算及热数据的估算习题解答.docx(22页珍藏版)》请在冰豆网上搜索。
精品第四章能量衡算及热数据的估算习题解答
计算题(P106)
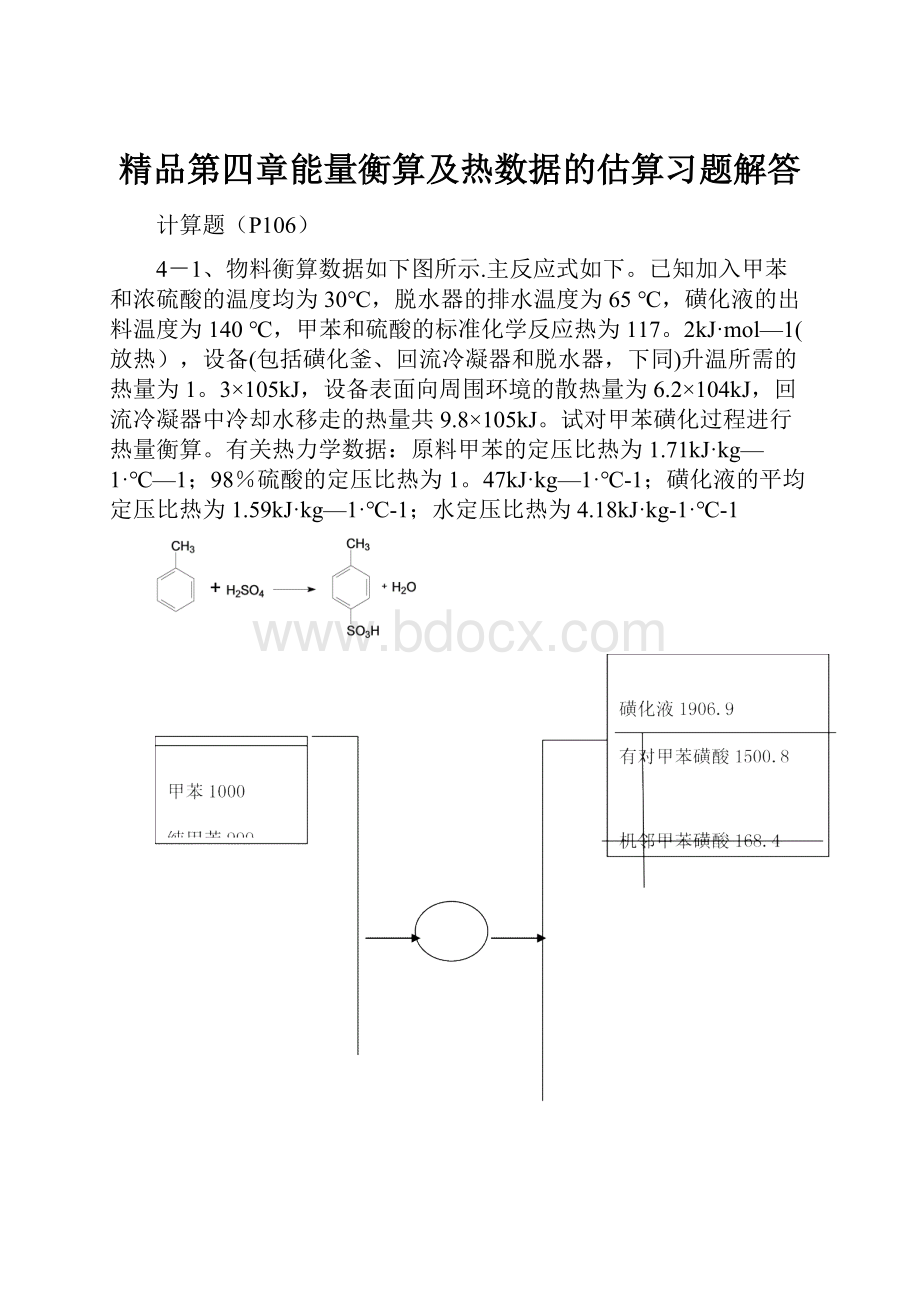
4-1、物料衡算数据如下图所示.主反应式如下。
已知加入甲苯和浓硫酸的温度均为30℃,脱水器的排水温度为65℃,磺化液的出料温度为140℃,甲苯和硫酸的标准化学反应热为117。
2kJ·mol—1(放热),设备(包括磺化釜、回流冷凝器和脱水器,下同)升温所需的热量为1。
3×105kJ,设备表面向周围环境的散热量为6.2×104kJ,回流冷凝器中冷却水移走的热量共9.8×105kJ。
试对甲苯磺化过程进行热量衡算。
有关热力学数据:
原料甲苯的定压比热为1.71kJ·kg—1·℃—1;98%硫酸的定压比热为1。
47kJ·kg—1·℃-1;磺化液的平均定压比热为1.59kJ·kg—1·℃-1;水定压比热为4.18kJ·kg-1·℃-1
解法一:
对甲苯磺化过程进行热量衡算的目的是为了确定磺化过程中的补充加热量。
依题意可将甲苯磺化装置(包括磺化釜、回流冷凝器和脱水器等)作为衡算对象.此时,输入及输出磺化装置的物料还应包括进、出回流冷凝器的冷却水,其带出和带入热量之差即为回流冷凝器移走的热量.若将过程的热效应作为输入热量来考虑,则可绘出如下图所示的热量衡算示意图.
则热量平衡方程式可表示为
取热量衡算的基准温度为25oC(若取0℃作为基准,结果又如何?
),则
(1)
(2)磺化过程热效应
反应中共加入98%浓硫酸的质量为1100kg,其中含水22kg。
若以SO3计,98%硫酸的质量分率为80%。
由式(4—44)得
反应结束后,磺化液含硫酸35.2kg,水21.4kg。
以SO3计,硫酸的质量分率为50。
8%.则
所以有
反应消耗的甲苯量为979kg,则
(3)反应产物(磺化液、脱水器排出的水)带走的热量Q4
Q4=1906.9x1.59x(140—25)+193。
1x4.18x(65—25)=3.77x105KJ
(4)由题意知
Q5=1.3x105KJ
Q6=6.2x104KJ
Q7=9.8x105KJ
所以
Q2=Q4+Q5+Q6+Q7—Q1—Q3=2。
12x105KJ
甲苯磺化过程热量平衡表
输
出
项目名称
热量/KJ
输
入
项目名称
热量/KJ
甲苯:
1000kg
1.66x104
磺化液:
1906。
9kg
3。
77x105
浓硫酸:
1100kg
脱水器排水:
193。
1kg
过程热效应
1。
32x106
设备升温
1.3x105
补充加热
2.12x105
设备表面散热
6。
2x104
冷却水带走热量
9.8x105
合计
1。
55x106
合计
1.55x106
解法二:
对甲苯磺化过程进行热量衡算的目的是为了确定磺化过程中的补充加热量。
依题意可将甲苯磺化装置(包括磺化釜、回流冷凝器和脱水器等)作为衡算对象。
此时,输入及输出磺化装置的物料还应包括进、出回流冷凝器的冷却水,其带出和带入热量之差即为回流冷凝器移走的热量。
若将过程的热效应作为输入热量来考虑,则可绘出如下图所示的热量衡算示意图.
基准温度:
0℃(若取25℃作为基准,结果又如何?
)
(1)反应原料带入的热量Q1
Q1=1000x1.71x(30—0)+1100x1。
47x(30-0)=99884.1=9.98x104(KJ)
(2)甲苯磺化过程热效应Q3
甲苯磺化过程可以看出是按下列步骤进行
①原始硫酸(98%)反应硫酸(100%)+分离酸+Q分离
②C7H9+反应硫酸(100%)C7H8SO3H+H2O+Qr
③分离酸+H2O残余酸+Q稀释
Q分离=m原q原—m反q反—m分q分
Q稀释=m分q分-m残q残
上两式相加,则有Q分离+Q稀释=m原q原—m反q反-m残q残
m原=1100kg,原始硫酸浓度为98%,所以n=2,由式(4-47)得
q原=766.2—1357x2/(2+49)=713(KJ/kg酸)
参与反应的纯硫酸质量m反=(1500.8+168.4+161。
1)/172x98=1042.85(kg),因参与反应的是纯硫酸,所以n=0,由式(4-47)得
q反=766.2-1357x0/(0+49)=766.2(KJ/kg酸)
磺化反应结束后,磺化液中含硫酸35。
2kg、水21.4kg,所以
m残=35。
2+21.4=56。
6kg,n=21.4/56。
6x100=37。
8
q残=766。
2-1357x37.8/(37.8+49)=175.25(KJ/kg酸)
Q分离+Q稀释=m原q原-m反q反—m残q残
=1100x713—1042.85x766.2-56.6x175。
25=—24650。
82(KJ)
Qr=1042。
85x1000x117。
2/98=1247163.47(KJ)
Q3=Qr+Q分离+Q稀释=1247163.47—24650。
82=1222512.65=1.22x106(KJ)
(3)反应产物(磺化液、脱水器排出的水)带走的热量Q4
Q4=1906.9x1.59x(140-0)+193。
1x4。
18x(65—0)
=476941。
21=4.77x105KJ
(4)由题意知
Q5=1.3x105KJ
Q6=6.2x104KJ
Q7=9.8x105KJ
所以
Q2=Q4+Q5+Q6+Q7-Q1-Q3=4.77x105+1.3x105+6。
2x104+9.8x105-9。
98x104-1。
22x106=3。
29x105KJ
甲苯磺化过程热量平衡表
输
出
项目名称
热量/KJ
输
入
项目名称
热量/KJ
甲苯:
1000kg
9。
99x104
磺化液:
1906。
9kg
4。
77x105
浓硫酸:
1100kg
脱水器排水:
193.1kg
过程热效应
1。
22x106
设备升温
1。
3x105
补充加热
3.29x105
设备表面散热
6.2x104
冷却水带走热量
9.8x105
合计
1.65x106
合计
1。
65x106
4-2、硝基苯的磺化采用60%的发烟硫酸作磺化剂在间歇操作的磺化锅内进行。
主反应为:
副反应为:
硝基苯的转化率为100%,硝基苯-磺化物的选择性系数为0.9,物料衡算的结果如下图所示(下图中质量单位为kg)。
根据条件,计算磺化过程的热效应.磺化温度为408K.(温度对反应热的影响忽略)。
解:
由题意知,硝基苯的磺化过程热效应包括60%发烟硫酸的浓度变化热QP和硝基苯进行主、副反应的反应热Qr,即
。
(1)60%发烟硫酸的浓度变化热QP:
①反应中共加入60%浓硫酸的质量为1203。
5kg,其中含水87。
9kg。
以SO3表示60%发烟硫酸的质量分数为(60+40x80/98)%=92.7%
则有m=0.927,T=408K=135℃,所以由公式(4—44)得
②反应结束后,磺化液含SO3400.1kg,水87。
9kg。
以SO3的质量分率为400。
1/(400。
1+87.9)=0.82,则由公式(4-44)得
因此,
(2)磺化反应热Qr(主反应Qr1+副反应Qr2)的计算:
①主反应Qr1:
由式
来计算反应热。
主反应中各物质燃烧热的估算:
SO3本身为完全氧化的产物,则有
用卡拉奇法估算硝基苯(C6H5NO2)的燃烧热:
C6H5NO2+29/2
=6CO2+5/2H2O+NO2
则
k(NO2)=1,
查表4—7得△(Ar-NO2)=54。
4KJ/mol,所以有
用卡拉奇法估算硝基苯(NO2C6H4SO3H)的燃烧热:
NO2C6H4SO3H+29/2
=6CO2+5/2H2O+NO2+SO3
则
,k(NO2)=1,k(SO3H)=1;
查表4-7得△(Ar-NO2)=54。
4KJ/mol;
△(Ar-SO3H)=—97。
906KJ/mol
另外,参与主反应的硝基苯的物质的量为1485。
4/203=7.32kmol;一磺化物(NO2C6H4SO3H)的生成量为1485。
4/203=7。
32kmol,则有
②副反应Qr2:
由式
来计算反应热。
副反应中各物质燃烧热的估算:
SO3本身为完全氧化的产物,则有
用卡拉奇法估算硝基苯(C6H5NO2)的燃烧热:
用卡拉奇法估算硝基苯【NO2C6H3(SO3H)2】的燃烧热:
NO2C6H3(SO3H)2+29/2
=6CO2+5/2H2O+NO2+2SO3
则
k(NO2)=1,k(SO3H)=2;
查表4-7得△(Ar-NO2)=54。
4KJ/mol;
△(Ar—SO3H)=—97。
906KJ/mol
另外,参与副反应的硝基苯的物质的量为230。
1/283=0。
813kmol;二磺化物【NO2C6H4(SO3H)2】生成量为230.1/283=0.813kmol,则有
那么,
最终,磺化过程的热效应Q3为
Q3为正,因此磺化过程需吸收的热量为-5.43x105KJ。
4—3、用1876kg混酸(HNO332%、H2SO456%、H2O12%)对1052。
6kg含量为95%的乙苯进行硝化,乙苯的转化率100%,全部生成一硝基乙苯,其中对位、邻位与间位的比例为50:
44:
6.已知硝化反应温度为40℃,求硝化过程热效应。
解:
由题意知,乙苯的硝化过程热效应包括混酸的浓度变化热QP和乙苯进行主、副反应的反应热Qr,即
。
(1)物料衡算
反应中共加入混酸的质量为1876kg,其中含HNO3600。
32kg;含H2SO41050。
56kg;含水225.12kg。
由题意知,乙苯的转化率100%,则生成的对位、邻位与间位一硝基乙苯的总量为
,其中
对硝基乙苯:
1424.5x50%=712.25kg
邻-硝基乙苯:
1424.5x44%=626。
78kg
间硝基乙苯:
1424.5x6%=85.47kg
参与反应的HNO3的量为
剩余HNO3的量为
剩余H2SO4:
600.32kg
剩余H2O(原混酸中):
225。
12kg
硝化反应生成的H2O:
所以,物料衡算的结果如下图所示:
(2)混酸的浓度变化热QP:
由盖斯定律,得
①反应前,混酸的无限稀释热q:
q1的计算:
反应前混酸含水量为12%,则n=12,由式(4—47)得
q2的计算:
反应前混酸含水量为12%,则n=12,由式(4—48)得
则有
②反应后,混酸的无限稀释热q`:
q'1的计算:
反应后混酸含水量为394。
93/1451。
49=27。
21%,则n=27。
21,由式(4-47)得
q’2的计算:
反应后混酸含水量为27。
21%,则n=27。
21,由式(4-48)得
则有
因此有,
(3)硝化反应热Qr的计算
①生成对硝基乙苯的反应热Qr1
由式
来计算反应热。
生成对硝基乙苯的反应中各物质燃烧热的估算:
C2H5C6H5+HNO3=C2H5C6H4NO2+H2O
用卡拉奇法估算乙苯(C2H5C6H5)的燃烧热:
C2H5C6H5+21
=8CO2+5H2O
则
,k(-C2H5)=1
查表4-7得△(C2H5—Ar)=-14。
6KJ/mol所以有
硝酸(HNO3)为完全氧化的产物,其燃烧热为0。
用卡拉奇法估算对硝基苯(C2H5C6H4NO2)的燃烧热:
C2H5C6H4NO2+41/2
=8CO2+9/2H2O+NO2
则
,k(NO2)=1,k(C2H5)=1
查表4-7得△(Ar-NO2)=54。
4KJ/mol,
△(C2H5—Ar)=-14。
6KJ/mol所以有
另外,生成对硝基乙苯的反应中,乙苯参与反应的物质的量为712.25/151=4。
72kmol;对硝基乙苯的生成量为712.25/151=4。
72kmol,则有
②生成邻—硝基乙苯的反应热Qr2
由式
来计算反应热。
生成对硝基乙苯的反应中各物质燃烧热的估算:
C2H5C6H5+HNO3=C2H5C6H4NO2+H2O
用卡拉奇法估算乙苯(C2H5C6H5)的燃烧热:
C2H5C6H5+21
=8CO2+5H2O
则
k(—C2H5)=1
查表4—7得△(C2H5-Ar)=-14。
6KJ/mol所以有
硝酸(HNO3)为完全氧化的产物,其燃烧热为0。
用卡拉奇法估算对硝基苯(C2H5C6H4NO2)的燃烧热:
C2H5C6H4NO2+41/2
=8CO2+9/2H2O+NO2
则
,k(NO2)=1,k(C2H5)=1
查表4-7得△(Ar-NO2)=54.4KJ/mol,
△(C2H5-Ar)=—14。
6KJ/mol所以有
另外,生成对硝基乙苯的反应中,乙苯参与反应的物质的量为626.78/151=4.15kmol;对硝基乙苯的生成量为626.78/151=4.15kmol,则有
③生成间-硝基乙苯的反应热Qr3
由式
来计算反应热.
生成对硝基乙苯的反应中各物质燃烧热的估算:
C2H5C6H5+HNO3=C2H5C6H4NO2+H2O
用卡拉奇法估算乙苯(C2H5C6H5)的燃烧热:
C2H5C6H5+21
=8CO2+5H2O
则
,k(—C2H5)=1
查表4—7得△(C2H5—Ar)=-14.6KJ/mol所以有
硝酸(HNO3)为完全氧化的产物,其燃烧热为0。
用卡拉奇法估算对硝基苯(C2H5C6H4NO2)的燃烧热:
C2H5C6H4NO2+41/2
=8CO2+9/2H2O+NO2
则
,k(NO2)=1,k(C2H5)=1
查表4—7得△(Ar-NO2)=54.4KJ/mol,
△(C2H5—Ar)=—14。
6KJ/mol所以有
另外,生成对硝基乙苯的反应中,乙苯参与反应的物质的量为85。
47/151=0.57kmol;对硝基乙苯的生成量为85。
47/151=0。
57kmol,则有
因此,乙苯生成一硝基乙苯的反应热Q为
乙苯生成一硝基乙苯的反应需吸收的热量为5。
16x105KJ.
4-4、某工厂要生产一套萘1,5—二磺酸双钠盐。
生产该产品为间歇生产,要经过磺化反应、盐析、精制三个阶段.生产规模为300吨/年.工人的年操作时间为300天,一天24小时三班操作.反应的转化率为100%,收率为60%,其中单磺化反应为80%,双磺化反应为75%,其余均为异构体.原料的规格:
精萘98%;浓硫酸98%;发烟硫酸20%。
磺化工艺如下:
在生产操作中,先将硫酸及发烟硫酸(合计)投入磺化反应锅内,将底酸冷至10℃,然后开始将萘分批加入,进行单磺反应,控制反应温度≤40℃,约反应3小时后将磺化温度调整为55℃。
保温2小时后,将物料冷至30℃以下,再滴加发烟硫酸进行双磺反应,滴加的速度以控制反应温度≤40℃为宜,加毕,保温4小时,磺化结束。
投料比为:
萘:
浓硫酸:
发烟硫酸(单磺化):
发烟硫酸(双磺化)=1:
0.4:
1。
2:
1。
4。
对磺化反应锅进行热量衡算,计算加热剂和冷却剂的用量和反应锅的换热面积。
列出常规手册上查不到的一些数据:
1、萘的比热:
0。
31Kca/(kg·℃)《化学工程手册》l
2、发烟硫酸的比热:
0。
3395Kcal/(kg·℃),《硫酸工作者手册》
3、反应产生异构物的比热:
0。
338Kcal/(kg·℃)
4、单磺化反应产物奈磺酸的比热:
0。
422Kcal/(kg·℃)
5、双磺化反应产物奈二磺酸的比热:
0。
367Kcal/(kg·℃).、
6、单磺化、双磺化反应后的废酸(H2SO4)的比热:
0。
348Kcal/(kg·℃)
7、奈磺酸的生成热:
一124.8Kcal/mol。
8、奈二磺酸的生成热:
—270.2Kcal/mol
9、萘的生成热:
18.4Kcal/mol
4-5、
4-6、
4—7、
4-8、