合肥高考化学铝及其化合物推断题的综合热点考点难点.docx
《合肥高考化学铝及其化合物推断题的综合热点考点难点.docx》由会员分享,可在线阅读,更多相关《合肥高考化学铝及其化合物推断题的综合热点考点难点.docx(19页珍藏版)》请在冰豆网上搜索。
合肥高考化学铝及其化合物推断题的综合热点考点难点
合肥高考化学铝及其化合物推断题的综合热点考点难点
一、铝及其化合物
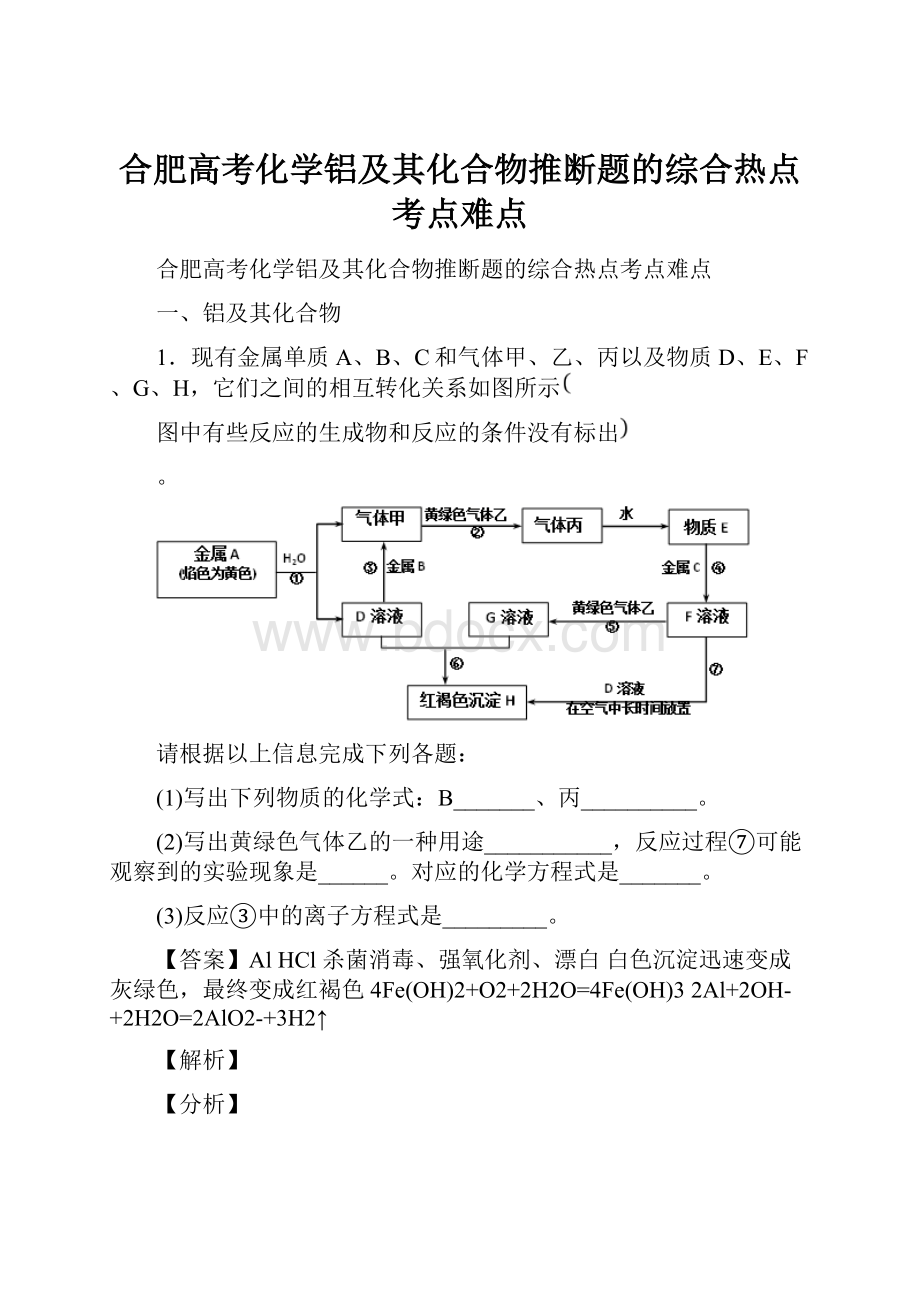
1.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示
图中有些反应的生成物和反应的条件没有标出
。
请根据以上信息完成下列各题:
(1)写出下列物质的化学式:
B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】AlHCl杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色4Fe(OH)2+O2+2H2O=4Fe(OH)32Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
【分析】
金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
【详解】
根据上述分析可知A是Na,B是Al,C为Fe,气体甲是H2,气体乙是Cl2,气体丙是HCl;D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3。
(1)根据上述分析可知,物质B是Al,丙是HCl;
(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl和HClO,HClO具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;
(3)FeCl2与NaOH溶液发生反应:
FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:
4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;
(4)反应③是Al与NaOH溶液发生反应产生NaAlO2和H2,反应的离子方程式为:
2Al+2OH-+2H2O=2AlO2-+3H2↑。
【点睛】
本题是无机物推断,物质的颜色及转化关系中特殊反应是物质推断的突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,试题培养了学生的分析能力及逻辑推理能力。
2.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A_____________、B___________、C______________、F_____________、H____________、乙______________
(2)写出下列反应化学方程式:
反应①_________________________________________________
反应⑤_________________________________________________
反应⑥_________________________________________________
【答案】NaAlFeFeCl2Fe(OH)3Cl22Na+2H2O=2NaOH+H2↑2FeCl2+Cl2=2FeCl3FeCl3+3NaOH=Fe(OH)3↓+3NaCl
【解析】
【分析】
【详解】
金属单质A的焰色为黄色,则A为Na;反应①为Na与水反应生成NaOH和H2,则物质D为NaOH,气体为H2;金属B与NaOH反应生成H2,则金属B为Al;黄绿色气体为Cl2,反应②为H2与Cl2化合成HCl,则气体丙为HCl,物质E为盐酸;金属C与盐酸反应生成F,F与Cl2反应生成物质G,G与NaOH反应得红棕色沉淀,则金属C为Fe,F为FeCl2,G为FeCl3;
(1)A、B、C、F、H、乙的化学式依次为Na、Al、Fe、FeCl2、Fe(OH)3、Cl2。
(2)反应①的化学方程式为2Na+2H2O=2NaOH+H2↑;
反应⑤的化学方程式为Cl2+2FeCl2=2FeCl3;
反应⑥的化学方程式为FeCl3+3NaOH=Fe(OH)3↓+3NaCl。
3.A、B、C、D均为中学化学中常见的物质,它们之间转化关系如图(部分产物和条件已略去),请回答下列问题:
(1)若A为CO2气体,D为NaOH溶液,则B的化学式为_________。
(2)若A为AlCl3溶液,D为NaOH溶液,则C的名称为_________。
(3)若A和D均为非金属单质,D为双原子分子,则由C直接生成A的基本反应类型为_________。
(4)若常温时A为气态氢化物,B为淡黄色固体单质,则A与C反应生成B的化学方程式为_________。
(5)若A为黄绿色气体,D为常见金属,则A与C溶液反应的离子方程式为_________。
下列试剂不能鉴别B溶液与C溶液的是_________(填字母编号)。
a.NaOH溶液b.盐酸c.KSCN溶液d.酸性KMnO4溶液
【答案】NaHCO3偏铝酸钠分解反应
b
【解析】
【分析】
【详解】
(1)若A为CO2与过量的D即NaOH反应,生成碳酸氢钠;碳酸氢钠溶液与NaOH反应可得到碳酸钠溶液;碳酸钠溶液又可以与CO2反应生成碳酸氢钠;所以B的化学式为NaHCO3;
(2)若A为AlCl3,其与少量的NaOH反应生成Al(OH)3沉淀,Al(OH)3继续与NaOH反应生成偏铝酸钠;偏铝酸钠溶液和氯化铝溶液又可以反应生成Al(OH)3;所以C的名称为偏铝酸钠;
(3)若A,D均为非金属单质,且D为双原子分子,那么推测可能为性质较为活泼的O2或Cl2,A则可能为P,S或N2等;进而,B,C为氧化物或氯化物,C生成单质A的反应则一定为分解反应;
(4)淡黄色的固体有过氧化钠,硫单质和溴化银;根据转化关系,推测B为S单质;那么A为H2S,C为SO2,B为氧气;所以相关的方程式为:
;
(5)A为黄绿色气体则为Cl2,根据转化关系可知,该金属元素一定是变价元素,即Fe;那么B为FeCl3,C为FeCl2;所以A与C反应的离子方程式为:
;
a.NaOH与Fe2+生成白色沉淀后,沉淀表面迅速变暗变绿最终变成红褐色,而与Fe3+直接生成红褐色沉淀,a项可以;
b.盐酸与Fe2+,Fe3+均无现象,b项不可以;
c.KSCN溶液遇到Fe3+会生成血红色物质,而与Fe2+无现象,c项可以;
d.Fe2+具有还原性会使高锰酸钾溶液褪色,Fe3+不会使高锰酸钾溶液褪色,d项可以;答案选b。
4.已知A是由两种阳离子和一种阴离子组成的盐,且常用作净水剂,B是一种常见的两性氢氧化物。
试根据下列转化关系回答有关问题:
(1)试判断:
B为___,F为___;
(2)写出沉淀B与盐酸反应的离子方程式___;
(3)根据上述关系写出盐A的化学式___。
【答案】氢氧化铝或Al(OH)3硫酸钡或BaSO4Al(OH)3+3H+=Al3++3H2OKAl(SO4)2或K2SO4﹒Al2(SO4)3
【解析】
【分析】
已知A是由两种阳离子和一种阴离子组成的盐,且常用作净水剂,透过蓝色鈷玻璃观察时焰色反应呈紫色,该溶液中含有K+,故A是KAl(SO4)2;向溶液A中加入氨水,Al3+会发生反应:
Al3++3NH3·H2O==Al(OH)3↓+3NH4+,产生白色沉淀B是Al(OH)3,溶液C是(NH4)2SO4;Al(OH)3是两性氢氧化物,可以与强酸HCl发生反应:
Al(OH)3+3H+=Al3++3H2O,产生的溶液E是AlCl3;也可以与强碱NaOH发生反应:
Al(OH)3+NaOH=NaAlO2+2H2O,得到的溶液D是NaAlO2;向溶液C中加入Ba(NO3)2溶液,发生复分解反应产生BaSO4白色沉淀,该物质既不溶于水,也不溶于酸,所以沉淀F是BaSO4。
【详解】
(1)通过分析可知,B为Al(OH)3,F为BaSO4,故答案为:
氢氧化铝;硫酸钡或BaSO4;
(2)B是Al(OH)3,与盐酸反应的离子方程式是:
Al(OH)3+3H+=Al3++3H2O,故答案为:
Al(OH)3+3H+=Al3++3H2O;
(3)根据上述关系写出盐A是KAl(SO4)2,故答案为:
KAl(SO4)2或K2SO4﹒Al2(SO4)3。
5.把7.5g镁铝合金的粉末放入200ml4mol/L的盐酸中,往充分反应后的混合溶液中逐渐滴入一定物质的量浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如图所示。
(1)合金中镁的物质的量为_______。
(2)氢氧化钠的物质的量浓度为_______mol/L。
(3)V1=_______mL。
(4)写出该合金溶于足量NaOH溶液的化学方程式为_________。
【答案】0.2mol2450
【解析】
【分析】
镁铝合金与盐酸反应后溶液有铝离子、镁离子、以及剩余的氢离子;加入氢氧化钠后氢氧化钠先于氢离子反应,此时无沉淀产生,之后镁、铝离子开始沉淀,发生反应 Al3++3OH-═Al(OH)3↓、 Mg2++2OH-═Mg(OH)2↓,当沉淀达到最大值时溶液中的溶质只有NaCl,再继续滴加氢氧化钠,氢氧化铝沉淀开始溶解,发生反应Al(OH)3+OH-═AlO2-+2H2O,据此进行解答。
【详解】
(1)当滴加400mL氢氧化钠溶液时,沉淀达到最大值,此时溶液中的溶质为NaCl,根据元素守恒可知此时溶液中n(Cl-)=0.2L×4mol/L=0.8mol,由电荷守恒可知n(Na+)=n(Cl-)=0.8mol,即400mL氢氧化钠溶液中n(Na+)=0.8mol,则其浓度c(NaOH)=
;此时溶液中据图可知前50mL氢氧化钠溶液没有沉淀产生,即此时发生反应H++OH-=H2O,所以与镁铝合金反应后剩余的n(H+)=0.05L×2mol/L=0.1mol,则与镁铝合金反应的n(H+)=0.8mol-0.1mol=0.7mol,设镁铝合金中镁的物质的量为xmol,铝的物质的量为ymol,则有24x+27y=7.5g,根据电子守恒(镁铝失去的电子都转移给氢离子)可得2x+3y=0.7,联立解得x=0.2mol,y=0.1mol,故答案为:
0.2mol;
(2)根据
(1)可知答案为:
2;
(3)400mL至V1mL发生反应Al(OH)3+OH-═AlO2-+2H2O,根据
(1)可知镁铝合金中铝的物质的量为0.1mol,则生成氢氧化铝0.1mol,此段消耗n(OH-)=0.1mol,所以消耗的氢氧化钠体积V=
,即50mL,所以V1=400+50=450,故答案为:
450;
(4)该合金中铝单质可以与氢氧化钠溶液反应生成偏铝酸钠和氢气,故答案为:
。
【点睛】
解决本题的关键是理解沉淀达到最大值时溶液中的成分,之后再利用元素守恒、电子守恒等解决问题。
6.工业上以锂辉石为原料生产碳酸锂的部分工业流程如图所示:
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2+H2SO4(浓)
Li2SO4+Al2O3·4SiO2·H2O。
③某些物质的溶解度(S)如下表所示:
回答下列问题:
(1)从滤渣1中分离出Al2O3的流程如下所示:
写出生成沉淀的离子方程式:
___。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。
向滤液1中加入石灰乳的作用是___(运用化学平衡原理简述)。
(3)最后一个步骤中,用“热水洗涤”的理由是___。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择性透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中电解时所用的是___(填“阳离子交换膜”或“阴离子交换膜”)。
②电解后,LiOH溶液浓度增大的原因是___。
b中生成Li2CO3反应的化学方程式是___。
(5)磷酸亚铁锂电池总反应为FePO4+Li
LiFePO4,电池中的固体电解质可传导Li+,写出该电池放电时的正极反应:
___。
【答案】Al3++3NH3·H2O===Al(OH)3↓+3NH4+Ca(OH)2
Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀Li2CO3的溶解度随温度升高而减小阳离子交换膜阴极氢离子放电,锂离子向阴极移动2LiOH+NH4HCO3
Li2CO3↓+2H2O+NH3↑FePO4+Li++e-===LiFePO4
【解析】
【分析】
由工业流程图可知,锂辉石经过研磨、加热、酸化得到可溶性的硫酸锂、硫酸铝和不溶的二氧化硅,过滤得到滤液1和含有二氧化硅的滤渣1,向滤液1中加入石灰乳调节pH值后,再加入碳酸钠溶液,以增加溶液中Ca2+、OH-的浓度,使Mg(OH)2、CaCO3更利于析出,以便形成滤渣2,向滤液2中加入饱和碳酸钠溶液,反应生成碳酸锂沉淀,过滤、热水洗涤的原因是Li2CO3的溶解度随温度升高而减小,可减少Li2CO3的损失,得到最终产物碳酸锂,据此分析解答。
【详解】
(1)据已知信息①可知滤渣1中含有氧化铝和二氧化硅,氧化铝是两性氧化物,而二氧化硅是酸性氧化物,因此首先用盐酸溶解滤渣1,过滤后得到二氧化硅和氯化铝的溶液。
向滤液中通入足量的氨气即可生成氢氧化铝,灼烧氢氧化铝即可得到氧化铝,生成沉淀的离子方程式为Al3++3NH3·H2O===Al(OH)3↓+3NH4+,故答案为:
Al3++3NH3·H2O===Al(OH)3↓+3NH4+;
(2)石灰乳中存在氢氧化钙的溶解平衡Ca(OH)2
Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀,而钙离子与碳酸根结合生成碳酸钙沉淀,故答案为:
Ca(OH)2
Ca2++2OH-,Mg2+与OH-结合生成Ksp很小的Mg(OH)2沉淀,导致平衡右移,生成Mg(OH)2沉淀;
(3)根据表中数据可判断Li2CO3的溶解度随温度升高而减小,因此最后一个步骤中,用“热水洗涤”可以减少固体溶解而造成的损失,故答案为:
Li2CO3的溶解度随温度升高而减小;
(4)①电解池中阳极失去电子发生氧化反应,阴极氢离子放电,产生氢氧根离子,而锂离子向阴极移动,故a中电解时所用的是阳离子交换膜,故答案为:
阳离子交换膜;
②阴极得到电子,则溶液中的氢离子放电,由于阴极氢离子放电,产生氢氧根离子,而锂离子向阴极移动,所以电解后,LiOH溶液浓度增大。
根据原子守恒可判断LiOH溶液中加入少量NH4HCO3溶液并共热,除得到高纯Li2CO3外还有氨气和水生成,反应的化学方程式为2LiOH+NH4HCO3
Li2CO3↓+2H2O+NH3↑,故答案为:
阴极氢离子放电,锂离子向阴极移动;2LiOH+NH4HCO3
Li2CO3↓+2H2O+NH3↑;
(5)根据原电池的工作原理,正极上发生还原反应,得到电子,因此FePO4在正极上发生反应,即正极反应式为FePO4+Li++e-===LiFePO4,故答案为:
FePO4+Li++e-===LiFePO4。
7.某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)。
请回答:
(1)步骤Ⅰ中,发生的氧化还原反应的离子方程式为___,涉及到的分离操作是___。
(2)试剂X是___;溶液D是___。
(3)溶液E在空气中易被氧化,请设计一个简单的实验方案检验溶液E是否被氧化___。
(4)在步骤Ⅱ时,若用大理石与浓盐酸制取CO2并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。
为避免固体C减少,可采取的改进措施是___。
(5)工业上常用溶液E制取净水剂Na2FeO4,流程如图:
写出由Fe(OH)3制取Na2FeO4的离子方程式___。
(已知NaClO还原为NaCl)
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑过滤稀硫酸(或稀H2SO4;或硫酸)NaHCO3溶液(或碳酸氢钠溶液)取少量E溶液于试管中,滴入几滴硫氰化钾溶液,若溶液变为血红色,则说明E溶液已被氧化,反之,则未被氧化在通入CO2之前增加一个盛有饱和NaHCO3溶液的洗气瓶,除去HCl气体2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
【解析】
【分析】
Cu、Fe和Al,少量Al2O3和Fe2O3,氢氧化钠与Al、Al2O3反应,而Cu、Fe和Fe2O3不反应,过滤得到滤渣为Cu、Fe和Fe2O3,滤液为偏铝酸钠溶液和氢氧化钠溶液,向滤液中通入过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠溶液,过滤,向沉淀中加入盐酸生成氯化铝溶液,最终得到氯化铝固体;向滤渣为Cu、Fe和Fe2O3中加入稀硫酸,生成硫酸亚铁,最终得到绿矾,过滤得到Cu,Cu与氧气、硫酸反应得到硫酸铜。
【详解】
⑴步骤Ⅰ中,发生的氧化还原反应的是铝和氢氧化钠反应生成偏铝酸钠和氢气,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,Fe、Cu、Fe2O3不和氢氧化钠溶液反应,因此涉及到的分离操作是过滤;故答案为:
2Al+2OH-+2H2O=2AlO2-+3H2↑;过滤。
⑵将Fe、Cu中Fe溶于溶液中生成硫酸亚铁,因此试剂X是硫酸;溶液A为偏铝酸钠溶液,向溶液中通入过量二氧化碳,反应生成氢氧化铝沉淀和碳酸氢钠溶液,因此D是碳酸氢钠;故答案为:
稀硫酸(或稀H2SO4;或硫酸);NaHCO3溶液(或碳酸氢钠溶液)。
⑶溶液E在空气中易被氧化,亚铁离子被氧化生成铁离子,铁离子常用KSCN溶液来检验,因此简单的实验方案检验溶液E是否被氧化的实验为取少量E溶液于试管中,滴入几滴硫氰化钾溶液,若溶液变为血红色,则说明E溶液已被氧化,反之,则未被氧化;故答案为:
取少量E溶液于试管中,滴入几滴硫氰化钾溶液,若溶液变为血红色,则说明E溶液已被氧化,反之,则未被氧化。
⑷在步骤Ⅱ时,若用大理石与浓盐酸制取CO2并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,减少的主要原因是浓盐酸易挥发,挥发出的HCl与沉淀反应,为避免固体C减少,先用饱和碳酸氢钠溶液除掉挥发的HCl,再通入CO2;故答案为:
在通入CO2之前增加一个盛有饱和NaHCO3溶液的洗气瓶,除去HCl气体;故答案为:
在通入CO2之前增加一个盛有饱和NaHCO3溶液的洗气瓶,除去HCl气体。
⑸Fe(OH)3与NaClO反应生成NaCl和Na2FeO4,其制取Na2FeO4的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42−+3Cl-+5H2O;故答案为:
2Fe(OH)3+3ClO-+4OH-=2FeO42−+3Cl-+5H2O。
8.某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质。
现通过下列生产过程,从该样品中提纯Al2O3,并回收铁红。
流程如下:
(1)操作①是_________,在实验室进行该操作需要的玻璃仪器有_________。
(2)白色固体②是_________,样品和试剂①反应的化学方程式是_________。
(3)固体①加入适量稀盐酸,可能发生的反应有:
_______(用化学方程式表达)。
(4)溶液③中铁元素的存在形式是_________,如何用实验证明:
____。
(5)溶液③中通入某气体,该气体可以是_________(任写一种的化学式),红褐色固体制得铁红的化学方程式是_________。
【答案】过滤烧杯、漏斗、玻璃棒Al(OH)3Al2O3+2NaOH=2NaAlO2+H2OFe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑Fe2+取少量溶液于试管中,滴入KSCN溶液无变化,滴加氯水后变血红色O2或者Cl22Fe(OH)3
Fe2O3+3H2O
【解析】
【分析】
Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质,根据题中流程图可知,样品与试剂①反应得溶液①再通入CO2得白色沉淀②,该白色固体加热分解产生Al2O3,可推知试剂①为NaOH,得到的固体①为Cu、Fe、Fe2O3,溶液①为NaAlO2、NaOH混合溶液,通入过量CO2后得溶液②为NaHCO3溶液,白色固体②为Al(OH)3,Al(OH)3受热分解得Al2O3,固体①中加入盐酸得到固体粉末中铁有剩余,由于Fe会发生反应2Fe3++Fe=3Fe2+,则溶液③中主要含有Fe2+,经过操作①得红褐色固体应为Fe(OH)3,所以通入的气体应为氧化剂,可以是O2或Cl2,氢氧化铁受热分解得Fe2O3。
【详解】
(1)操作①是分离难溶性固体与可溶性液体混合物的方法,名称为过滤;在实验室进行过滤操作需要的玻璃仪器有烧杯、漏斗、玻璃棒;
(2)白色固体②受热分解产生Al2O3,则②是Al(OH)3,样品中含有Al2O3和试剂NaOH溶液反应产生NaAlO2和H2O,反应的化学方程式是Al2O3+2NaOH=2NaAlO2+H2O;
(3)固体①中含有Al2O3、Cu、Fe、Fe2O3,加入适量稀盐酸,由于反应后的固体粉末中含有Fe单质,则可能发生的反应有Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑;
(4)由于固体①中样品与适量盐酸反应后的固体粉末中含有Fe,结合Fe2O3+6HCl=2FeCl3+3H2O、2Fe3++Fe=3Fe2+可知溶液③中铁元素的存在形式是Fe2+,证明方法是:
取少量该溶液于试管中,滴入KSCN溶液无变化,滴加氯水后溶液变血红色;
(5)溶液③中含有Fe2+,向溶液③通入某气体后再加入足量NaOH溶液,产生红褐色的Fe(OH)3沉淀,该气体具有强的氧化性,气体可以是O2或者Cl2,红褐色固体Fe(OH)3不稳定,受热分解产生铁红Fe2O3,该反应的化学方程式是2Fe(OH)3
Fe2O3+3H2O。
【点睛】
本题以从Al2O3样品中提取氧化铝的工艺流程为线索,考查了氧化还原反应、化学试剂的使用、混合物的分离,正确理解制备流程及反应原理为解答关键,注意掌握铝及其化合物性质和转化关系,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力。
9.一种高效无机水处理剂——聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m。
它可通过调节AlCl3溶液的pH,促进其水解而结晶析出。
其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。
聚合氯化铝生产的工艺流程如下:
(1)搅拌加热操作过程中发生反应的离子方程式为______________________