届鲁科版电化学基本原理 单元测试.docx
《届鲁科版电化学基本原理 单元测试.docx》由会员分享,可在线阅读,更多相关《届鲁科版电化学基本原理 单元测试.docx(18页珍藏版)》请在冰豆网上搜索。
届鲁科版电化学基本原理单元测试
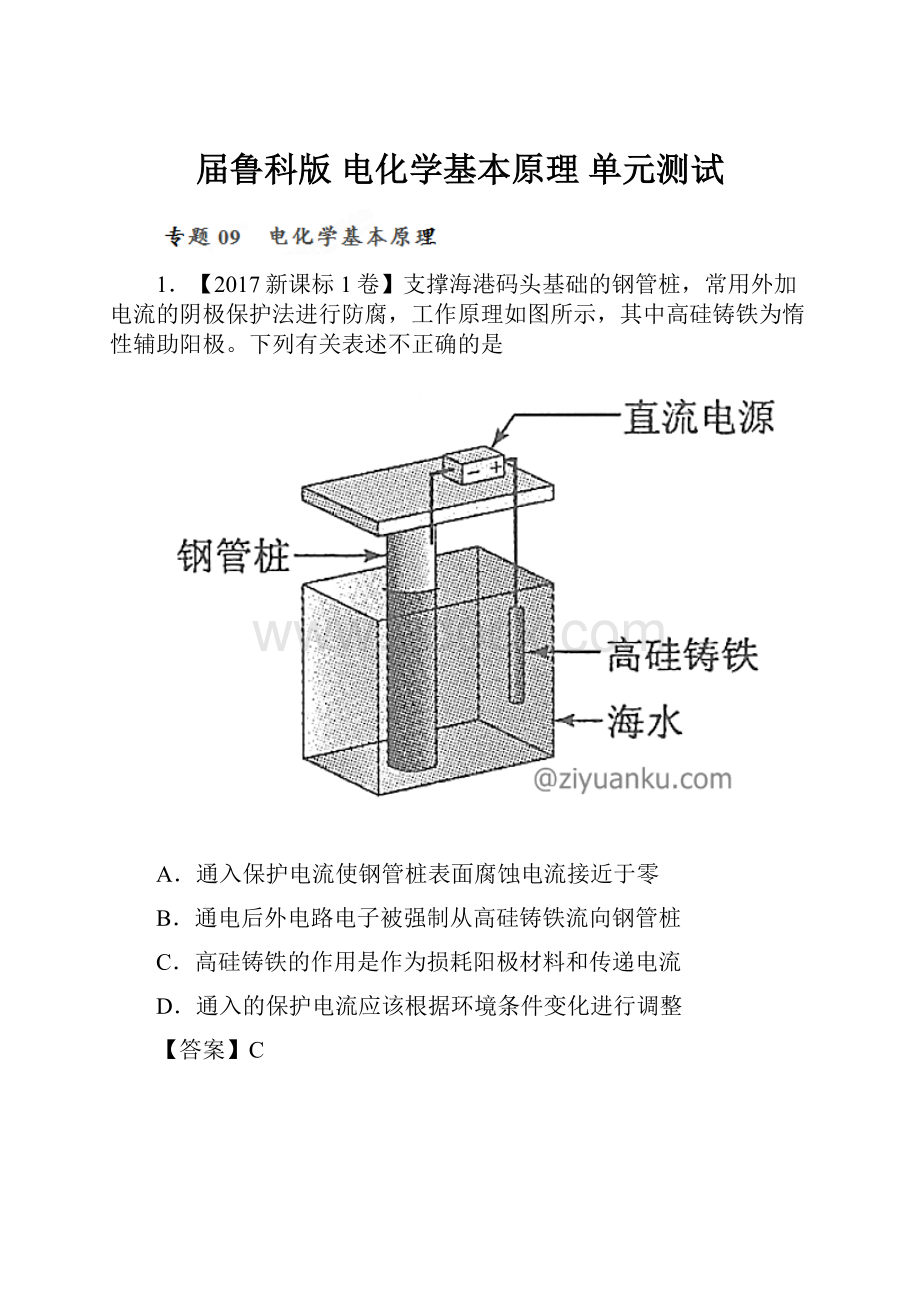
1.【2017新课标1卷】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。
下列有关表述不正确的是
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
【答案】C
【名师点睛】该题难度较大,明确电化学原理是以及金属的防腐蚀原理是解答的关键,钢管桩表面腐蚀电流的理解是难点,注意题干信息的挖掘,即高硅铸铁为惰性辅助阳极,性质不活泼,不会被损耗。
2.【2017新课标2卷】用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为
混合溶液。
下列叙述错误的是
A.待加工铝质工件为阳极
B.可选用不锈钢网作为阴极
C.阴极的电极反应式为:
D.硫酸根离子在电解过程中向阳极移动
【答案】C
【解析】A、根据原理可知,Al要形成氧化膜,化合价升高失电子,因此铝为阳极,故A说法正确;B、不锈钢网接触面积大,能增加电解效率,故B说法正确;C、阴极应为阳离子得电子,根据离子放电顺序应是H+放电,即2H++2e−=H2↑,故C说法错误;D、根据电解原理,电解时,阴离子移向阳极,故D说法正确。
【名师点睛】本题考查电解原理的应用,如本题得到致密的氧化铝,说明铝作阳极,因此电极方程式应是2Al−6e−+3H2O=Al2O3+6H+,这就要求学生不能照搬课本知识,注意题干信息的挖掘,本题难度不大。
3.【2017新课标3卷】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:
16Li+xS8=8Li2Sx(2≤x≤8)。
下列说法错误的是
A.电池工作时,正极可发生反应:
2Li2S6+2Li++2e-=3Li2S4
B.电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
【答案】D
【名师点睛】考查二次电池的使用,涉及原电池工作原理,原电池工作时负极发生氧化反应,正极发生还原反应,而电池充电时,原来的负极连接电源的负极为电解池的阴极,发生还原反应,而原来的正极连接电源的正极为电解池的阳极发生氧化反应,解题是通过结合反应原理,根据元素化合价的变化,判断放电时正负极发生的反应,再结合电解质书写电极反应方程式。
4.【2017江苏卷】下列说法正确的是
A.反应N2(g)+3H2(g)
2NH3(g)的ΔH<0,ΔS>0
B.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
C.常温下,Ksp[Mg(OH)2]=5.6×10−12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10−4mol·L−1
D.常温常压下,锌与稀H2SO4反应生成11.2LH2,反应中转移的电子数为6.02×1023
【答案】BC
【名师点睛】本题考查了对熵变、金属的电化学防腐措施、难溶电解质的沉淀溶解平衡、氧化还原反应中的电子转移、气体摩尔体积以及阿伏加德罗常数的掌握情况。
要求学生会判断一些常见反应的熵变,能合理运用熵判据和焓判据来判断一个反应能否自发进行;搞懂牺牲阳极的阴极保护法和外接电流的阴极保护法的原理及其区别;会进行有关溶度积的简单计算;会判断氧化还原反应中电子转移的方向和数目;弄清气体摩尔体积的使用条件及阿伏加德罗常数的含义和近似值。
5.【2016新课标1卷】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O−4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
【答案】B
【考点定位】考查电解原理的应用的知识。
【名师点睛】化学反应主要是物质变化,同时也伴随着能量变化。
电化学是化学能与电能转化关系的化学。
电解池是把电能转化为化学能的装置,它可以使不能自发进行的化学反应借助于电流而发生。
与外接电源正极连接的电极为阳极,与外接电源的负极连接的电极为阴极。
阳极发生氧化反应,阴极发生还原反应。
若阳极是活性电极(除Au、Pt、C之外的电极),则电极本身失去电子,发生氧化反应;若是惰性电极(Au、Pt、C等电极),则是溶液中的阴离子放电,放电的先后顺序是S2->I−>Br−>Cl−>OH−>含氧酸根离子,阴极则是溶液中的阳离子放电,放电顺序是Ag+>Hg2+>Fe3+>Cu2+>H+,与金属活动性顺序刚好相反。
溶液中的离子移方向符合:
同种电荷相互排斥,异种电荷相互吸引的原则,即阳离子向阴极区移动,阴离子向阳极区移动。
掌握电解池反应原理是本题解答的关键。
本题难度适中。
6.【2016新课标2卷】Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。
下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
【答案】B
【解析】
试题分析:
根据题意,电池总反应式为:
Mg+2AgCl=MgCl2+2Ag,正极反应为:
2AgCl+2e-=2Cl-+2Ag,负极反应为:
Mg-2e=Mg2+,A项正确,B项错误;对原电池来说,阴离子由正极移向负极,C项正确;由于镁是活泼金属,则负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑,D项正确;答案选B。
【考点定位】考查原电池的工作原理。
【名师点睛】本题以Mg-AgCl电池是一种以海水为电解质溶液的水激活电池为载体,考查原电池电极反应式的书写,离子的迁移方向等知识。
化学电源是高考中的热点,也是难点,学生要结合原电池的知识来推断试题给出的化学电源的工作原理,然后结合化合价的变化判断正、负极。
7.【2016新课标3卷】锌−空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)42-。
下列说法正确的是()
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为:
Zn+4OH–-2e–===Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
【答案】C
【考点定位】考查原电池和电解池的工作原理
【名师点睛】本题考查原电池和电解池工作原理,这是两个装置的重点,也是新电池的考查点,需要熟记。
电极反应式的书写是电化学中必考的一项内容,一般先写出还原剂(氧化剂)和氧化产物(还原产物),然后标出电子转移的数目,最后根据原子守恒和电荷守恒完成缺项部分并配平反应方程式,作为原电池,正极反应式为:
O2+2H2O+4e-=4OH-,负极电极反应式为:
Zn+4OH--2e-=Zn(OH)42-;充电是电解池,阳离子在阴极上放电,阴离子在阳极上放电,即阳离子向阴极移动,阴离子向阳极移动,对可充电池来说,充电时原电池的正极接电源正极,原电池的负极接电源的负极,不能接反,否则发生危险或电极互换,其电极反应式是原电池电极反应式的逆过程。
涉及到气体体积,首先看一下有没有标准状况,如果有,进行计算,如果没有必然是错误选项。
掌握原电池和电解池反应原理是本题解答的关键。
本题难度适中。
8.【2016北京卷】用石墨电极完成下列电解实验。
实验一
实验二
装置
现象
a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化
两个石墨电极附近有气泡产生;n处有气泡产生;……
下列对实验现象的解释或推测不合理的是
A.a、d处:
2H2O+2e-=H2↑+2OH-
B.b处:
2Cl--2e-=Cl2↑
C.c处发生了反应:
Fe-2e-=Fe2+
D.根据实验一的原理,实验二中m处能析出铜
【答案】B
【考点定位】本题主要是考查电解原理的应用
【名师点睛】化学反应主要是物质变化,同时也伴随着能量变化。
电化学是化学能与电能转化关系的化学。
电解池是把电能转化为化学能的装置,它可以使不能自发进行的化学借助于电流而发生。
与外接电源正极连接的电极为阳极,与外接电源的负极连接的电极为阴极。
阳极发生氧化反应,阴极发生还原反应。
若阳极是活性电极(除Au、Pt、C之外的电极),则电极本身失去电子,发生氧化反应;若是惰性电极(Au、Pt、C等电极),则是溶液中的阴离子放电,放电的先后顺序是S2->I->Br->Cl->OH->含氧酸根离子,阴极则是溶液中的阳离子放电,放电顺序是Ag+>Hg2+>Fe3+>Cu2+>H+,与金属活动性顺序刚好相反。
因此掌握电解池反应原理是本题解答的关键。
注意依据实验现象分析可能发生的电极反应。
9.【2016浙江卷】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。
该类电池放电的总反应方程式为:
4M+nO2+2nH2O=4M(OH)n。
已知:
电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
下列说法不正确的是
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C.M–空气电池放电过程的正极反应式:
4Mn++nO2+2nH2O+4ne–=4M(OH)n
D.在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
【答案】C
【考点定位】考查原电池的工作原理。
【名师点睛】原电池是将化学能变成电能的装置。
负极失去电子,被氧化,正极得到电子被还原。
注意原电池中的正负极的反应,氧气肯定在正极得到电子,金属肯定在负极失去电子,结合原电池的电解质的环境分析其电极反应的书写。
在电解质溶液中,阴离子向负极移动,阳离子向正极移动,电子从负极经过导线流向正极。
10.【2016海南卷】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。
下列说法正确的是
A.Zn为电池的负极
B.正极反应式为2FeO42−+10H++6e−=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时
向负极迁移
【答案】AD
【解析】A.根据化合价升降判断,Zn化合价只能上升,故为负极材料,K2FeO4为正极材料,正确;B.KOH溶液为电解质溶液,则正极反应式为2FeO42−+6e−+8H2O=2Fe(OH)3+10OH−,错误;C.该电池放电过程中电解质溶液浓度减小,错误;D.电池工作时阴离子OH−向负极迁移,正确;故选AD。
考点:
考查原电池原理及化学电源
【名师点睛】原电池原理是建立在氧化还原和电解质溶液基础上,借助氧化还原反应实现化学能与电能的相互转化,是高考命题重点,题目主要以选择题为主,主要围绕原电池的工作原理、电池电极反应的书写与判断、新型电池的开发与应用等进行命题。
11.【2016上海卷】图1是铜锌原电池示意图。
图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示
A.铜棒的质量B.c(Zn2+)
C.c(H+)D.c(SO42-)
【答案】C
【考点定位】考查原电池基本原理和溶液中离子浓度变化。
【名师点睛】原电池原理无论在工业生产、日常生活和科学研究领域都有着重要用途,尤其在金属的腐蚀与防护、新能源的开发和利用等方面有着不可替代的作用,因此也是历年高考必考知识点之一。
无论题型如何变化,如果把握原电池的工作原理、电极反应式和电池总反应方程式,问题都会迎刃而解。
在原电池中,一般活泼金属作负极、失去电子、发生氧化反应(金属被氧化)、逐渐溶解(或质量减轻);不活泼金属(或导电的非金属)作正极、发生还原反应、有金属析出(质量增加)或有气体放出;电子从负极流出经过外电路流回正极,电流方向正好相反;溶液中离子浓度变化及移动方向由电极反应决定。
12.【2016四川卷】某电动汽车配载一种可充放电的锂离子电池。
放电时电池的总反应为:
Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。
下列关于该电池的说法不正确的是
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe-=xLi++C6
C.充电时,若转移1mole-,石墨C6电极将增重7xg
D.充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+Li+
【答案】C
【考点定位】考查电化学原理的应用,化学电源。
【名师点睛】电化学问题分析思路:
首先要根据题给信息和装置确定考查的是原电池和电解池,然后根据反应类型、电子和电流方向、电解质中的离子流向、电极材料和实验现象等确定装置的两极,结合电极材料和离子种类、放电顺序确定放电的微粒,结合溶液的酸碱性、反应物和生成物结合原子守恒和电荷守恒确定电极反应式,进一步确定总反应进行作答。
涉及电化学计算要紧抓电子守恒,涉及酸碱性分析要根据电极反应分析电极周围的pH变化,根据总反应分析整个过程中的pH变化。
13.【2016天津卷】下列叙述正确的是()
A.使用催化剂能够降低化学反应的反应热(△H)
B.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
C.原电池中发生的反应达平衡时,该电池仍有电流产生
D.在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小
【答案】D
【解析】
试题分析:
A.使用催化剂不能改变化学反应的反应热(△H),错误;B.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度有关,氧气的浓度越大,腐蚀速率越快,错误;C.原电池中发生的反应达到平衡时,两端就不存在电势差了,无法形成电压驱动电子移动,无法形成电流,错误;D.根据Ksp的计算公式,二者化学式形式相似,在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小,正确;故选D。
【考点定位】考查反应热和焓变、金属的腐蚀与防护、原电池原理、难溶电解质的溶解平衡
【名师点晴】本题考查了催化剂对反应热的影响、金属的腐蚀与防护、原电池原理、难溶电解质的溶解平衡等知识点。
考查的知识点均为基础知识。
本题的易错选项是C,原电池中产生电流是因为正负极间存在电势差,当原电池中的反应达到平衡时,两端就不存在电势差了,也就无法形成电压驱动电子移动,无法形成电流了。
提醒同学们在学习过程中对于其他学科的基础知识要作为常识储备起来,提高自己的科学素养。
14.【2015福建卷】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。
下列说法正确的是
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从b极区向a极区迁移
C.每生成1molO2,有44gCO2被还原
D.a电极的反应为:
3CO2+16H+-18e-=C3H8O+4H2O
【答案】B
【考点定位】考查电解池反应原理的应用的知识。
15.【2015新课标1卷】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
【答案】A
【考点定位】原电池原理;难度为一般等级
16.【2015浙江卷】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。
下列说法不正确的是()
A.X是电源的负极
B.阴极的反应式是:
H2O+2eˉ=H2+O2ˉ
CO2+2eˉ=CO+O2ˉ
C.总反应可表示为:
H2O+CO2H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
【答案】D
【考点定位】本题主要是考查电解原理及其应用、电极判断、电极反应式书写、电极产物判断与计算等。
17.【2015天津卷】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
【答案】C
【解析】由图像可知该原电池反应原理为Zn+Cu2+=Zn2++Cu,故Zn电极为负极失电子发生氧化反应,Cu电极为正极得电子发生还原反应,故A项错误;该装置中为阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,故B项错误;电解过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池,乙池中Cu2++2e—=Cu,故乙池中为Cu2+~Zn2+,摩尔质量M(Zn2+)>M(Cu2+)故乙池溶液的总质量增加,C项正确;该装置中为阳离子交换膜只允许阳离子和水分子通过,电解过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池保持溶液中电荷平衡,阴离子并不通过交换膜,故D项错误;本题选C。
【考点定位】本题主要考查了原电池的反应原理,涉及反应类型、离子浓度的变化、电极的判断、离子的移动方向的判断等
18.【2015四川卷】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:
Cl-+2OH--2e-=ClO-+H2O
C.阴极的电极反应式为:
2H2O+2e-=H2↑+2OH-
D.除去CN-的反应:
2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
【答案】D
【考点定位】电化学基础知识
19.【2015上海卷】研究电化学腐蚀及防护的装置如图所示。
下列有关说法错误的是
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为:
O2+2H2O+4e→4OH–
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为:
2H++2e→H2↑
【答案】D
【解析】由于活动性:
Fe>石墨,所以铁、石墨及海水构成原电池,Fe为负极,失去电子被氧化变为Fe2+进入溶液,溶解在海水中的氧气在正极石墨上得到电子被还原,比没有形成原电池时的速率快,正确。
B.d为石墨,由于是中性电解质,所以发生的是吸氧腐蚀,石墨上氧气得到电子,发生还原反应,电极反应为:
O2+2H2O+4e→4OH–,正确。
C.若d为锌块,则由于金属活动性:
Zn>Fe,Zn为原电池的负极,Fe为正极,首先被腐蚀的是Zn,铁得到保护,铁片不易被腐蚀,正确。
D.d为锌块,由于电解质为中性环境,发生的是吸氧腐蚀,在铁片上电极反应为:
O2+2H2O+4e→4OH–,错误。
【考点定位】考查金属的电化学腐蚀及防护的知识。
20.【2015江苏卷】一种熔融碳酸盐燃料电池原理示意如图。
下列有关该电池的说法正确的是()
A.反应CH4+H2O
3H2+CO,每消耗1molCH4转移12mol电子
B.电极A上H2参与的电极反应为:
H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:
O2+2CO2+4e-=2CO32-
【答案】D
【考点定位】考查原电池的工作原理和电极反应式书写。