物质的检验练习高考化学二轮复习专题训练.docx
《物质的检验练习高考化学二轮复习专题训练.docx》由会员分享,可在线阅读,更多相关《物质的检验练习高考化学二轮复习专题训练.docx(30页珍藏版)》请在冰豆网上搜索。
物质的检验练习高考化学二轮复习专题训练
专题23物质的检验
1.镁及其化合物是实验设计的热点载体,查阅资料。
ⅰ
2NO2+2NaOH=NaN
O2+NaNO3+H2O
ⅱ
Mg3N2与水反应
ⅲ
常温下,NH3·H2O、CH3COOH的电离常数都等于1.8×10-5
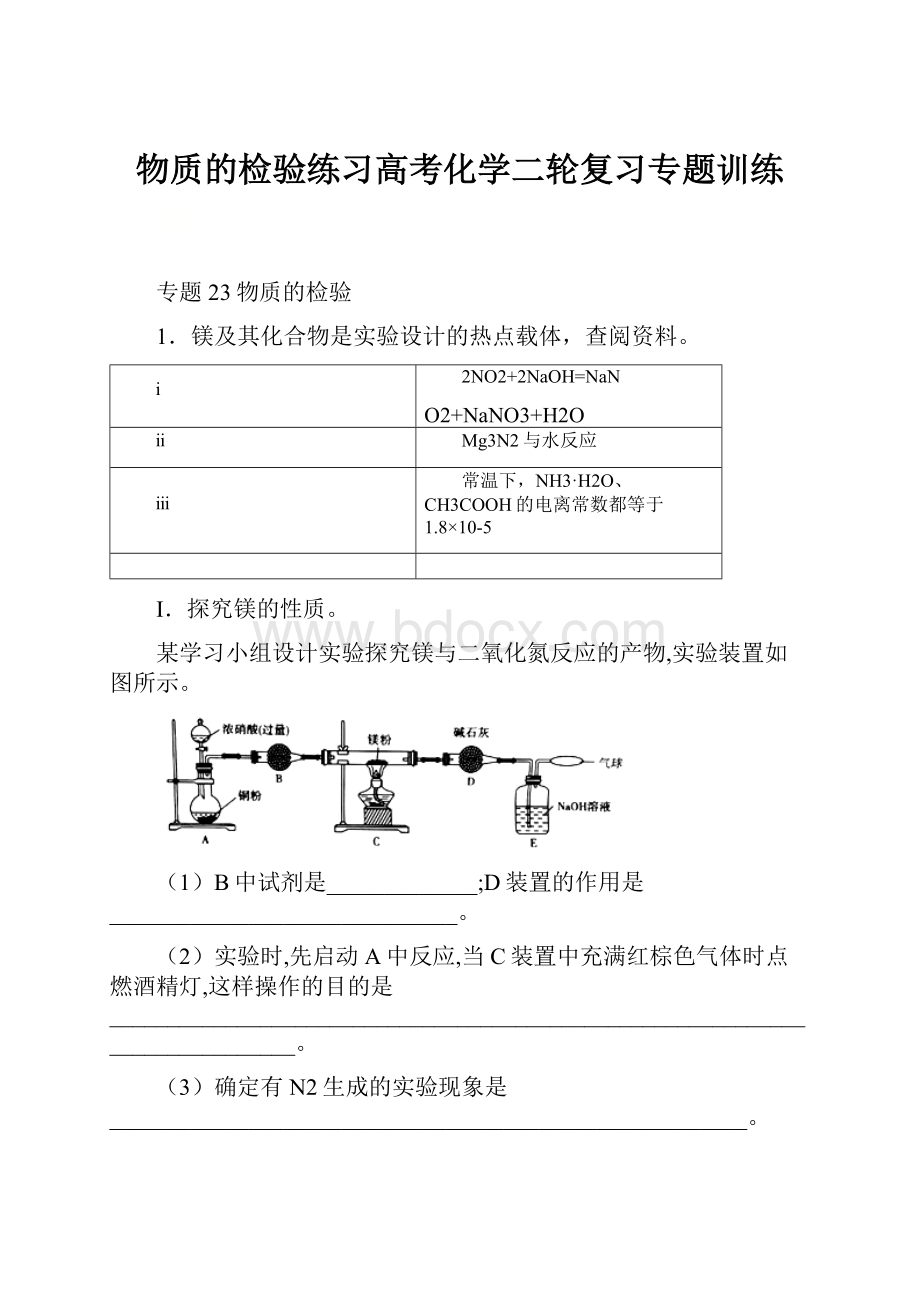
Ⅰ.探究镁的性质。
某学习小组设计实验探究镁与二氧化氮反应的产物,实验装置如图所示。
(1)B中试剂是_____________;D装置的作用是______________________________。
(2)实验时,先启动A中反应,当C装置中充满红棕色气体时点燃酒精灯,这样操作的目的是____________________________________________________________________________。
(3)确定有N2生成的实验现象是_______________________________________________________。
(4)实验完毕后,设计实验确认产物中有Mg3N2取少量C中残留固体于试管中,滴加蒸馏水,_____________________,则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。
C中发生反应的化学方程式为_____________________________________________________。
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。
供选试剂有:
氢氧化镁、蒸馏水、硝酸氨溶液、盐酸、醋酸铵溶液。
取少量氢氧化镁粉
末投入氯化氨溶液中,振荡、白色粉末全部溶解。
为了探究其原因,他们提出两种假设。
假设1:
氯化铵溶液呈酸性,H++OH-=H2O,促进Mg(OH)2溶解;
假设2:
NH4++OH-=NH3·H2O,促进Mg(OH)2溶解。
(6)请你帮他们设计实验探究哪一种假设正确:
____________________________________________。
【答案】P2O5等吸收E中挥发出来的水蒸气排尽装置内空气,避免O2、CO2、N2等与镁反应E中产生气泡,瘪气球缓慢鼓起有刺激性气味的气体逸出(产生的气体能使湿润红色石蕊试纸变蓝色)11Mg+4NO2
8MgO+Mg3N2+N2(写成4Mg+2NO2
4MgO+N2、3Mg+N2
Mg3N2也给分)取少量氢氧化镁于试管中,加入足量CH3COONH
4溶液,若白色固体溶解,则假设2正确;若白色固体不溶解,则假设1正确
2.乙二酸俗称草酸,其钠盐和钾盐易溶于水,钙盐难溶于水。
草酸晶体(H2C2O4·2H2O)无色、熔点为101℃。
易溶于水,150℃-160℃大量升华,170℃以上分解。
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是__________________________,由此可知草酸晶体分解的产物中有______________,装置B的主要作用是_____________________________________。
(2)乙组同学认为草酸晶体分解的产物中含有H2O和CO,为进行验证,选用下图中的装置进行实验。
实验装置连接的合理顺序为a
→___________________→k(填小写字母),能证明草酸晶体分解产物中有CO的现象是______________________________________________________________,草酸晶体受热分解的化学方程式为_______________________________________________________________。
(3)用酸性KMnO4溶液滴定反应结束后的F溶液,测定Na2C2O4的浓度
实验步骤:
取20.00mLF中的溶液于锥形瓶中,再向锥形瓶中加入足量稀H2SO4,用0.1600mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶被25.00mL。
①高锰酸钾溶液应装在_________(填“酸式”或“碱式”)滴定管中。
②滴定终点的现象是_______________________________________________________。
③计算F溶液中Na2C2O4的物质的量浓度为_________。
【答案】澄清石灰水出现白色浑浊CO2冷凝草酸,防止草酸进入C中与澄清石灰水作用生成沉淀干扰CO2的检验→d→e→f→g→h→i→b→c→m→nD中固体由黑变红,H中出现白色浑浊H2C2O4·2H2O
CO↑+CO2↑+3H2O酸式滴入最后一滴高锰酸钾溶液后,溶液颜色由无色变为红色,且30秒内不褪色0.5000mol/L
3.碳化铝可用作甲烷发生剂,实验室欲利用如图所示装置制取甲烷并还原CuO。
已知:
Al4C3+12H2O=4Al(OH)3+3CH4↑。
回答下列问题:
(1)仪器a的名称是____________。
(2)连接装置并检查气密性后,打开a的活塞和弹簧夹K,一段时间后点燃c和g,d中CuO全部被还原为Cu时,e中固体颜色由白变蓝,f中溶液变浑浊,g处酒精灯火焰呈蓝色。
①e中的试剂是________,其作用是_____________________________。
②实验完毕后,要先熄灭c并继续通入甲烷至d冷却后再熄灭g,原因是_______________。
(3)若最后在g处点燃的气体仅为CH4,则d中发生反应的化学方程式为____________________。
【答案】分液漏斗无水硫酸铜检验产物中是否有水避免炽热铜粉重新被氧化,且尾气可能含有毒的CO,需要用燃烧法除去CH4+4CuO
4Cu+2H2O+CO2
【解析】
(1)仪器a为分液漏斗;
(2)连接装置并检查气密性后,打开a的活塞和弹簧夹K,水滴入烧瓶与Al4C3发生反应,生成CH4,先利用CH4排尽装置中的空气,防止氧气干扰实验。
空气排尽后,再点燃c和g,与CuO发生反应。
e中固体由白变蓝,则e中为无水硫酸铜,检验水的产生;f中溶液变浑浊,则产生了CO2。
实验完毕后,先熄灭c
4.某课外小组利用H2还原WO3(黄色)粉末测定W(银白色)的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
请回答下列问题:
(1)仪器B的名称____________,C中水的作用是_______________________________;
(2)D中盛放的试剂是___________,其作用是___________________________________;
(3)实验过程中有下面几步:
①加热反应管E,②从仪器A逐滴滴加液体,③由仪器G收集气体并检验纯度,④待E试管冷却后,停止从A中滴加液体。
正确的实验操作顺序是_____;
(4)E中反应的化学方程式_____________________________________________________,
E中产生的现象为___________________________________________________________;
(5)本实验样品WO3为纯净物,且完全被还原。
若测得如下数据①空E管的质量a②E管和WO3的总质量b;③反应后E管和W粉的总质量c(冷却到室温称量);④反应前F管及内盛装物的总质量d;⑤反应后F管及内盛装物的总质量e。
由以上数据可以列出计算W的相对原子质量的不同计算式(除W外,其他涉及的元素的相对原子质量均为已知),请写出其中一个。
Ar(W)=___________________________。
【答案】圆底烧瓶除去B中挥发出的HCl气体浓硫酸干燥②③①④WO3+3H2=W+3H2O粉末由黄色逐渐变为银白色,且玻璃管内壁有水珠产生
或
或
-48或
-48
5.芳香族羧酸通常用芳香烃的氧化来制备。
芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。
某同学用甲苯的氧化反应制备苯甲酸。
反应原理:
相关物质的物理常数:
名称
相对分子质量
性状
熔点/℃
沸点/℃
密度/(g·cm-3)
溶解性
水
乙醇
乙醚
甲苯
92
无色液体,易燃,易挥发
-95
110.6
0.8669
不溶
易溶
易溶
苯甲酸
122
白色片状或针状晶体
122.4
248
1.2659
微溶
易溶
易溶
主要实验装置和流程如下:
图1回流搅拌装置图2抽滤装置
实验方法:
一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应
一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
(1)操作I为_________;操作II为_________。
(2)如果水层呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化。
加亚硫酸氢钾的目的是________。
(3)白色固体B的主要成分为_________,其中可能含有的主要杂质是_________。
(4)下列关于仪器的组装或者使用正确的是_________。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置可采用酒精灯直接加热的方法
D.图1冷凝管中水的流向是上进下出
(5)称取1.22g产品,配成100.0mL溶液。
取其中25.00mL溶液于锥形瓶中,滴加酚酞作为指示剂,用浓度为0.1000mol·L-1的KOH标准溶液进行滴定,消耗了20.00mL。
产品中苯甲酸质量分数为_____。
若采用甲基橙作指示剂,会导致测定的结果________(填“偏高”、“偏低”或“无影响”)。
【答案】分液蒸馏除去未反应的高锰酸钾,防止盐酸酸化时被高锰酸钾所氧化,产生氯气苯甲酸KClAB80.0%偏低
6.完成下列填空:
某化学小组拟采用如下装置(夹持和加热仪器等已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性。
完成下列填空:
(1)写出甲装置中反应的化学方程式______________________________。
(2)为完成上述实验,正确的连接顺序为A连______,B连_____(填写接口字母)。
(3)乙装置中a试剂可以是_______________。
(4)测定Cu的相对原子质量。
将wgCuO置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量
方案1
方案2
U型管+固体
硬质玻璃管+固体
反应前的总质量/g
a
c
反应后的总质量/g
b
d
你认为较佳方案是_____________,另一个方案得到的Cu的相对原子质量会_______(选填“偏低”、或“偏高”)
【答案】2NaCl+2H2O
2NaOH+H2↑+Cl2↑EC淀粉KI溶液方案2偏低
7.铝锰合金可作炼钢脱氧剂。
某课外小组欲测定铝锰合金中锰的含量。
I硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的浓度滴定
步骤1:
取20.00mL0.015mol/LK2Cr2O7标准液于250mL锥形瓶中,加入20mL稀硫酸和5mL浓磷酸,用硫酸亚铁铵溶液滴定,接近终点时加2滴R溶液作指示剂,继续滴定至终点,消耗的体积为V1mL。
步骤2:
重复步骤1实验,接近终点时加4滴R溶液,消耗的体积为V2mL.
Ⅱ过硫酸铵[(NH4)2S2O8]催化氧化滴定法测定锰含量
取mg铝锰合金于锥形瓶中,加入适量的浓磷酸,加热至完全溶解,稀释冷却谣匀,再加入少量的硝酸银溶液、过量的过硫酸铵溶液,加热煮沸至无大量气泡冒出,冷却至室温(此时溶液中锰的化合价为+7),用标定的硫酸亚铁铵溶液进行滴定,根据实验数据计算铝锰合金中锰的含量。
[查阅资料]①酸性条件下,Cr2O72-具有很强的氧化性,易被还原为绿色的Cr3+;
②R溶液的变色原理:
(1)Ⅰ中步骤1.2需要的玻璃仪器有锥形瓶、胶头滴管,_______、________。
(2)Ⅰ中滴定过程,主要反应的离子方程式是________。
(3)Ⅰ中步骤2的主要作用是_________
(4)Ⅱ中硫酸亚铁铵溶液的滴定浓度是_________mol/L(用含V1、V2的代数式表示)。
(5)Ⅱ中加入硝酸银溶液的目的是________。
(6)Ⅱ中若未加热煮沸无大量气泡冒出,锰含量测定结果将_______(填“偏大”“偏小”或“无影响”)。
(7)为了提高该实验的准确度和可靠度,需进行________。
【答案】酸式滴定管量筒或移液管14H++C2O72-+6Fe2+=6Fe3++2Cr3++7H2O校正指示剂1.8/(2V1-V2)作为催化剂,加快氧化速率偏大平行实验
8.硫代硫酸钠(Na2S2O3)是常用的定影剂、还原性分析试剂。
Na2S2O3·5H2O是无色晶体,易溶于水,不溶于乙醇,在潮湿的空气中易潮解,Na2S2O3和甲醛能形成难被碘溶液氧化的化合物。
甲、乙两个兴趣小组用下列装置在实验室制备硫代硫酸钠。
回答下列问题:
(1)仪器a的名称是_______;溶液1是______________。
(2)甲小组按上图连接好装置,打开K1,K3关闭K2,打开仪器a的活塞;片刻后,打开集热式磁力搅拌器加热;将气体通入锥形瓶中,溶液出现黄色浑浊后逐渐消失,相关的化学反应方程式为:
①_________________;②Na2SO3+S
Na2S2O3
(3)加热浓缩至出现少量晶膜,停止加热,打开K2,关闭K3,用注射器注入无水乙醇后有大量晶体析出。
加入乙醇的作用是_______________。
(4)乙小组在制备Na2S2O3时进行了改进。
将C装置中的溶液换为Na2CO3和Na2S混合液,其反应为:
Na2CO3+Na2S+4SO2=3Na2S2O3+CO2。
配制该混合溶液的过程中,先将Na2CO3完全溶解,再将Na2S溶解于Na2CO3的溶液中,其目的是__________________。
(5)测定乙小组产品纯度。
取3.000gNa2S2O3·5H2O晶体,配成100mL溶液,取20.00mL于锥形瓶,调节溶液的pH至6,加入适量甲醛溶液和Zn(CH3COO)2溶液,过滤,洗涤,在滤液中滴加几滴淀粉溶液,用0.1000mol/L标准碘溶液滴定,消耗标准碘溶液10.00mL。
①加入适量甲醛溶液和Zn(CH3COO)2溶液的目的是________________;
②该产品中Na2S2O3·5H2O的质量分数为__________________。
(已知:
2Na2S2O3+I2=Na2S4O6+2NaIKsp(ZnS)=1.6×10-24M(Na2S2O3·5H2O)=248g/mol)
【答案】分液漏斗NaOH溶液3SO2+2Na2S=2Na2SO3+3S↓Na2S2O3·5H2O不溶于乙醇,加入乙醇降低其溶解,促进产品析出Na2S容易被氧化,先溶解Na2CO3,使Na2S溶解时间缩短,且抑制了Na2S的水解除去溶液中残留的SO32- 和S2-82.67%
9.蒸
馏碘滴定法可测量中药材中二氧化硫是否超标(亚硫酸盐折算成二氧化硫)。
原理是利用如图装置将亚硫酸盐转化为SO2,然后通过碘标准溶液滴定吸收液。
实验步骤如下:
I.SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300mL;锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液;打开冷凝水,通氮气,滴入盐酸10mL;加热烧瓶A并保持微沸约3min后,用0.01000mol/L碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL;
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL.
(1)仪器C的名称______。
仪器B的入水口为_______(填“a”或“b”)。
(2)滴入盐酸前先通氮气一段时间作用是________,测定过程中氮气的流速过快会导致测量结果______。
(填“偏大”“偏小”“不变”)
(3)①滴定过程中使用的滴定管为_________。
A.酸式无色滴定管B.酸式棕色滴定管C.碱式无色滴定管D.碱式棕色滴定管
②滴定时锥形瓶中反应的离子方程式为________,滴定终点的现象是________。
(4)空白实验的目的是________。
(5)该中药中含SO2含量为________mg/kg。
【答案】分液漏斗b排除装置内空气,避免空气中O2干扰SO2测定偏小BI2+SO2+2H2O=4H++SO42-+2I-当滴入最后一滴碘标准溶夜时,锥形瓶内溶液由无色变为蓝色,且在30s内不变色消除其他试剂、实验操作等因素引起的误差64(V1-V0)
是0.01(V1-V0)/1000mol,质量为0.64(V1-V0)/1000g,这些是10g药粉中的含量,所以1kg药
粉中有64(V1-V0)/1000g二氧化硫,即有64(V1-V0)mg二氧化硫,所以答案为:
64(V1-V0)mg/kg。
10.无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。
实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如图所示。
回答下列问题:
已知:
①SnCl4在空气中极易水解生成SnO2·хH2O
②
物质
颜色、状态
熔点/℃
沸点/℃
SnCl2
无色晶体
246
652
SnCl4
无色液体
-33
114
(1)仪器A的名称是_______,其中发生反应的离子方程式是____________。
(2)点燃酒精灯前需排尽装置中的空气,否则会发生副反应,化学方程式是______、_____。
(3)试剂B、C依次为_______,试剂B的作用是______。
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为防止产品中带入SnCl2,可采取的措施是_______、_______。
(5)碘氧化法滴定分析产品中2价Sn(II)的含量。
准确称取mg产品于锥形瓶中,用蒸馏水溶解,淀粉-KI溶液做指示剂,用cmol·L-1碘标准溶液滴定至终点,消耗碘标准溶液VmL,计算产品中Sn(II)的含量_______(用含c、m、V的代数式表示)。
【答案】蒸馏烧瓶2MnO4-+16H++10C1-=2Mn2++5C12↑+8H2OSnCl4+(x+2)H2O=SnO2·xH2O↓+4HCl↑Sn+O2
SnO2浓硫酸氢氧化钠溶液防止C溶液的水进入收集器控制Sn与氯气的反应温度在232℃至650℃之间过量氯气(11.9cV/m)%
【解析】
(1)仪器A的名称是蒸馏烧瓶,其中浓盐酸和高锰酸钾反应生成氯化锰、氯气和水,发生反应的离子方程式是:
2MnO4-+16H++10C1-=2Mn2++5C12↑+8H2O;
(2)点燃酒精灯前需排尽装置中的空气,否则
11.硫酸亚铁铵(NH4)aFeb(SO4)c·dH2O又称莫尔盐,是浅绿色晶体,用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:
已知:
“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
(1)写出“还原”时Fe3+与FeS2发生还原反应Ⅱ的离子方程式:
__________________________。
实验室检验“还原”已完全的方法是:
__________________________。
(2
)称取11.76g新制莫尔盐,溶于水配成250mL溶液。
取25.00mL该溶液加入足量的BaCl2溶液,得到白色沉淀1.398g;另取25.00mL该溶液用0.0200mol/LKMnO4酸性溶液滴定,当MnO4-恰好完全被还原为Mn2+时,消耗溶液的体积为30.00mL。
试确定莫尔盐的化学式(请写出计算过程)_________。
【答案】FeS2+2Fe3+=3Fe2++2S↓取少量酸浸后的溶液,向其中滴加数滴KSCN溶液,如果溶液变红则“还原”未完全,反之,已完全。
原样品中的n(SO42-)=10×1.398g÷233g/mol=0.06mol
n(MnO4-)=0.0200mol/L×0.03L=0.0006mol
由得失电子守恒可知:
n(Fe2+)=5n(MnO4-)=0.003mol原样品中n(Fe2+)=0.03mol
由电荷守恒可知:
原样品中n(NH4+)=0.06mol
由质量守恒:
n(H2O)=0.18mol
故化学式为:
(NH4)2Fe(SO4)2•6H2O或(NH4)2SO4•FeSO4•6H2O
【解析】硫铁矿(主要含FeS2、SiO2等)在空气中焙烧,得二氧化硫气体和氧化铁、二氧化硅等固体,加硫酸
12.某实验室采用新型合成技术,以Cu(CH3COO)·2H2O和K2C2O4·H2O为原料在玛瑙研钵中研磨反应,经过后处理得到蓝色晶体。
已知该蓝色晶体的化学式为Ka[Cub(C2O4)c]·nH2O,在合成过程中各种元素的化合价均不发生变化。
为了测定其组成进行以下两组实验,请回答相关问题:
Ⅰ.草酸根与铜含量的测定
①将蓝色晶体于研钵中研碎,取该固体粉末,加入1mol/L的H2SO4溶解,配制成250mL溶液。
②配制100mL0.1000mol/LKMnO4溶液备用。
③取所配溶液25.00mL于锥形瓶中,采用0.1000mol/LKMnO4溶液滴定至草酸根恰好全部氧化成二氧化碳,共消耗KMnO4溶液20.00mL。
④另取所配溶液25.00mL于锥形瓶中,加入过量KI溶液,充分反应后用0.2000mol/LNa2S2O3溶液滴定,消耗12.50mL.(发生反应:
2Cu2++4I-=2CuI↓+I2,2Na2S2O3+I2=Na2S4O6+2NaI)
(1)后处理提纯该蓝色晶体时,除掉的杂质的主要成分(除原料外)是_______(填化学式)
(2)配制0.1000mol/LKMnO4溶液,需要的玻璃仪器有________、_______,胶头滴管,玻璃棒,烧杯。
(3)用Na2S2O3滴定时,应选用_______滴定管(填“酸式”或“碱式”)
(4)KMnO4溶液滴定草酸根过程中发生反应的离子方程式为_______,滴定终点的现象为_____。
Ⅱ.热重分析法测定结晶的含量
氮气气氛中以升温速率10℃/min测定该化合物的热失重曲线,如图所示晶体在107℃失重10.2%,失去全部结晶水。
(5)通过热失重分析,蓝色晶体的化学式中n=________,经过实验测定后,蓝色晶体的化学
式为________.
(6)加热400℃之后,剩余物质的质量不再发生变化。
为探究剩余固体的成分,冷却后取少量固体于试管中,加水溶解有红色不溶物,过滤后向滤液中加入稀盐酸产生无色
无味气体。
则剩余固体的成分为________。
【答案】CH3COOK量筒100mL容量瓶碱式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O当滴入最后一滴试剂时,锥形瓶中溶液由无色变成粉红色,且30s不褪色2