工业流程图题精选.docx
《工业流程图题精选.docx》由会员分享,可在线阅读,更多相关《工业流程图题精选.docx(23页珍藏版)》请在冰豆网上搜索。
工业流程图题精选
工业流程题
18.我省物产资源丰富。
东海有蛭石,蛭石为一种层状结构的含镁的铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,因为其受热膨胀时呈挠曲状,形态酷似水蛭,故此得名蛭石。
膨化后的蛭石呈颗粒状,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸。
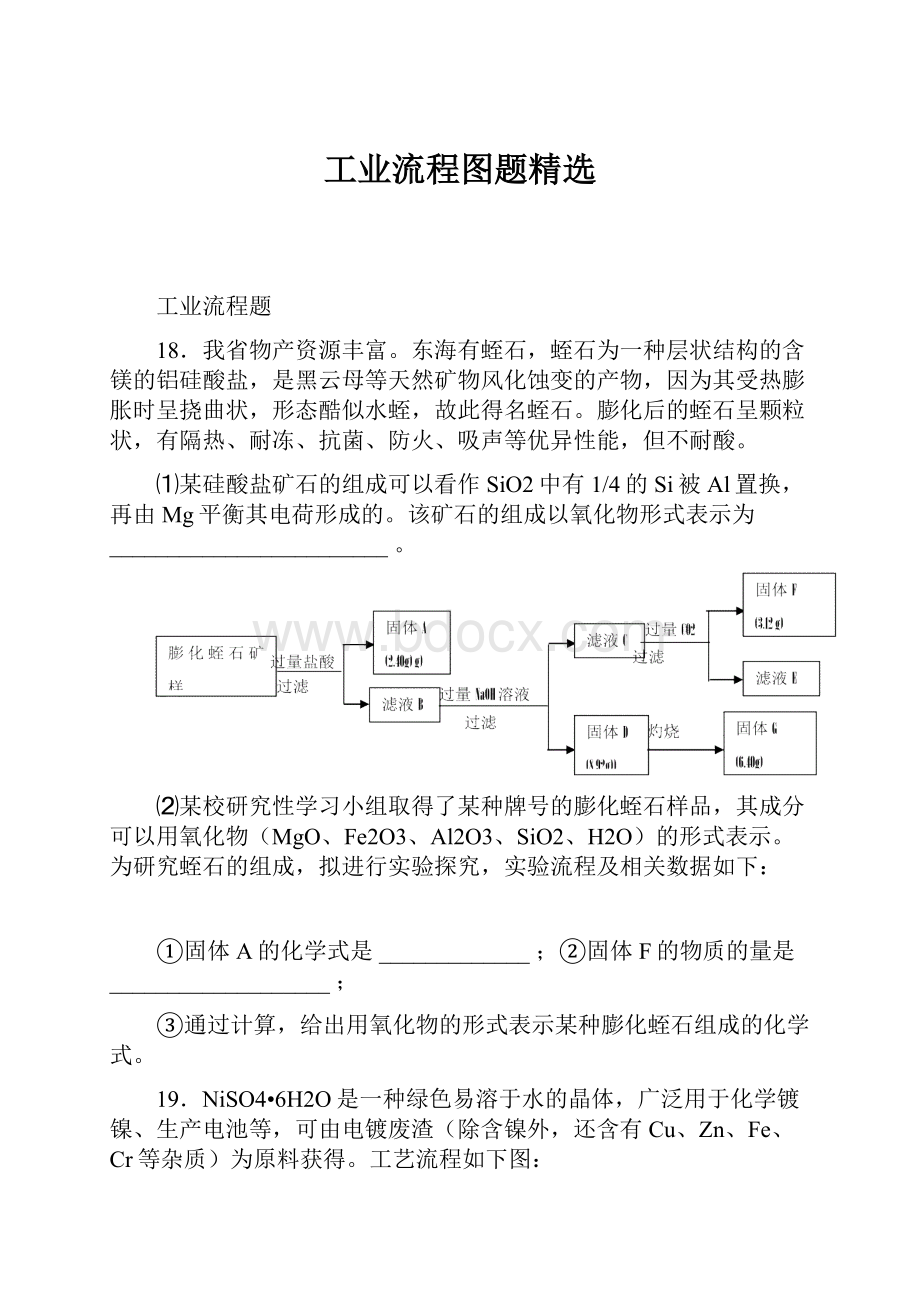
⑴某硅酸盐矿石的组成可以看作SiO2中有1/4的Si被Al置换,再由Mg平衡其电荷形成的。
该矿石的组成以氧化物形式表示为________________________。
⑵某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。
为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
①固体A的化学式是_____________;②固体F的物质的量是___________________;
③通过计算,给出用氧化物的形式表示某种膨化蛭石组成的化学式。
19.NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。
工艺流程如下图:
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_________________。
(任写一点)
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:
__________。
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃时加入NaOH调节pH,除去铁和铬。
此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。
下图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10−39)。
下列说法正确的是______(选填序号)。
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10−29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:
6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8
减少过氧化氢的分解
6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
(4)上述流程中滤液Ⅲ的主要成分是_________________。
(5)确定步骤④中Na2CO3溶液足量,碳酸镍已完全
沉淀的简单实验方法是____________________________________。
Na2SO4、NiSO4
(6)操作Ⅰ的实验步骤依次为:
【实验中可选用的试剂:
6mol•L-1的H2SO4溶液,蒸馏水、pH试纸】。
__________________________________;
__________________________________;
蒸发浓缩、冷却结晶,过滤得NiSO4•6H2O晶体;
用少量乙醇洗涤NiSO4•6H2O晶体并晾干。
20.钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。
利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下:
已知:
FeTiO3与盐酸反应的离子方程式为:
FeTiO3+4H++4Cl−=Fe2++TiOCl42−+2H2O
(1)滤渣A的成分是▲。
(2)滤液B中TiOCl42−转化生成TiO2的离子方程式是▲。
(3)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,
Ti元素的浸出率与反应温度的关系如图9所示。
反应温度过高时,Ti元素浸出率下降的原因
是▲。
(4)反应③的化学方程式是▲。
(5)由滤液D制备LiFePO4的过程中,所需
17%双氧水与H2C2O4的质量比是▲。
(6)LiFePO4电池中常加入少量活性炭黑,其作用可能是▲。
21.工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下:
下列说法正确的是
A.酸溶时,MnO2作还原剂B.可用盐酸代替硫酸进行酸溶
C.原料硫酸可以循环使用D.在电解池的阴极处产生MnO2
22.(12分)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。
合成路线如下:
(1)写出反应Ⅰ的化学方程式。
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是
。
(3)下列有关说法正确的是。
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4︰1
c.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
d.反应V中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是。
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式。
23.(15分))氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量
Mg(ClO3)2·6H2O的流程如下:
已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如右图所示。
(1)过滤所需要的主要玻璃仪器有,
加MgO后过滤所得滤渣的主要成分为。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全?
答:
。
(3)加入NaClO3饱和溶液发生反应为:
MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓
再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
①;
②;③;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:
准确称量3.50g产品配成100mL溶液。
步骤2:
取10mL于锥形瓶中,加入10mL稀硫酸和20mL1.000mol·L-1的
FeSO4溶液,微热。
步骤3:
冷却至室温,用0.100mol·L-1K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:
将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
①写出步骤2中发生反应的离子方程式:
。
②产品中Mg(ClO3)2·6H2O的质量分数为。
24.(14分)Ni2O3是一种灰黑色粉末,约在600℃分解成NiO,工业上利用含镍废料(镍、铁、钙、镁合金为主)制取Ni2O3的工艺流程如下:
已知:
①草酸的钙、镁、镍盐均难溶于水。
②有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
Ni(OH)2
Fe(OH)3
Fe(OH)2
Mg(OH)2
开始沉淀的pH
7.1
1.5
6.5
9.7
沉淀完全的pH
9.1
3.7
9.7
12.4
请问答下列问题:
(1)加入H2O2的目的是将溶液中Fe2+氧化,写出该反应的离子方程式▲。
(2)步骤A应调节溶液pH的范围是▲。
步骤B中加入NH4F的目的是▲。
(3)如果在酸溶过程中HNO3完全反应,则从溶液A中可以回收的物质是▲。
(4)干燥脱水后得到NiC2O4,将其煅烧3h,制得Ni2O3,同时生成CO和CO2。
写出NiC2O4受热分解的化学方程式▲。
煅烧时温度不宜过高的原因是▲。
(5)向NiCl2溶液中加入NaOH、NaClO溶液也可以析出Ni2O3沉淀,该反应的离子方程式为▲。
25.(15分)信息时代产生的大量电子垃圾对环境构成了威胁。
某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
(1)第①步Cu与酸反应的离子方程式为____。
(2)第②步加H2O2的作用是____。
(3)该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:
取ag试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。
用0.1000mol·L-1Na2S2O3标准溶液滴定(原理为I2+2S2O
===2I-+S4O
),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
①滴定过程中可选用________作指示剂,滴定终点的现象是____________。
②CuSO4溶液与KI反应的离子方程式为____。
方案二:
取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用cmol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6mL。
滴定反应如下:
Cu2++H2Y2-===CuY2-+2H+。
③写出计算CuSO4·5H2O质量分数的表达式w=________。
④下列操作会导致CuSO4·5H2O含量的测定结果偏高的是________(填字母)。
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
26.(11分)有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。
一种由废催化剂制取PdCl2的工艺流程如下:
(1)“焙烧1”通入空气的目的是________________。
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式:
____。
(3)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室中检测溶液pH的简单方法是________________。
(4)写出“焙烧2”发生反应的化学方程式:
____。
(5)Pd中加入王水的反应可以表示为Pd+HCl+HNO3―→A+B↑+H2O(未配平)。
其中B为无色有毒气体,该气体在空气中不能稳定存在;A中含有三种元素,其中Pd元素的质量分数为42.4%,H元素的质量分数为0.8%。
则A的化学式为____。
27.(13分)NaClO2用于棉、麻、粘胶纤维及织物的漂白。
实验室制备NaClO2的装置如下图所示:
(1)装置I控制温度在35~55℃,通入SO2将NaClO3还原为ClO2(沸点:
11℃),反应结束后通入适量的空气,其目的是▲。
(2)装置Ⅱ中反应生成NaClO2的化学方程式为▲。
反应后的溶液中阴离子除了ClO2-,还有少量ClO3-、Cl-、ClO-、OH-,另外还可能含有的一种阴离子是▲,用离子方程式表示该离子产生的原因▲。
(3)已知在NaClO2饱和溶液中温度低于38℃时析出晶体是NaClO2·3H2O,温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
请补充从装置Ⅱ反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②▲;③▲;④▲;得到成品。
(4)装置Ⅲ中试剂X为▲。
28.(12分)NaNO3是重要的化工原料,可通过下列方法制备:
第一步:
在吸收塔中,将硝酸生产中排出的尾气(体积分数:
含0.5%NO、1.5%NO2)
用纯碱溶液完全吸收。
第二步:
将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到NaNO3和硝酸的混合液。
第三步:
将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:
每生产1.7t纯净的NaNO3固体,需消耗1.3t无水Na2CO3、消耗氧气的体积为67.2m3(标准状况下)和一定量的HNO3。
生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1)第一步生产过程中发生反应的总化学方程式是。
(2)检验NaNO3成品中是否含少量的Na2CO3杂质的方法是。
(3)生产过程中Na2CO3的利用率是________(计算结果精确到小数点后两位)。
(4)生产1.7t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积为________m3(标准状况下)。
(写出计算过程)
29.(13分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下:
(1)写出“碱浸”反应的离子方程式:
▲
(2)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。
当BaMoO4开始沉淀时,SO42-的去除率是▲。
[已知:
碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,
Ksp(BaSO4)=1.1×10-10、Ksp(BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。
]
(3)重结晶得到的母液可以在下
次重结晶时重复使用,但达到一
定次数后必须净化处理,原因是▲。
(4)右图是碳钢在3种不同介质
中的腐蚀速率实验结果:
一.碳钢在盐酸和硫酸中腐蚀速
率随酸的浓度变化有明显差异,
其原因可能是▲。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。
NaNO2的作用是▲。
③若缓释剂钼酸钠—月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为▲。
30.硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。
下列说法错误的是
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
31.(12分)实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。
其工艺流程为:
图Ⅰ图Ⅱ
⑴根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为▲。
图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是▲。
⑵工艺流程中“副产品”的化学式为▲。
⑶已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
Fe(OH)3
Fe(OH)2
Ni(OH)2
开始沉淀的pH
1.5
6.5
7.7
沉淀完全的pH
3.7
9.7
9.2
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:
向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。
请对该实验方案进行评价:
▲(若原方案正确,请说明理由;若原方案错误,请加以改正)。
⑷操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则Ca2+的浓度为▲mol·L-1。
(常温时CaF2的溶度积常数为2.7×10-11)
⑸电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。
第②步反应的离子方程式为▲。
32.(13分)工业生产无铁硫酸铝,以硫酸浸取铝土矿得含铁(Fe2+和Fe3+)的硫酸铝溶液,加热到一定温度,搅拌,加入一定量高锰酸钾溶液和硫酸锰溶液,在溶液中生成活性二氧化锰,调节溶液的pH,反应一段时间,Fe(OH)3和二氧化锰发生吸附共沉作用,最终得到无铁硫酸铝产品。
(1)KMnO4首先将Fe2+氧化为Fe3+,其本身被还原为MnO2,反应的离子方程式为。
(2)写出高锰酸钾溶液和硫酸锰溶液反应的化学方程式。
实验证明,n(MnO2)/n(Fe)控制在4∶1时,除铁效果较好。
若溶液中亚铁离子和铁离子浓度均为0.03mol/L,为达到较好的除铁效果,每1L溶液应加入高锰酸钾的物质的量为。
(3)调节pH的作用是。
(4)操作1的名称为,操作2的名称为。
(5)下列有关工艺的说法正确的是。
(填字母序号)
A.溶液的pH越大,则除铁效果越好,但同时会影响硫酸铝的产率
B.活性二氧化锰生成量应适宜,不足时铁的去除率较低,过量时会增加成本
C.可以直接向溶液中加入二氧化锰粉末以除去Fe(OH)3
33.(10分)某铜矿石含氧化铜、氧化亚铜、三氧化二铁和大量脉石(SiO2),现采用酸浸法从矿石中提取铜,其流程图如下:
已知:
①当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;②反萃取后的水层是硫酸铜溶液,Cu2+浓度约为50g/L。
回答下列问题:
(1)矿石用稀硫酸浸出过程中氧化亚铜发生的反应为:
Cu2O+2H+===Cu2++Cu+H2O;请写出该过程中发生的另一个氧化还原反应的离子方程式:
。
(2)写出用惰性电极电解水层的电解总反应方程式:
。
(3)循环中反萃取剂B的主要成分是。
(4)某铜矿石样品中,若仅含氧化亚铜、三氧化二铁和脉石三种物质。
取该矿石样品200.0g,用100mL1.0mol•L—1H2SO4溶液浸取后,还需加入10mL1.0mol•L—1Fe2(SO4)3溶液才能使铜全部浸出,浸取液经充分电解后可得到6.4gCu。
求铜矿石样品中氧化亚铜和氧化铁的质量分数?
(写出计算过程)
34.汞(熔点-39℃,沸点356℃)是制造电池、电极等的重要原料,历史上曾用“灼烧辰砂法”制取汞。
目前工业上制粗汞的一种流程图如下。
下列分析错误的是
A.“灼烧辰砂法”过程中电子转移的方向和数目可表示为:
B.辰砂与氧化钙加热反应时,CaSO4为氧化产物
C.洗涤粗汞可用5%的盐酸代替5%的硝酸
D.减压蒸馏的目的是降低汞的沸点,提高分离效率
35.(12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
Fe(OH)3
Fe(OH)2
Al(OH)3
开始沉淀
2.3
7.5
3.4
完全沉淀
3.2
9.7
4.4
回答下列问题:
⑴加入少量NaHCO3的目的是调节pH,使溶液中的▲沉淀,该工艺中“搅拌”的作用是▲。
⑵在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作▲。
若参与反应的O2有
11.2L(标准状况),则相当于节约NaNO2的物质的量为▲。
⑶碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。
该水解反
应的离子方程式为▲。
⑷在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。
根据我国质量标准,产品中不得含有Fe2+及NO3-。
为检验所得产品中是否含有Fe2+,应使用的试剂为▲
(填字母序号)。
A.氯水B.KSCN溶液C.NaOH溶液D.酸性KMnO4溶液
36.(14分)硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。
生产硫化钠大多采用无水芒硝(Na2SO4)-炭粉还原法,其流程示意图如下:
⑴上述流程中“碱浸”后,物质A必须经过▲(填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为▲。
⑵上述流程中采用稀碱液比用热水更好,理由是▲。
⑶取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。
若反应后测得溶液的pH=4,则此时溶液中c(S2-)=▲。
(已知:
常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
⑷①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如右图所示)。
为使除汞效果最佳,应控制的条件是▲、▲。
②某毛纺厂废水中含0.001mol·L-1的硫化钠,与纸张漂白后的废水(含0.002mol·L-1NaClO)按1:
2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有▲。
37.(12分)轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为MgCl2,含Fe2+、Fe3+、Mn2+等杂质离子)为原料制备轻质碳酸镁的工艺流程如下:
(1)“氧化”一步中发生反应的离子方程式为____▲____。
(2)“调节pH”一步应调节溶液的pH=9.8,其目的是____▲____。
(3)“热解”一步温度控制在75℃左右,其原因是____▲____。
(4)从“过滤2”步骤中得到的滤液中能回收的盐类物质主要有____▲____(填化学式)。
表1 生成氢氧化物沉淀的pH
物质
开始沉淀
沉淀完全
Fe(OH)3
2.7
3.7
Fe(OH)2
7.6
9.6
Mn(OH)2
8.3
9.8
Mg(OH)2
9.9
11.1
注:
Fe(OH)2沉淀呈絮状,不易从溶液中除去。
(5)轻质碳酸镁的成分为碱式碳酸镁[MgCO3·Mg(OH)2·3H2O],则“热解”一步发生反应的离子方程式为____▲____。
38.(12分)K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。
以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
(1)几种盐的溶解度见图7。
反应III中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、▲、洗涤、干燥等操作即得K2SO4产品。
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是:
▲。
(3)反应IV的化学方程式为▲。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为▲。
(5)图8是煅烧MnSO4•H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为▲。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。
试分析产物总锰含量减小的原因:
▲。
39.(15分)利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
(1)“酸浸”中硫酸要适当过量,目的是①提高铁的浸出率,②▲。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为
▲。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:
准确量