18专题92 溶液的浓度及溶液的配制Word格式.docx
《18专题92 溶液的浓度及溶液的配制Word格式.docx》由会员分享,可在线阅读,更多相关《18专题92 溶液的浓度及溶液的配制Word格式.docx(16页珍藏版)》请在冰豆网上搜索。
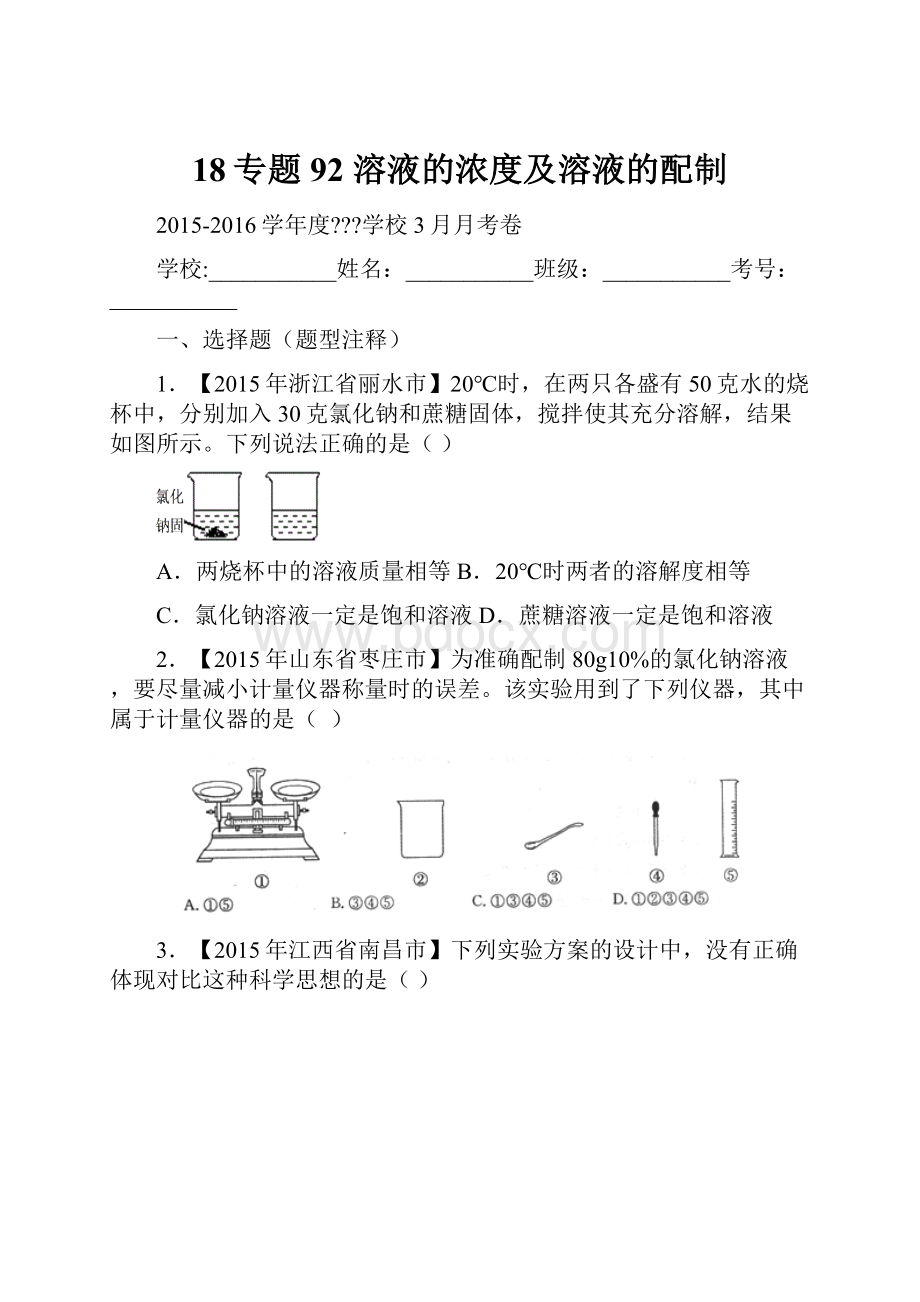
(1)t1℃时,A物质的溶解度是克。
(2)当A物质中混有少量B物质时,通常可采用的方法提纯A物质。
(3)将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃后(升温过程中溶剂的量不变),三种溶液中溶质的质量分数由大到小的顺序是(填字母)。
7.【2015年陕西省】下图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答。
(1)蒸发前原溶液是(填“饱和”或“不饱和”)溶液。
n的数值是。
(2)依据上述实验,你认为甲的溶解度随温度变化的趋势是(填字母)的。
A.随温度升高而增大B.随温度升高而减小C.无法判断
8.【2015年内蒙古自治区赤峰市】赤峰市2014年中考化学实验考察有:
Ⅰ配制60g5%的氯化钠溶液Ⅱ二氧化碳的实验室制取Ⅲ中和反应Ⅳ过滤10mL粗食盐水等六个考签,由学生抽签确定一个考题进行考察。
(1)甲同学抽签后到实验室,发现本组实验桌上准备了下列仪器和药品:
①上述仪器中D的名称为,F的名称为
②甲同学抽到的考签应该是(填字母编号)
③制取一瓶该气体,应选用的仪器有(填字母编号)
④利用上述气体发生装置在实验室还可以制取的其他常见气体,请你写出制取该气体的化学方程式,该反应类型为
(2)乙同学抽到的考签是Ⅰ,他的实验操作如下图所示,请回答:
①图示操作中,有一项是错误的,这一错误操作是(填写字母编号)
②上述操作正确的顺序是(填写字母编号)
③按照正确的操作将配制好的溶液装入试剂瓶时,不慎洒出了几滴,这会使溶液中溶质的质量分数(填“偏大”“偏小”或“不变”)
(3)丙同学抽到的考签是Ⅳ,他在进行实验时,发觉得到的滤液浑浊,于是他将得到的滤液进行了第二次过滤,结果发现滤液仍然浑浊,请你帮助丙同学分析一下产生该现象的原因:
(写出一点即可)
9.【2015年辽宁省丹东市】A、B、C三种固体物质在水中的溶解度曲线如右图所示,请回答:
(1)℃时,A、B两种物质在100g水中达到饱和状态时溶解的质量相等;
(2)若B中混有少量的A,最好采用的方法提纯B;
(3)现有接近饱和的C物质溶液,使其变成饱和溶液的方法有:
①加入C物质;
②恒温蒸发溶剂;
③;
(4)t3℃时将20gA物质放入50g水中,充分搅拌,所得溶液中溶质的质量分数是;
(5)将t3℃时等质量的A、B、C三种物质的饱和溶液降温至t1℃时,所得溶液的质量由大到小的顺序是。
10.【2015年辽宁省丹东市】用下列实验操作可分别完成“粗盐中难溶性杂质的去除”和“一定溶质质量分数的氯化钠溶液的配制”两个实验。
(1)操作E中得到的滤液仍浑浊,其原因可能是(答出一点即可);
(2)若图B所用的烧杯内壁沾有水,导致配制溶液中溶质的质量分数会(填“偏大”、“偏小”或“不变”);
(3)图D中玻璃棒的作用是;
(4)图C中有一处明显的错误,请你改正:
。
11.【2015年湖南省张家界市】右图为甲、乙两种物质的溶解度曲线,请回答下列问题:
(1)20℃时,为使接近饱和的甲物质溶液变为饱和溶液的方法是:
(任写一种方法即可);
(2)40℃时,乙物质的溶解度是____g。
此温度下,该饱和溶液中乙物质的质量分数是。
(精确到0.1%)
12.【2015年北京市】3%的硼酸溶液可用于清洗皮肤的小面积创伤。
现配制300g质量分数为3%的硼酸溶液,实验操作如下:
(1)称量硼酸固体的质量:
在下图中分别标出所选砝码的质量和游码的示数。
(2)量取水的体积:
用量筒取mL水(
)。
(3)溶解:
用到的玻璃仪器是。
(4)装瓶、贴标签:
在右图的标签中填上相应的内容。
13.【2015年福建省泉州市】农业生产上通常用溶质质量分数为10%~20%的食盐溶液来选种。
(1)现要配制120kg溶质质量分数为20%的食盐溶液,需要取用固体食盐kg;
(2)用60kg溶质质量分数为20%的食盐溶液,可稀释成12%的食盐溶液kg。
四、简答题(题型注释)
五、探究题(题型注释)
六、信息分析题(题型注释)
七、推断题(题型注释)
八、计算题(题型注释)
14.【2015年新疆自治区、兵团】某化学研究小组为了测定一工厂废水中硫酸的溶质质量分数,取100克废水置于烧杯中,加入100克一定质量分数的硝酸钡溶液恰好完全反应(废水中其它成分不与硝酸钡反应)。
反应后过滤,将得到的沉淀洗涤、干燥、称重,称得质量为2.33克。
(化学反应方程式为:
Ba(NO3)2+H2SO4==BaSO4↓+2HNO3)请计算:
(1)完全反应后烧杯内剩余的溶液质量为克。
(2)100克废水中硫酸的溶质质量分数是多少?
15.【2015年陕西省】某化学兴趣小组同学为回收一块质量为40g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去稀硫酸100g,烧杯内剩余固体质量为27g。
请完成下列分析及计算:
(1)40g铜锌合金中锌的质量是g。
(2)计算所用稀硫酸中溶质的质量分数。
16.【2015年辽宁省丹东市】取锌、铜的混合物8g与154.7g稀硫酸恰好完全反应,称得剩余物质的总质量为162.5g。
请计算:
(1)产生氢气的质量是多少?
(2)反应后所得溶液中溶质的质量分数是多少?
17.【2015年黑龙江省哈尔滨市】为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:
(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是____________;
(2)发生反应的化学方程式为_____________________;
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(x)的比例式为__________;
(4)该黄铜样品中铜的质量分数是__________;
(5)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是__________;
(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干,然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是__________,再经过某些反应及操作就得到了所需铜盐。
18.【2015年贵州省黔东南州】某化学兴趣小组对某铜锌合金样品进行探究实验。
称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示。
求:
(1)铜锌合金汇中,Zn的质量分数是。
(2)所用稀硫酸溶液中溶质的质量分数是多少?
评卷人
得分
九、综合题
十、新添加的题型
参考答案
1.C
【解析】
试题分析:
A选项是错误的叙述,因为氯化钠没有溶解完;
B选项是错误的的叙述,在该温度下,蔗糖的溶解度大于氯化钠的溶解度;
C选项是正确的叙述;
因为在该温度下,有溶解不完的氯化钠;
D选项是错误的叙述,蔗糖溶液可能是饱和溶液;
故答案选择C
考点:
溶液的判定、溶液的组成
2.A
配制溶液的一般步骤是:
计算、称量、溶解。
其中称量时需要的是托盘天平和量筒。
故选A。
溶液的配制
3.D
对比法指的是保持其他条件不变,只改变其中一个条件,探讨该条件对实验的影响。
A中相对比的两个集气瓶内只有氧气的含量不同,B中两个试管中只有二氧化锰的情况不同,C中两个试管中只有钙镁离子含量不同,故上述三个实验都达到对比试验的目的;
D中两个烧杯中溶质和溶剂的量都不同,不能进行对比试验。
对比试验的设计
4.A
根据溶质质量分数计算的表达式,所配溶液的浓度偏低:
要不就是溶质质量偏小,要不就是溶剂质量偏大,A、称取5g含杂质的蔗糖,使得溶质蔗糖质量偏小,所配溶液的浓度偏低,正确,B、用量筒量取90mL水,溶剂质量偏小,所配溶液的浓度偏高,错误,C、搅拌后玻璃棒上有液体残留,溶剂质量偏小,所配溶液的浓度偏高,错误,D、量筒中的水未完全倒入烧杯中,溶剂质量偏小,所配溶液的浓度偏高,错误,故选A
溶质质量分数计算
5.D
保持温度不变,物质的溶解度不会变化,所以加入10g硝酸钾后,不会溶解,溶液中溶质的质量分数不变;
保持温度不变,蒸发10g水后,水中的溶质会结晶析出,溶液中溶质的质量分数仍然不变,降温至10℃时,硝酸钾的溶解度减小,因为硝酸钾的溶解度随温度的降低而降低。
故选D.
溶解度、溶质的质量分数
6.
(1)25
(2)降温结晶(3)BCA
根据溶解度曲线的含义可知,
(1)t1℃时,A物质的溶解度是25g;
(2)当A物质中混有少量B物质时,通常可采用降温结晶的方法提纯A物质,是因为A物质的溶解度受温度的影响较大;
(3)三种溶液的的溶质的质量分数的大小既要看其实溶解度的大小,又要看物质的溶解度与温度升高的变化趋势,根据二者的综合可知,将t1℃时A、B、C三种物质饱和溶液的温度升高到t2℃后(升温过程中溶剂的量不变),三种溶液中溶质的质量分数由大到小的顺序是BCA。
溶解度曲线的应用
7.
(1)不饱和、11、
(2)C
因为第一次蒸发掉10g水,析出1g的溶质,这是属于饱和溶液;
再蒸发掉10g水,析出5g的溶质;
因为溶剂一定,饱和时析出的溶质一样多,原溶液为和溶液,故
(1)蒸发前原溶液是不饱和溶液,n的数值是11g;
(2)依据上述实验,甲的溶解度随温度变化的趋势是无法判断,因为是恒温下蒸发结晶。
溶液
8.
(1)①烧杯,酒精灯;
②Ⅱ;
③ABCE;
④2H2O2
2H2O+O2↑,分解反应;
(2)①C;
②ECADB;
③不变(3)滤液高于滤纸边缘
(1)①D的名称为烧杯,F的名称为酒精灯;
②有药品碳酸钙和盐酸可知,甲同学抽到的考签应该是实验室制取二氧化碳;
③制取一瓶该气体,应选用的仪器有ABCE;
④利用上述气体发生装置在实验室还可以制取氧气,制取该气体的化学方程式2H2O2
2H2O+O2↑,反应类型为分解反应;
(2)①图示操作中,有一项是错误的,这一错误操作是C称量氯化钠;
②上述操作正确的顺序是ECADB;
③因为溶液具有均一、稳定性,按照正确的操作将配制好的溶液装入试剂瓶时,不慎洒出了几滴,这会使溶液中溶质的质量分数不变;
(3)丙同学抽到的考签是Ⅳ,他在进行实验时,发觉得到的滤液浑浊,于是他将得到的滤液进行了第二次过滤,结果发现滤液仍然浑浊的原因为:
滤液高于滤纸边缘。
溶液的配制、实验室制取气体的思路和方法
9.
(1)t2
(2)蒸发结晶(或蒸发溶剂)(3)升高温度(4)20﹪(5)C>B>A
从图示看:
t2℃时,A、B两种物质在100g水中达到饱和状态时溶解的质量相等;
若B中混有少量的A,最好采用蒸发结晶(或蒸发溶剂),因为B的溶解度随温度的变化较小;
现有接近饱和的C物质溶液,使其变成饱和溶液的方法有:
③升高温度因为C的溶解度随温度的升高而较小,t3℃时将20gA物质放入50g水中,充分搅拌,所得溶液中溶质的质量分数是12.5克/62.5克=20%,将t3℃时等质量的A、B、C三种物质的饱和溶液降温至t1℃时,所得溶液的质量由大到小的顺序是C>B>A,因为C没有结晶析出,而B析出的比A小。
溶解度和溶解度曲线、溶质的质量分数
10.
(1)滤纸破损
(2)偏小(3)搅拌,防止局部温度过高,造成液滴飞溅
(4)视线与凹液面最低处保持水平
操作E中得到的滤液仍浑浊,其原因可能是滤纸破损或液面高于滤纸边缘或仪器不干净;
若图B所用的烧杯内壁沾有水,导致配制溶液中溶质的质量分数会偏小,图D中玻璃棒的作用是搅拌,防止局部温度过高,造成液滴飞溅,图C中有一处明显的错误视线没有与凹液面最低处保持水平,因为俯视时读数大于实际,影响实验的结果。
11.
(1)降温
(2)40克;
28.6%
20℃时,为使接近饱和的甲物质溶液变为饱和溶液的方法是降温或者是增加溶质等,40℃时,乙物质的溶解度是40克,该饱和溶液中乙物质的质量分数是=40/140×
100%=28.6%。
溶解度溶质的质量分数
12.
(1)5g、4g
(2)291(3)烧杯、玻璃棒(4)硼酸、3%
(1)根据溶质质量分数表达式的变形,配制300g质量分数为3%的硼酸溶液需要溶质硼酸的质量=300g×
3%=9g,故所选砝码的质量和游码的示数分别是5g、4g
(2)根据
(1)的计算,所需水的质量=300g-9g=291g,结合水的密度,故量取水的体积:
用量筒取291mL水;
用到的玻璃仪器是烧杯、玻璃棒(4)装瓶、贴标签,应注明溶液的名称以及溶质质量分数,故标签中填的相应内容:
硼酸、3%
溶质质量分数表达式,配制的过程
13.
(1)24
(2)100
需要取用固体食盐=120kg×
20%=24kg;
用60kg溶质质量分数为20%的食盐溶液,可稀释成12%的食盐溶液=60kg×
20%/12%=100kg.
溶液的计算
14.
(1)197.67g;
(2)
解:
(1)根据质量守恒定律可知,完全反应后烧杯内剩余的溶液质量为:
100g+100g-2.33g=197.67g
(2)设完全反应后烧杯内剩余的溶液质量为X
Ba(NO3)2+H2SO4==BaSO4↓+2HNO3
98233
100g×
X2.33g
98/(100g×
X)=233/2.33g
X=0.98%
答:
100克废水中硫酸的溶质质量分数是0.98%
有关溶液的计算、有关溶质质量分数的计算
15.
(1)13g;
(2)19.6%
(1)因为铜锌合金中金属锌与硫酸反应,剩余的固体为,不反应的金属铜,故40g铜锌合金中锌的质量是:
40g-27g=13g;
(2)设100g硫酸溶液中H2SO4的质量为X
Zn+H2SO4===ZnSO4+H2↑
6598
13gX
65/98=13g/x
X=19.6g
所用稀硫酸中溶质的质量分数为:
19.6g/100g×
100%=19.6%。
40g铜锌合金中锌的质量是13g,所用稀硫酸中溶质的质量分数19.6%。
根据化学方程式的计算
16.
(1)0.2克
(2)10%
根据质量守恒定律可以知道:
H2的质量是154.7g+8g-162.5=0.2g,
(2)所得溶液的质量为:
6.5g+154.7g-0.2g=161g或162.5g-(8g-6.5g)=161g
所得溶液中溶质的质量分数为16.1克/161克×
100%=10%
考点:
根据化学方程式的计算、质量守恒定律、溶质的质量分数
17.
(1)40g
(2)Zn+2HCl=ZnC12+H2↑
(4)80%(5)13.6%(6)107g(l分)
(1)根据溶液稀释前后溶质的质量不变,设需要质量分数为36.5%的浓盐酸的质量是X;
14.6%=X×
36.5%;
得x=40g;
(2)在黄铜中金属锌与酸反应产生氢气;
故
(2)发生反应的化学方程式为Zn+2HCl=ZnC12+H2↑;
因为反应的减少的质量即为生成的氢气的质量,生成氢气的质量为:
100g+100g-199.6g=0.4g;
设金属锌的质量为X,生成氯化锌的质量为Y
(3)黄铜样品中锌的质量(x)的比例式为:
65/2=x/0.4g;
(4)该黄铜样品中铜的质量分数是:
(100g-13g-7g)/100g×
100%=80%;
(5)过滤后溶液的质量为:
199.6g-87g+87.4g=200g;
故最终所得溶液中溶质的质量分数是27.2g/200g×
100%=13.6%;
(6)过滤后所得的不溶性物质洗涤、烘干,然后在空气中加热,充分反应,发生铜与氧气的反应,生成氧化铜;
根据
128/160=80g/zz=100g
所以得到固体混合物的质量为:
100g+7g=107g
溶液的计算、根据化学方程式的计算
18.
(1)65%
(2)19.6%
(1)根据图示可知,3.5克为合金中的铜,则锌的质量=10克-3.5克=6.5克,合金中锌的质量分数
=6.5克/10克×
100%=65%;
(2)根据锌的质量,利用化学方程式进行计算即可。
具体如下:
解得:
X=9.8g
所以,所用稀硫酸溶液中溶质的质量分数为:
溶质质量分数与化学方程式相结合的计算题