专题二十一 学科内综合题解题技巧1Word文件下载.docx
《专题二十一 学科内综合题解题技巧1Word文件下载.docx》由会员分享,可在线阅读,更多相关《专题二十一 学科内综合题解题技巧1Word文件下载.docx(18页珍藏版)》请在冰豆网上搜索。
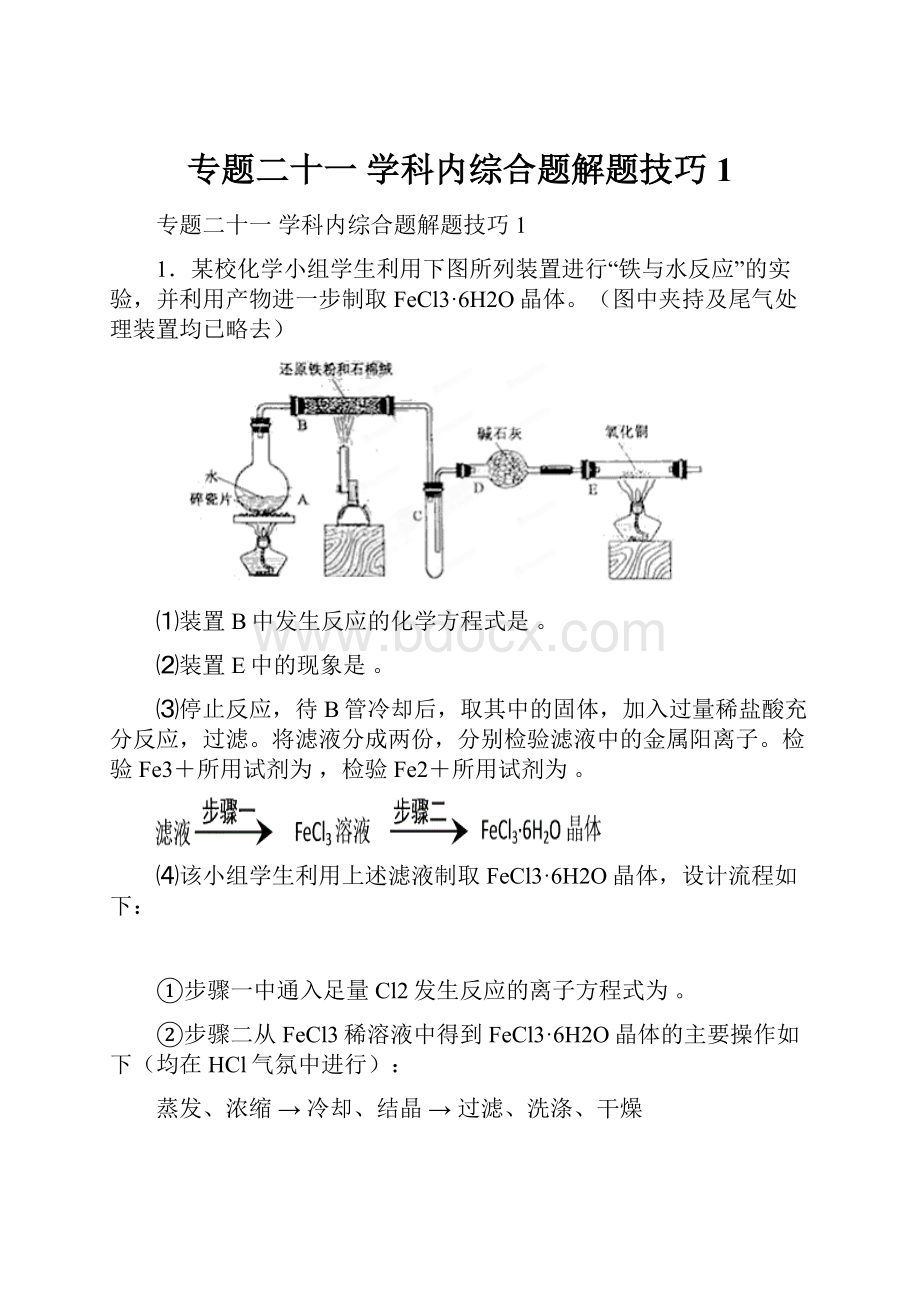
(10分)
⑴①2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ……(2分)
②Cl2+2OH-=Cl-+ClO-+H2O;
……(2分)③13……(2分)
⑵①SO2……(1分)4OH--4e-=O2↑+2H2O ……(3分)
②A……(1分)
3.常温下,某水溶液M中存在的离子有:
Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。
根据题意回答下列问题:
⑴写出酸H2A的电离方程式__________________________。
⑵若溶液M由10mL2mol·
L-1NaHA溶液与2mol·
L-1NaOH溶液等体积混合而得,则溶液M的pH________7(填“>
”、“<
”或“=”),溶液中离子浓度由大到小顺序为。
已知Ksp(BaA)=1.8×
10-10,向该混合溶液中加入10mL1mol·
L-1BaCl2溶液,混合后溶液中的Ba2+浓度为___________mol·
L-1。
⑶若溶液M由下列三种情况:
①0.01mol·
L-1的H2A溶液②0.01mol·
L-1的NaHA溶液③0.02mol·
L-1的HCl与0.04mol·
L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为_______;
pH由大到小的顺序为_________________。
⑷若溶液M由pH=3的H2A溶液V1mL与pH=11的NaOH溶液V2mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为___________(填“大于、等于、小于”或“均有可能”)。
(14分)⑴H2A
H++HA-HA-
H++A2-……(2分)(方程式写错扣两分)
⑵>……(2分)c(Na+)>
c(A2-)>
c(OH-)>
c(HA-)>
c(H+)……(2分)5.4×
10-10……(2分)
⑶③……(2分)②>③>①……(2分)
⑷均有可能……(2分)
4.A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去)
⑴若C为当今需要减排的一种热点温室气体,B为一种弱酸,则A化学式为______________。
⑵若D为白色胶状难溶物,且与A摩尔质量相等,则反应③的离子方程式为____________。
⑶若A为CO,则D的化学式为____________;
t℃时,在2L的密闭的容器中加入3molCO和0.75mol水蒸气,达到平衡时,CO的转化率为20%,在相同温度下再加入3.75mol水蒸气,再次达到平衡时,CO的转化率为_________。
(8分)
⑴F2 (2分)⑵3Al3++3AlO2-+6H2O=4Al(OH)3↓(2分)⑶Na2CO3 (2分)60%(2分)
【解析】⑴若C为CO2,则符合转化关系“
的A有三种:
、
,考虑到E为弱酸,则A应是F2。
⑵若D为白色胶状难溶物,设X为铝盐,D为Al(OH)3。
先看转化关系:
应有OH-
AlO2-
Al(OH)3。
再看相对分子质量:
Mr(D)=78,与Na2O2的摩尔质量相同,且转化关系也吻合,故反应
的离子方程式为3Al3++3AlO2-+6H2O=4Al(OH)3↓。
⑶若“A为CO”,则B为CO2、X为NaOH,C为NaHCO3,D为Na2CO3。
根据CO的转化率为20%可求得在t℃时该反应的平衡常数等于1,设再次达平衡时消耗xmolCO
CO+H2O
CO+H2
起始:
34.5
变化:
xxxx
平衡:
3-x4.5-xxx
则有:
x2/[(3-x)(4.5-x)]=1,解得x=1.8mol,由此求得(CO)=1.8/3×
100%=60%。
4.以下是25℃时几种难溶电解质的溶解度:
难溶电解质
Mg(OH)2
Cu(OH)2
Fe(OH)2
Fe(OH)3
溶解度/g
9×
10-4
1.7×
10-6
1.5×
3.0×
10-9
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。
例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶。
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的Mg(OH)2,充分反应,过滤结晶。
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶。
请回答下列问题:
⑴上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为而除去。
⑵①中加入的试剂应该选择___________________________为宜。
⑶②中除去Fe3+所发生的总反应的离子方程式为_____________________________。
⑷下列与方案③相关的叙述中,正确的是__________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>
4的溶液中Fe3+一定不能大量存在
【答案】⑴氢氧化铁(1分)⑵氨水(1分)
⑶2Fe3++3Mg(OH)2==3Mg2++2Fe(OH)3(3分)
⑷ACDE(4分)
5.电浮选凝聚法是工业上采用的一种污水处理方法:
保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。
Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。
阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。
⑴实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。
此时,应向污水中加入适量的__________。
a.BaSO4b.CH3CH2OHc.Na2SO4d.NaOH
⑵电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是
Ⅰ._____________________________;
Ⅱ.______________________________。
⑶电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是___________________________。
⑷该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。
A物质的化学式是_________________;
【答案】⑴c(2分)⑵Fe-2e-=Fe2+4OH-4e-=2H2O+O2↑(各2分)
⑶4Fe2++10H2O+O2=4Fe(OH)3↓+8H+(2分)
⑷CO2(2分)
6.红矾钠(重铬酸钠:
Na2Cr2O7·
2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作辅助剂,在化学工业和制药工业中也可作氧化剂,应用领域十分广泛。
实验室中红矾钠可用一种铬铁矿(主要成分:
FeO·
Cr2O3,还含有少量铝的氧化物)通过以下过程来制取。
I氧化IINaOH溶液浸取III
铬铁矿等原料Na2CrO4溶液
IV加H2SO4酸化V
产品:
2H2O
铬渣(含硫酸钠)
⑴步骤I中反应化学方程式为:
4FeO·
Cr2O3+8Na2CO3+7O2→8Na2CrO4+2Fe2O3+8CO2在常温下该反应速率极慢,下列措施中能使反应速率增大的是。
(填字母)
A.将原料粉碎B.增加纯碱的用量C.升高温度
⑵步骤III需将溶液的pH调至7~8,并煮沸,其目的是。
⑶步骤IV中发生反应的离子方程式为。
⑷利用下面的复分解反应,将红矾钠与KCl固体按1:
2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:
Na2Cr2O7+2KCl=K2Cr2O7+2NaCl(已知:
温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)。
基本实验步骤为:
溶解;
冷却、结晶,再过滤得K2Cr2O7晶体。
其中
应在(填“高温”或“低温”)条件下进行。
⑴A、C(2分)⑵除去AlO2-杂质(1分)
⑶2CrO42-+2H+==Cr2O72-+H2O(2分)
⑷
蒸发(1分)
过滤(1分)高温(1分)
【解析】⑴将原料粉碎,即增大反应物的接触面积,可加快反应速率,由于纯碱是固体,固体用量的多少不影响化学反应速率,升高温度可加快反应速率。
⑵由于题中明确铬铁矿中含有少量铝的氧化物,故后续操作必须除去铝,要注意的是本题不能回答除铁,原因是步骤
中反应已生成Fe2O3。
⑶利用步骤
的反应可反推步骤
中生成物是Na2Cr2O7,由此可知酸化时发生了CrO42-离子的缩合反应。
⑷由于
进行冷却结晶,故
必为趁热过滤。
7.甲苯是有机化工生产的基本原料之一。
利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。
⑴写出下列反应方程式
①B+D→E______________________________________________________。
②G→H______________________________________________________。
⑵①的反应类型为________;
②的反应类型为____;
F的结构简式为___________。
⑶E、J有多种同分异构体,写出符合下列条件的4种同分异构体结构简式。
要求:
①与E、J属同类物质②苯环上有两个取代基且苯环上的一氯代物只有两种。
①;
②;
③;
④。
(15分)
⑴①
②
⑵取代酯化(或取代)
⑶
【解析】分析整个流程图:
A是乙醇氧化产物乙醛,B是CH3COO-,B和D发生酯化反应生成E,由E的化学式可反推知D是苯甲醇,即C是甲苯侧链上的一氯取代产物。
由题中信息:
2个羟基连在同一碳原子上会失水形成羰基,故F是苯甲醛,其氧化产物I是苯甲酸,由苯甲酸反推得G是甲苯侧链上的三氯取代产物,水解产物H是苯甲酸钠。
8.有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素。
A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g·
L-,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族。
均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。
⑴单质B的结构式:
⑵F元素周期表中的位置:
⑶均含有F元素的乙与丁在溶液中发生反应的离子方程式;
均含有D元素的乙与丁在溶液中发生反应的离子方程式。
⑷由A、C元素组成化合物庚和A、E元素组成的化合物辛,式量均为34。
其中庚的溶沸点比辛
(填“高”或“低”),原因是。
【答案】⑴N≡N⑵第四周期第
族⑶Fe+2Fe3+=3Fe2+Al3++3AlO2-+6H2O=4Al(OH)3↓
⑷高H2O2分子间存在氢键
【解析】由题意可得A是H元素,M(甲)=22.4×
0.759=17g·
mol-1,由此可知B是N元素,C是O元素,E是硫元素,D是铝元素,此时乙和丁发生双水解反应生成丙,F是铁元素,此时乙和丁发生归中反应生成丙。
9.I.实验室有一瓶失去标签的某白色固体,已知其成份可能是碳酸或亚硫酸的钠盐或钾盐,
且其成分单一。
现某化学小组通过如下步骤来确定其成分:
⑴阳离子的确定:
实验方法及现象:
结论:
此白色固体是钠盐。
⑵阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:
取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
II.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤I称取样品1.000g。
步骤II将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤III移取25.00mL样品溶液于250mL锥形瓶中,用0.01mol·
L-1KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
⑴写出步骤III所发生反应的离子方程式。
⑵在配制0.01mol·
L-1KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量(填“偏大”、“偏小”或“无影响”)
⑶滴定结果如下表所示:
滴定次数
待测溶液的体积/mL
标准溶液的体积
滴定前刻度/mL
滴定后刻度/mL
1
25.00
1.02
21.03
2
2.00
21.99
3
2.20
20.20
则该变质固体中X的质量分数为。
10.甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
①CH4(g)+H2O(g)
CO(g)+3H2(g)H1
②CO(g)+2H2(g)
CH3OH(g)H2
将0.20molCH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
⑴温度不变,缩小体积,①的逆反应速率(填“增大”、“减小”或“不变”)。
⑵反应①的H10(填“<”“=”或“>”)100°
C时的平衡常数值K=。
⑶在压强为0.1Mpa条件下,将amolCO与3amolH2的混合气体在催化剂作用下进行反应②再生成甲醇。
为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中。
请在空格中填入剩余的实验条件数据。
实验编号
T(°
C)
n(CO)/n(H2)
p(MPa)
I
150
1/3
0.1
II
5
III
350
300°
C时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是(填字母)()
A.c(H2)减少B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加D.重新平衡时c(H2)/c(CH2OH)减小
⑷已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)H=-1275.6kJ·
mol-1
②2CO(g)+O2(g)=2CO2(g)H=-556.0kJ·
③H2O(g)=H2O(l)H=-44.0kJ·
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式。
⑸某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
【答案】⑴增大⑵>1.35×
10-3
⑶CD实验
1501/3实验
1/3
⑷CH3OH(l)+O2(g)
CO(g)+2H2O(g)H=-447.8kJ·
⑸①O2+2H2O+4e-=4OH-2CH3OH+3O2+4KOH=2K2CO3+6H2O
K=c(CO)×
c(H2)3/[c(CH4)×
c(H2O)]=0.01×
0.033/(0.01×
0.02)=1.35×
10-3。
⑶显然该同学通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,故实验
的温度是150℃,n(CO)/n(H2)=1/3,同样实验
中n(CO)/n(H2)同样等于1/3。
由于反应CO(g)+2H2(g)
CH3OH(g)是气体体积减小的反应,现体积缩小,即增大压强,反应物和生成物的浓度均增大,正逆反应速率均加快,化学平衡向正反应方向移动,综上分析,选项C和D正确。
⑷根据盖斯定律得(
—
+
×
4)/2得CH3OH(l)+O2(g)
mol-1。
⑸根据题意该原电池反应的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,故导致溶液的pH减小。
11.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。
现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。
在反应结束后的溶液中,逐滴加入5mol·
L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。
则
⑴B与A的差值为mol。
⑵C点对应的溶液体积为mL。
⑶原硝酸溶液中含硝酸的物质的量为mol。
⑷铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为。
⑸写出铝与该浓度硝酸反应的离子方程式。
【答案】⑴0.05⑵40⑶0.5⑷5:
3⑸8Al+30H++3NO3-=8Al3++3NH4++9H2O
【解析】由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,由图又可看出金属与硝酸反应后,硝酸是过量的,故金属的氧化产物为Fe(NO3)3、Al(NO3)3。
图中:
0→C:
H++OH-=H2O;
C→88:
R3++3OH-=R(OH)3↓(R代表Fe或Al);
88→94:
NH4++OH-=NH3•H2O;
94→104:
Al(OH)3+OH-=AlO2-+2H2O。
由
知n[Al(OH)3]=0.01L×
5mol·
L-1=0.05mol=n(Al),此值也是B与A的差值。
知,n(NH4NO3)=0.006L×
L-1=0.03mol,根据反应中得失电子相等的原则得:
3n(R3+)=0.03×
8=0.24mol,则n(R3+)=0.08mol=n(合金),故混合物中n(Al):
n(Fe)=5:
3。
0→88mL中,用于沉淀金属离子的OH-有0.08mol×
3=0.24mol,故C点:
(0.088L×
5mol·
L-1-0.24mol)/5mol·
L-1=0.04L,即40mL。