浙江省温州市乐清乐成寄宿中学学年高二化学月考试题Word文件下载.docx
《浙江省温州市乐清乐成寄宿中学学年高二化学月考试题Word文件下载.docx》由会员分享,可在线阅读,更多相关《浙江省温州市乐清乐成寄宿中学学年高二化学月考试题Word文件下载.docx(17页珍藏版)》请在冰豆网上搜索。
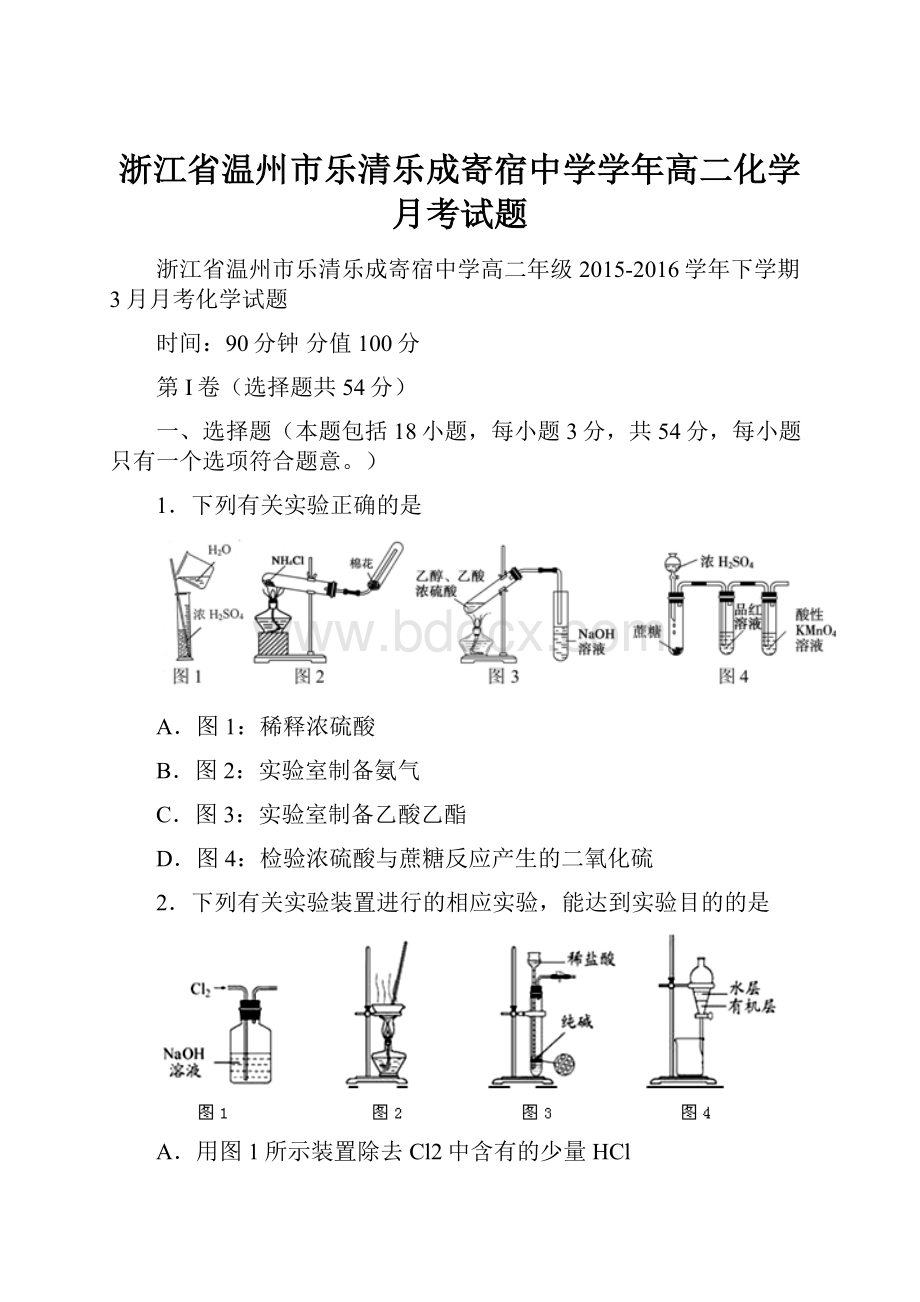
除去乙醇
中的苯酚
从KI和I2的固体
混合物中回收I2
配制100mL0.1000
mol·
L-1K2Cr2O7溶液
装
置
或
仪
器
6.下列操作中,完全正确的一组是
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶中的液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体
⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热
A.①④⑦⑩B.①④⑤⑦⑩C.①④⑤⑦⑧⑩D.④⑤⑦⑩
7.糖类、油脂和蛋白质是生命活动所必需的营养物质。
下列叙述正确的是
A.植物油不能发生水解反应B.棉花和蚕丝的主要成份都是纤维素
C.淀粉水解的最终产物是葡萄糖D.蛋白质溶液中加重金属盐发生物理变化
8.下列过程中,共价键被破坏的是
A.碘升华B.溴蒸气被木炭吸附
C.酒精溶于水D.氯化氢气体溶于水
9.X、Y是周期表短周期的两种元素。
下列叙述能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X的单质从NaX的溶液中置换出来
10.短周期元素W、X、Y、Z在元素周期表中的位置如图所示。
下列说法正确的是
A.W的非金属性比Z的弱
B.W的最高价氧化物对应的水化物是强酸
C.Y的原子半径在同周期主族元素中最大
D.Z的气态氢化物的稳定性在同主族元素中最强
11.下列物质中,含有共价键的离子化合物是
A.H2SO4B.MgCl2C.Na2OD.NaOH
12.元素的性质随着原子序数的递增呈周期性变化的本质原因是
A.元素的原子半径呈周期性变化
B.元素的原子核外电子排布呈周期性变化
C.元素的原子电子层数呈周期性变化
D.元素的常见化合价呈周期性变化
13.下列有关化学用语表示正确的是
A.四氯化碳分子比例模型:
B.次氯酸的结构式为H-Cl-O
C.CO2的电子式是:
D.
O2-离子结构示意图:
14.某阴离子X2—核外有m个电子,其质量数为a,则核内中子数为
A.m+2B.m+5C.a-m+2D.a-m-2
15.金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。
下列有关48Ti和50Ti的说法正确的是
A.48Ti和50Ti的质子数相同,互称同位素
B.48Ti和50Ti的质量数不同,属于两种元素
C.48Ti和50Ti的质子数相同,是同一种核素
D.48Ti和50Ti的质子数相同,中子数不同,互称同素异形体
16.下表给出几种氯化物的熔、沸点:
NaCl
MgCl2
CaCl2
SiCl4
熔点(℃)
801
712
782
-68
沸点(℃)
1465
1412
1600
57.6
①CaCl2属于离子晶体
②SiCl4是分子晶体
③1500℃时,NaCl可气化
④MgCl2水溶液不能导电。
则上述各项中与表中数据一致的有
A.仅①B.仅②C.①②④D.①②③
17.下列有关化学用语正确的是
A.某元素基态原子的电子排布图
B.NH4Cl电子式为
C.Ca2+离子基态电子排布式为1s22s22p63s23p6
D.α-羟基丙酸(乳酸)的比例模型为:
18.分析原子的杂化方式,并根据等电子体原理判断下列各组分子中的所有原子,或者处于同一平面,或者在一条直线上的是
A.C2H2、HClO、C2H6B.CO2、N2O、HC≡C—NH2
C.C6H5CH3、C3H4、CH4D.C6H6、C2H4、HCN
第II卷(共46分)
二、填空题(共46分)
19.(9分)下面A~F是几种常见的烃的分子球棍模型,根据这些模型回答下列问题:
(1)常温下含碳量最高的液态烃是________。
(2)能够发生加成反应的烃为________。
(3)一氯代物的同分异构体最多的是________(以上填对应字母)。
(4)由C制备聚合物的反应类型为____________,高分子中链节是____________。
(5)有机物G、H与E具有相同实验式,其中G式量是E式量的三分之二,H式量是E式量的4/3倍,G不能使溴水褪色,只有一种环境氢,G的结构简式为____________。
H是一种链状分子,且全部C原子共平面,有两种不同环境氢原子,H的结构简式为____________。
20.(8分)由于反应的情况不同,反应热可以分为多种,如燃烧热和中和热等。
(1)下列各项中的△H表示物质的燃烧热的是(填字母,下同),表示物质的中和热的是。
A.2H2(g)+O2(g)=2H2O(g)△H1
B.C(s)+1/2O2(g)=CO(g)△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)=CO2(g)△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H7
(2)25℃、101kPa时,1gC6H6(l)完全燃烧生成CO2(g)和H2O(l),放出41.8kJ的热量,则C6H6的燃烧热为,该反应的热化学方程式为。
21.(15分)X、Y、Z、W是元素周期表前四周期中的常见元素。
其相关信息如下表:
元素
相关信息
X
X的一种核素的质量数为18,中子数为10
Y
Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一
Z
Z的单质常温下为黄绿色气体
W
W的基态原子核外有4个未成对电子
(1)Z位于元素周期表的位置,写出Z的原子结构示意图。
(2)Y的电负性比Z的(填“大“或”小”);
X和Y的气态氢化物中,较稳定的是(写化学式)。
(3)X的一种氢化物H2X2分子中极性键和非极性健数目之比为。
(4)Z的一种单质与烧碱溶液作用可以生产日常生活用的消毒剂,请写出其反应的离子方程式:
。
(5)已知28gW在氧气中燃烧,放出186.4kJ的热量,请写出此反应的热化学方程式:
22.(12分)I、下列物质中属于强电解质的是;
属于弱电解质的是;
属于非电解质的是。
(填序号)①氨气②氨水③盐酸④醋酸⑤硫酸钡⑥银⑦氯化钠⑧二氧化碳⑨醋酸铵⑩氢气
II、某反应体系中的物质有:
Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O。
已知K2S2O8的氧化性比K2Cr2O7强。
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(不要求配平)
(2)反应中,被还原的物质是Cr2(SO4)3是
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:
Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为。
参考答案
1.D
【解析】
试题分析:
A.稀释浓硫酸时,将浓硫酸沿着器壁慢慢注入水中,并不断搅拌,量筒不能稀释浓硫酸,A错误;
B.氯化铵受热易分解生成氨气和氯化氢,则不能用图2制备氨气,B错误;
C.应该用饱和碳酸钠溶液吸收乙酸乙酯,则不能用图3制备乙酸乙酯,C错误;
D.SO2能使品红溶液和酸性高锰酸钾溶液褪色,则可以用图4:
检验浓硫酸与蔗糖反应产生的二氧化硫,D正确,答案选D。
考点:
考查化学实验方案设计与评价
2.D
A.氢氧化钠也与氯气反应,不能用图1所示装置除去Cl2中含有的少量HCl,A错误;
B.氯化铵受热易分解生成氨气和氯化氢,则不能用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体,B错误;
C.纯碱易溶于水,不是块状固体,则不能用图3所示装置制取少量纯净的CO2气体,C错误;
D.碘易溶在四氯化碳中,则用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层,D正确,答案选D。
3.A
A.分离Na2CO3溶液和CH3COOC2H5应该用分液法,选③,A错误;
B.用CC14提取碘水中的碘,选③,B正确;
C.用FeC12,溶液吸收C12,选⑤,C正确;
D.粗盐提纯需要过滤和蒸发,选①和②,D正确,答案选A。
考查化学实验基本操作
4.A
A.浓硝酸具有腐蚀性,见光易分解,因此浓硝酸应该用带玻璃塞的细口、棕色试剂瓶盛放,并贮存在阴凉处,A错误;
B.硫酸亚铁易被氧化,且亚铁离子水解,因此保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉,B正确;
C.钠易被氧化,易与水反应,密度大于煤油,因此少量金属钠保存在煤油中,C正确;
D.试剂瓶中的液溴可用水封存,防止溴挥发,D正确,答案选A。
考查化学试剂保存
5.A
A、溴易溶在四氯化碳中可用萃取溴水中的溴,A正确;
B、苯酚易溶在乙醇,不能过滤除去,B错误;
C、固体加热应该用坩埚,不能与蒸发皿,C错误;
D、配制100ml0.100mol/LK2Cr2O7溶液应该用100ml容量瓶,D错误,答案选A。
6.A
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部,①正确;
②给盛有液体的体积不超过1/3容积的试管加热,②错误;
③应该用手轻轻的煽动仅使少量气体飘进鼻孔去闻气体的气味,③错误;
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管,④正确;
⑤取用放在细口瓶中的液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着手心,⑤错误;
⑥不能将烧瓶放在桌上,用力塞紧塞子,⑥错误;
⑦用坩埚钳夹取加热后的蒸发皿,⑦正确;
⑧将滴管垂直于试管口上方滴加液体,⑧错误;
⑨稀释浓硫酸时,将浓硫酸沿着器壁慢慢注入水中,并不断搅拌,量筒不能稀释浓硫酸,⑨错误;
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热看导管口有气泡产生,停止加热后形成右端水柱,说明装置气密性良好,⑩正确,答案选A。
7.C
A.植物油属于油脂,酯类的一种,能发生水解反应,A项错误;
B.棉花的主要成分是纤维素,而蚕丝的主要成分是蛋白质,B项错误;
C.淀粉水解的最终产物是葡萄糖,C项正确;
D.蛋白质遇到重金属盐会发生变性,变性是化学变化,D项错误;
答案选C。
考查糖类、油脂和蛋白质的性质及检验等知识。
8.D
A.碘升华即I2由固态变为气态,破坏的是I2分子间的作用力,A项错误;
B.溴蒸气被木炭吸附,属于物理变化,没有破坏化学键,B项错误;
C.酒精溶于水,乙醇分子未被破坏,破坏的是分子间作用力,C项错误;
D.HCl气体溶于水后,在水分子的作用下,离解成H+、Cl-,破坏了氢、氯原子间的共价键,D项正确;
答案选D。
考查化学键的类型与破坏。
9.C
A.元素非金属性强弱与元素原子得电子能力有关,与电子层数无关,A项错误;
B.元素的非金属性越强,其对应的氢化物的稳定性就越强,而沸点由分子间作用力决定,属于物理性质,B项错误;
C.元素的非金属性越强,其对应的氢化物的稳定性就越强,由于稳定性X的氢化物比Y的氢化物稳定,所以非金属性X>
Y,C项正确;
D.在氧化还原反应中活动性强的能把活动性弱的置换出来,由于发生反应Y2+2X-=2Y-+X2,所以非金属性Y>
X,D项错误;
考查元素非金属性强弱的判断。
10.B
根据元素周期表的结构可知,X为He,Y为F,Z为S,W为Cl,A.同周期元素,从左到右,非金属性逐渐增强,则W的非金属性比Z的强,A项错误;
B.W为Cl,非金属性越强,最高价含氧酸的酸性最强,F没有含氧酸,所以HClO4是强酸,B项正确;
C.同周期元素从左到右,原子半径逐渐减小,C项错误;
D.非金属性:
Cl>
S,则气态氢化物的稳定性HCl>
H2S,D项错误;
答案选B。
考查元素周期表和元素周期律的应用。
11.D
一般来说,非金属元素之间易形成共价键,活泼金属和活泼非金属元素之间易形成离子键,含有离子键的化合物是离子化合物,A.H2SO4—共价键、共价化合物,A项不符;
B.MgCl2—离子键,离子化合物,B项不符;
C.Na2O—离子键,离子化合物,C项不符;
D.NaOH—离子键、共价键,离子化合物,D项符合;
考查化学键的类型及化合物的分类判断。
12.B
元素的性质随着原子序数的递增呈周期性变化的本质原因是元素的原子核外电子排布呈周期性变化的必然结果,答案选B。
考查元素周期律的实质。
13.C
A.四氯化碳分子中Cl原子比C原子体积大,在比例模型中,外面的四个小球的体积应该比里面的碳原子大,A项错误;
B.次氯酸分子的中心原子是O,结构式为H—O—Cl,B项错误;
C.CO2分子中C、O原子间共用2对共用电子对,C项正确;
D.氧原子的质子数为8,
O2-离子结构示意图为
,D项错误;
考查化学用语的正误判断。
14.C
根据质量数=质子数+中子数和阴离子核外电子数=核内质子数+所带电荷数,所以核内中子数为a-(m-2)=a-m+2,答案选C。
考查原子的组成及各种关系。
15.A
A.在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,质子数相同,中子数不同的同一种元素的不同核素互称为同位素,A项正确;
B.质子数相同,属于同种元素,B项错误;
C.它们的质子数相同,但中子数不同,属于不同的核素,C项错误;
D.同素异形体是指由同一种元素组成的性质不同的单质,它们表述的是原子,不是单质,D项错误;
答案选A。
考查原子的组成,同位素、同素异形体的判断。
16.D
A.根据表中数据可知氯化钙、氯化镁和氯化钠的熔沸点高于SiCl4的熔沸点,因此氯化钙、氯化镁和氯化钠属于离子晶体,SiCl4属于分子晶体,A、B项正确;
C.NaCl的沸点是1465℃,所以1500℃时,NaCl可气化,C项正确;
D.氯化镁是离子化合物,在溶液中能电离出离子,可以导电,D项错误;
考查晶体类型的判断及晶体的性质。
17.C
A中2p排一个电子的自旋方向相同,错误;
B中氯离子周围的电子需要表示出来,错误;
D中结构简式为CH3CH(OH)COOH,说明比例模型中羟基连接位置有误,错误。
考查化学用语
18.D
A.C2H2的中心原子是C,C原子的杂化类型是sp杂化,分子构型是直线形,HClO的中心原子是O,根据杂化轨道理论,应该是sp3不等性杂化,因此,它的分子构型是V形,A项错误;
B.CO2、N2O的中心原子采取sp杂化,分子构型为直线形,HC≡C—NH2中N原子的杂化类型为sp3杂化,三角锥形分子,B项错误;
C.C6H5CH3、C3H4、CH4中C原子采取sp3杂化,四面体形分子,C项错误;
D.C6H6、C2H4、HCN三分子均采取sp2杂化,平面形分子,D项正确;
考查等电子体原理,分子构型等知识。
19.
(1)E
(2)CEF(3)F(4)加聚反应,-CH2-CH2-
(5)
。
根据分子球棍模型,可知A为甲烷、B为乙烷、C为乙烯、D为丙烷、E为苯、F为甲苯;
(1)分子中碳原子数≥5的烃为液态,液态烃为苯和甲苯,含碳量最高的是苯;
(2)分子中含有碳碳双键、苯环能加成,所以能加成的是CEF;
(3)A、B、C、E的一氯代物只有一种,丙烷的一氯代物有2种;
甲苯的一氯代物有4种;
(4)乙烯制备聚乙烯属于加聚反应,分子的链结为-CH2-CH2-;
(5)G、H与E的实验式为CH;
G式量是52,G的分子式为C4H4,不能使溴水褪色,只有一种环境氢,G的结构简式为
;
H式量是104,分子式为C8H8,H是一种链状分子,且全部C原子共平面,有两种不同环境氢原子,H的结构简式为
本题考查有机物的结构和性质。
20.
(1)D、E;
F;
(2)3260.4kJ/mol;
C6H6(l)+15/2O2(g)=6CO2(g)+3H2O△H=-3260.4kJ/mol
A.氢气的物质的量为2mol,反应热△H1不能表示燃烧热,B.碳燃烧的生成物为CO,表示温度的氧化物CO2,反应热△H2不能表示燃烧热,C.1mol甲烷完全燃烧,生成的水是气态,不是稳定的状态,应为液态水,故反应热△H3不能表示燃烧热,D.C(s)+O2(g)═CO2(g)△H4中1molC完全燃烧生成二氧化碳,符合燃烧热概念,反应热△H4能表示燃烧热,E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5中1molC6H12O6完全燃烧生成二氧化碳与液态水,符合燃烧热概念,反应热△H5能表示燃烧热,F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6中实质是1mol氢离子与1mol氢氧根离子反应生成1molH2O,符合中和热概念,反应热△H6能表示中和热,G.反应生成的水为2mol,反应热△H7不能表示中和热,故答案为:
D、E;
F
(2)1gC6H6(l)气体完全燃烧生成液态水和CO2气体,放出41.8kJ的热量,则1molC6H6(l)2气体气体完全燃烧放出的热量41.8kJx78=3260.4kJ,故热化学方程式为C6H6(l)+15/2O2(g)=6CO2(g)+3H2O(l)△H=-3260.4kJ/mol
热化学方程式的书写
21.
(1)三周期ⅦA
(2)小;
H2O(3)2:
1
(4)Cl2+2OH—=Cl—+ClO—+H2O;
(5)3Fe(s)+2O2(g)=Fe3O4(s)△H=—1118.4kJ·
mol—1
【解析】
根据题意可得X是O;
Y是S;
Z是Cl;
W是Fe。
(1)Cl元素位于元素周期表第三周期第ⅦA族。
Cl的原子结构示意图是
(2)非金属性S<
Cl,元素的非金属性越强,其电负性越大。
所以S的电负性比Cl的小。
O和S是同一主族的元素,元素的非金属性O>
S。
元素的非金属性越强,其氢化物稳定性就越强,所以这两种元素形成气态氢化物中,较稳定的是H2O。
(3)在H2O2分子中含有2个H—O极性键和一个O—O非极性健,因此数目之比为2:
1。
(4)Cl2与NaOH溶液反应制取消毒液的离子方程式是Cl2+2OH—=Cl—+ClO—+H2O;
(5)Fe在氧气中燃烧的热化学方程式是3Fe(s)+2O2(g)=Fe3O4(s)△H=—1118.4kJ/mol.。
考查元素的推断、元素的电负性、分子结构、化学用语、离子方程式、热化学方程式的书写的知识。
22.I、
(1)⑤⑦⑨;
④;
①⑧;
II、
(1)7H2O+Cr2(SO4)3+3K2S2O8=7H2SO4+2K2SO4+K2Cr2O7;
(2)K2S2O8还原剂;
(3)3:
1
I、
(1)①氨气是非电解质;
②氨水是混合物;
既不是电解质,也不是非电解质;
③盐酸是混合物;
④醋酸是弱电解质;
⑤硫酸钡是强电解质;
⑥银是单质,既不是电解质,也不是非电解质;
⑦氯化钠是强电解质;
⑧二氧化碳是非电解质;
⑨醋酸铵是强电解质;
⑩氢气是单质,既不是电解质,也不是非电解质。
所以属于强电解质的是⑤⑦⑨;
属于弱电解质的是④;
属于非电解质的是①⑧;
II、
(1)根据题意,结合原子守恒和电子守恒,可得方程式7H2O+Cr2(SO4)3+3K2S2O8=7H2SO4+2K2SO4+K2Cr2O7;
(2)在反应中,K2S2O8得到电子被还原为K2SO4,所以被还原的物质是K2S2O8;
Cr2(SO4)3失去电子被氧化为K2Cr2O7;
所以Cr2(SO4)3是还原剂;
(3)在氧化还原反应中电子转移数目相等。
则在酸性条件下K2Cr2O7与草酸(H2C2O4)则反应时还原剂H2C2O4与氧化剂K2Cr2O7的物质的量关系的:
2n(H2C2O4)=2×
3n(K2Cr2O7),则还原剂与氧化剂物质的量之比为n(H2C2O4):
n(K2Cr2O7)=3:
1.
考查物质的分类、氧化还原反应方程式的配平、物质的作用及相互关系的知识。
23.
(1)其中的铁元素为+6价,易得电子(2分)
(2)高铁酸钾有强氧化性,能杀菌消毒(1分)产生的Fe(OH)3有吸附性,有絮凝作用(1分)
(3)①10(2分)②2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O(2分)
(4)放电时间长(1分)工作电压稳定(1分)
(1)高铁酸钾中的铁是+6价,处于高价态,易得电子,具有强氧性。
(2)高铁酸钾是具有强氧性,还原产物铁离子水解生成氢氧化铁胶体,具有吸附杂质、絮凝的作用。
(3)①2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,6molNa2O2中12mol的负一价氧,2mol的有变成0价,还有10mol变成-2价,而铁是+2价变为+6价,所以每生成2molNa2FeO4时转移电子10mol;
②Fe(NO3)3被NaClO氧化成Na2FeO4,反应