化学化学反应原理综合考查的专项培优练习题含答案及详细答案Word下载.docx
《化学化学反应原理综合考查的专项培优练习题含答案及详细答案Word下载.docx》由会员分享,可在线阅读,更多相关《化学化学反应原理综合考查的专项培优练习题含答案及详细答案Word下载.docx(35页珍藏版)》请在冰豆网上搜索。
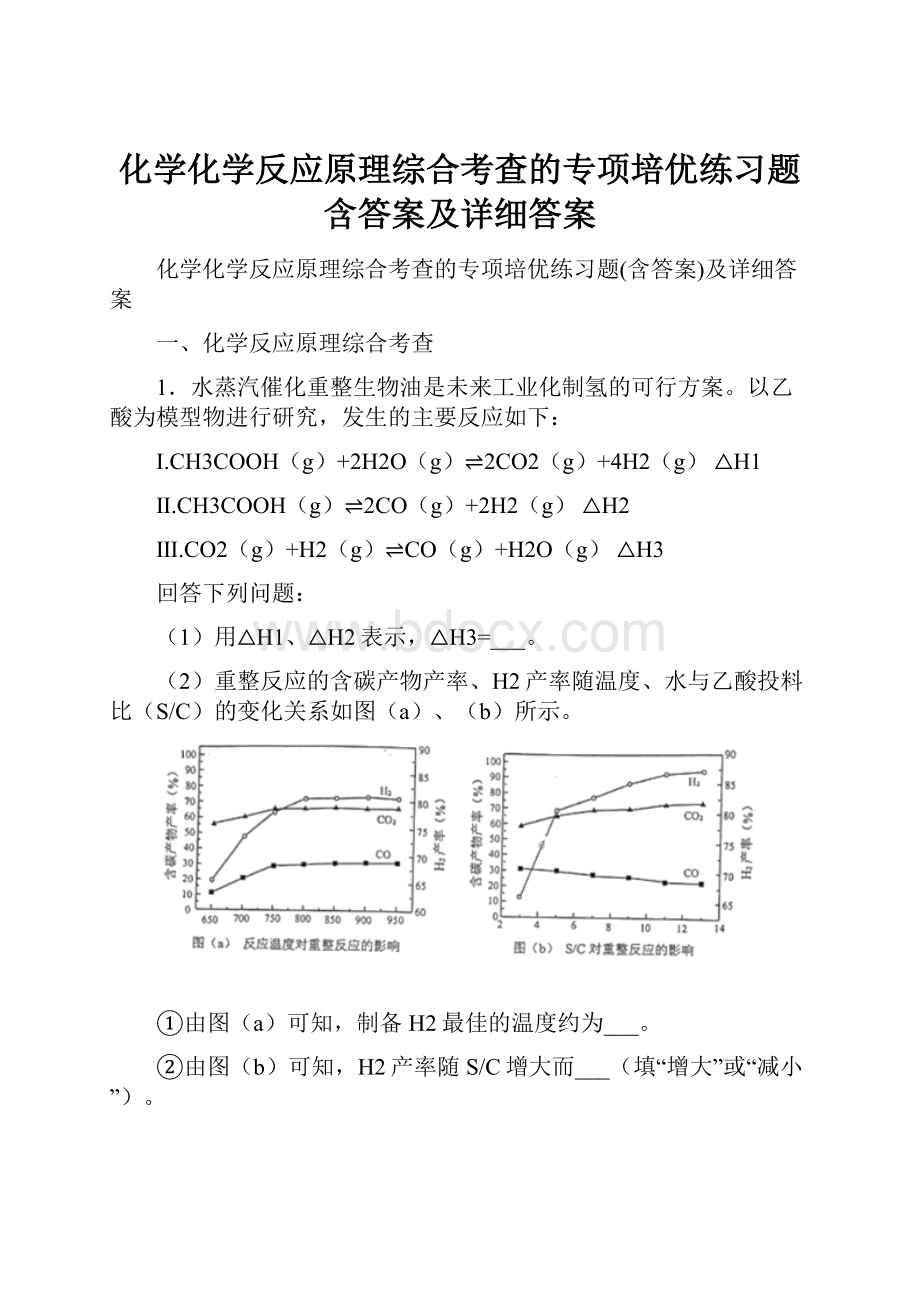
测得H2的体积分数为50%,则
,计算得x=0.4mol,醋酸的转化率为:
=40%,即CH3COOH平衡转化率为40%,故答案为:
40%;
(4)当温度一定时,随着S/C增加,积碳量逐渐减小,是由于积碳与水蒸气反应生成了CO和H2,反应的化学方程式为C(s)+H2O(g)
CO(g)+H2(g),故答案为:
C(s)+H2O(g)
CO(g)+H2(g);
2.秋冬季是雾霾高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NO,可减少氮氧化物的排放。
已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ·
mol−1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ·
甲烷直接将NO2还原为N2的热化学方程式为_____________________________________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)
N2(g)+2CO2(g)ΔH<
T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如上图所示。
①已知:
平衡时气体的分压=气体的体积分数×
体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp=_______;
平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____(填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是__(填序号)
A.增大CO浓度B.升温C.减小容器体积D.加入催化剂
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2,和氮的氧化物气体(NOx),如用氢氧化钠溶液吸收可得到Na2SO3、NaHSO3、NaNO2、NaNO3等溶液。
常温下,HNO2的电离常数为Ka=7×
10-4,H2SO3的电离常数为Ka1=1.2×
10-2、Ka2=5.8×
10-8。
①常温下,相同浓度的Na2SO3、NaNO2溶液中pH较大的是______溶液。
②常温下,NaHSO3显___性(填“酸”“碱”或“中”,判断的理由是(通过计算说明)_____________。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。
雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1)。
可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:
_______________________________。
【答案】CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)ΔH=-867kJ·
mol−10.0875(MPa)-1或
(MPa)-1不ACNa2SO3酸因为HSO3-的电离常数Ka2=5.8×
10-8,水解常数Kh=
≈8.3×
10-13,电离常数大于水解常数,所以溶液显酸性a2NO2-+8H++6e−=N2↑+4H2O
(4)电解过程中Ce3+在阳极失电子,变为Ce4+,则b进Ce3+,a出Ce4+,NO2-在阴极得电子变为N2,则d进NO2-,c出N2。
(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·
得:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)ΔH=
=-867kJ·
mol−1,故答案为:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)ΔH=-867kJ·
mol−1;
(2)①由图可知,NO起始物质的量为0.4mol,0到15min共减少了0.2mol,则
,平衡时p(NO)=20MPa×
=
MPa,同理可得:
p(CO)=
MPa,p(N2)=
MPa,p(CO2)=
MPa,所以Kp=
=0.0875(MPa)-1或
(MPa)-1。
再向容器中充入NO和CO2各0.3mol,加入的NO和CO2物质的量相等,那么二者引起压强增大量相等,假设二者引起的压强增量分别为p,则Qc=
(MPa)-1,Qc=Kp,平衡不移动,故答案为:
0.0875(MPa)-1或
(MPa)-1;
不;
②由图可知NO物质的量减小,说明平衡正向移动。
A.增大CO浓度,平衡正向移动,NO物质的量减小,A正确;
B.升温,平衡逆向移动,NO物质的量增大,B错误;
C.减小容器体积,等同于增大压强,平衡正向移动,NO物质的量减小,C正确;
D.加入催化剂,反应速率增大,但平衡不移动,NO物质的量不变,D错误;
故答案为:
AC;
(3)①HNO2的电离常数为Ka=7×
10-8可知,HNO2的酸性强于HSO3-的酸性,则NO2-的水解程度小于SO32-,所以相同浓度的Na2SO3、NaNO2溶液,Na2SO3的碱性更强,pH更大,故答案为:
Na2SO3;
②HSO3-+H2O
H2SO3,Ka2×
Kh=Kw,故HSO3-的水解常数Kh=
10-13,又因为HSO3-的电离常数Ka2=5.8×
10-8,所以,HSO3-的电离常数大于水解常数,常温下,NaHSO3显酸性,故答案为:
酸;
因为HSO3-的电离常数Ka2=5.8×
10-13,电离常数大于水解常数,所以溶液显酸性;
(4)①生成Ce4+,则Ce3+-e-=Ce4+,Ce4+在阳极生成,从a口流出,故答案为:
a;
②NO2-转化为无毒物质,则NO2-在阴极得电子,转化为N2,结合电子得失守恒、电荷守恒可得阴极电极反应为:
2NO2-+8H++6e−=N2↑+4H2O,故答案为:
2NO2-+8H++6e−=N2↑+4H2O。
【点睛】
Ka×
Kh=Kw,越弱越水解。
3.(11分)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。
下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。
P204[二(2−乙基己基)磷酸酯]常用于萃取锰,P507(2−乙基己基膦酸−2−乙基己酯)和Cyanex272[二(2,4,4)−三甲基戊基次磷酸]常用于萃取钴、镍。
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式__________________________________。
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:
加入NaOH溶液调pH=5可除去图中的________(填金属离子符号)杂质;
写出除去金属离子的离子方程式________________________(一种即可)。
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。
萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nNa+(aq)。
对萃取剂进行皂化处理的原因为________________。
(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。
■—Co(Cyanex272);
●—Ni(Cyanex272);
▲—Co(P507);
▼—Ni(P507)
由图可知,钴、镍的萃取率随萃取剂浓度增大而_________(填“增大”或“减小”);
两种萃取剂中___________(填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为__________mol·
L−1;
若选Cyanex272萃取剂,则最适宜的萃取剂浓度大约为___________mol·
L−1。
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。
已知Ksp[Ni(OH)2]=5.25×
10−16,则沉镍母液中Ni2+的浓度为2.1×
10−11mol·
L−1时,pH=______(lg5=0.7)。
【答案】2LiCoO2+3H2SO4+H2O2
Li2SO4+O2↑+2CoSO4+4H2OFe3+、Al3+(1分,少选和错选没分)Fe3++3OH−
Fe(OH)3或Al3++3OH−
Al(OH)3(合理即可)维持萃取过程中pH恒定增大Cyanex2720.250.411.7
(1)LiCoO2与硫酸和H2O2反应生成能使带火星木条复燃的气体,说明LiCoO2在硫酸作用下把H2O2氧化成O2,+3价Co降低为+2价的Co2+,方程式为2LiCoO2+3H2SO4+H2O2
Li2SO4+O2↑+
2CoSO4+4H2O。
(2)由图可知,加入NaOH溶液调pH=5时,Fe3+、Al3+沉淀完全,所以去除Fe3+的离子方程式为Fe3++3OH−
Fe(OH)3,去除Al3+的离子方程式为Al3++3OH−
Al(OH)3。
(3)nHR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),会使溶液酸性增强,萃取效率下降,故用NaOH进行皂化处理后离子反应变为nNaR(Org)+Mn+(aq)
MRn(Org)+nNa+(aq),反应前后pH基本不变,根据题意可知,萃取效率不会降低。
故萃取前先用NaOH对萃取剂进行皂化处理的目的是维持萃取过程中pH恒定。
(4)由图可知,钴、镍的萃取率随萃取剂浓度增大而呈增大趋势,萃取时“Cyanex272”比“P507”对钴、镍萃取率的差值大,Cyanex272分离效果好。
选P507为萃取剂,浓度在0.25mol·
L−1以后变化不大,所以0.25mol·
L−1最好;
选Cyanex272萃取剂,浓度在0.40mol·
L−1以后变化不大,所以0.4mol·
L−1最好。
(5)Ksp[Ni(OH)2]=c(Ni2+)·
c2(OH−)=5.25×
10−16,c2(OH−)=
=2.5×
10−5,c(OH−)=5×
10−3,pOH=3−lg5=2.3,pH=14−pOH=14−2.3=11.7。
4.I.合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知:
5.6L(标况下)CH4与水蒸气完全反应,吸收51.5KJ的热量,请写出该反应的热化学方程式_______________________________________________。
(2)在150℃时2L的密闭容器中,将2molCH4和2molH2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____________。
②在该温度下,计算该反应的平衡常数K=________________________(保留两位小数)。
③下列选项中能表示该反应已达到平衡状态的是__________________________
A.v(H2)逆=3v(CO)正B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变D.C(CH4)=C(CO)
(3)合成气中的氢气也用于合成氨气:
N2+3H2
2NH3。
保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。
则下列说法正确的是___________。
容
器
体积
起始物质
平衡时NH3的物质的量
平衡时N2的
体积分数
反应开始时的速率
平衡时容器内压强
甲
1L
1molN2+3molH2
1.6mol
φ甲
ν甲
P甲
乙
2molN2+6molH2
n1mol
φ乙
ν乙
P乙
丙
2L
n2mol
φ丙
ν丙
P丙
A.n1=n2=3.2B.φ甲=φ丙>φ乙C.ν乙>ν丙>ν甲D.P乙>P甲=P丙
II.
(1)常温下,在xmol·
L-1氨水中加入等体积的ymol·
L-1硫酸得混合溶液M恰好显中性。
①M溶液中所有离子浓度由大到小的顺序为_________________。
②常温下,NH3·
H2O的电离常数K=_____(用含x和y的代数式表示,忽略溶液混合前后的体积变化)。
(2)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
阴极的电极反应式为___________________________。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)________。
【答案】CH4(g)+H2O(g)=CO(g)+3H2(g)
21.87ACBD
2NO+4e-=N2+2O2-阴极发生副反应O2+4e-=2O2-
I.
(1)标况下,5.6LCH4物质的量为:
=0.25mol,吸收51.5kJ的热量,则1mol甲烷反应吸收热量=51.5kJ×
=206kJ,该反应的热化学方程式为:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206kJ/mol;
(2)在150℃时2L的密闭容器中,将2molCH4和2molH2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%,则
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=
=0.12mol•L-1•min-1;
②结合①计算得到的平衡浓度,计算得到该反应的平衡常数K=(1.83×
0.6)/(0.4×
0.4)=21.87;
③A.v逆(H2)=3v正(CO),说明正逆反应速率相同,反应达到平衡状态,故A正确;
B.密闭容器中混合气体的质量和体积不变,密度始终不变,不能说明反应达到平衡状态,故B错误;
C.反应前后气体物质的量增加,气体压强之比等于气体物质的量之比,密闭容器中总压强不变,说明反应达到平衡状态,故C正确;
D.浓度关系和消耗量、起始量有关,c(CH4)=c(CO)不能说明反应达到平衡状态,故D错误;
(3)A.甲和丙为等效平衡,则n2=1.6mol,但乙与甲相比,相当于增大压强,平衡向着正向移动,则n1>3.2,故A错误;
B.甲和丙达到平衡状态为相同平衡状态,氮气体积分数相同,乙相当于甲平衡状态再加入1mol氮气和3mol氢气,增大压强平衡正向进行,氮气体积分数减小,φ甲=φ丙>φ乙,故B正确;
C.乙容器中反应物浓度大于甲和丙,反应速率大,甲和丙起始浓度相同反应速率相同,故C错误;
D.乙中物质浓度是甲的2倍,且压强大于甲,甲和丙为等效平衡,压强相同,得到P乙>P甲=P丙,故D正确;
BD;
II.
(1)①根据电荷守恒,c(NH4+)+c(H+)=c(OH-)+2c(SO42-),混合后溶液显中性,则c(NH4+)=2c(SO42-),则
②xmol•L-1氨水中加入等体积的ymol•L-1硫酸得混合溶液M恰好显中性,则c(NH4+)=2c(SO42-)=2×
mol•L-1=ymol•L-1,混合后,根据物料守恒c(NH3•H2O)+c(NH4+)=0.5xmol•L-1,则c(NH3•H2O)=(0.5x-y)mol•L-1,K=c(NH4+)•c(OH-)/c(NH3•H2O)=y×
1×
10-7/(0.5x-y)=2y×
10-7/(x-2y);
(2)①阴极:
NO得到电子生成N2,结合守恒原则,则电极方程式为2NO+4e-=N2+2O2-;
②消除一定量的NO所消耗的电量远远大于理论计算量,可能存在副反应,O2浓度约为NO浓度的10倍,氧气易得到电子生成O2-,电极方程式为:
O2+4e-=2O2-。
5.煤燃烧排放的烟气含有SO2和NOx,大量排放烟气形成酸雨、污染大气,因此对烟气进行脱硫、脱硝,对环境保护有重要意义。
Ⅰ.利用CO脱硫
(1)工业生产可利用CO气体从燃煤烟气中脱硫,则25℃时CO从燃煤烟气中脱硫的热化学方程式2CO(g)+SO2(g)⇌2CO2(g)+S(s)的焓变△H=_____________。
25℃,100kPa时,由元素最稳定的单质生成1mol纯化合物时的反应热称为标准摩尔生成焓,已知一些物质的“标准摩尔生成焓”如下表所示:
物质
CO(g)
CO2(g)
SO2(g)
标准摩尔生成焓∆fHm(25℃)/kJ∙mol-1
-110.5
-393.5
-296.8
(2)在模拟脱硫的实验中,向多个相同的体积恒为2L的密闭容器中分别通入2.2molCO和1molSO2气体,在不同条件下进行反应,体系总压强随时间的变化如图所示。
①在实验b中,40min达到平衡,则0~40min用SO2表示的平均反应速率v(SO2)=_______。
②与实验a相比,实验b可能改变的条件为_______________,实验c可能改变的条件为_________________。
Ⅱ.利用NH3脱硝
(3)在一定条件下,用NH3消除NO污染的反应原理为:
4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)△H=-1807.98kJ·
mol-1。
在刚性容器中,NH3与NO的物质的量之比分别为X、Y、Z(其中X<
Y<
Z),在不同温度条件下,得到NO脱除率(即NO转化率)曲线如图所示。
①NH3与NO的物质的量之比为X时对应的曲线为_____________(填“a”“b”或“c”)。
②各曲线中NO脱除率均先升高后降低的原因为__________。
③900℃条件下,设Z=
,初始压强p0,则4NH3(g)+6NO(g)⇌5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
Ⅲ.利用NaCIO2脱硫脱硝
(4)利用NaClO2的碱性溶液可吸收SO2和NO2(物质的量之比为1:
1)的混合气体,自身转化为NaCl,则反应的离子方程式为________________。
【答案】-269.2kJ·
mol-10.01mol·
L-1·
min-1加入催化剂升高温度c温度低于900℃时,反应速率较慢,随着温度升高反应速率加快,NO脱出率逐渐升高,温度高于900℃,反应达到平衡状态,反应的ΔH<
0,继续升高温度,平衡向左移动,NO脱出率又下降
3ClO2-+4SO2+4NO2+12OH-===3Cl-+4SO42-+4NO3-+6H2O
(1)根据“标准摩尔生成焓”的定义可得:
再根据盖斯定律2(反应③-反应①)-反应③可得到2CO(g)+SO2(g)⇌2CO2(g)+S(s),则,CO脱硫反应2CO(g)+SO2(g)⇌2CO2(g)+S(s)的焓变
-269.2kJ·
mol-1;
(2)①结合题干信息,列三段式有:
则
,解得x=0.8,则
,故答案为0.010.01mol·
min-1;
②与实验a相比,实验b达到的平衡状态不变且所需时间缩短,改变的条件应为加入了催化剂,与实验a相比,实验c达到平衡状态改变且所需时间缩短,可能是增大压强或升高温度,联系反应特点,若是增大压强,平衡向右移动,向右反应的程度应增大,与图像不符,若是升高温度,平衡向左移动,与图像相符,故答案为:
加入催化剂;
升高温度;
(3)①NH3和NO的物质的量之比越大,NO的脱出率月啊,则相同温度下,不同NH3、NO物质的量之比对应NO的脱出率:
X<
Z,则X对应曲线c,Y对应曲线b,Z对应曲线a,故答案为:
c;
②NO的脱出率会受到速率、平衡移动等因素的影响,温度低于900℃时,反应速率较慢,随着温度升高反应速率加快,NO脱出率逐渐升高,温度高于900℃,反应达到平衡状态,反应的ΔH<
0,继续升高温度,平衡向左移动,NO脱出率又下降,故答案为:
温度低于900℃时,反应速率较慢,随着温度升高反应速率加快,NO脱出率逐渐升高,温度高于900℃,反应达到平衡状态,反应的ΔH<
0,继续升高温度,平衡向左移动,NO脱出率又下降;
③压强为p0,根据曲线a上NH3与NO的物质的量之比为
,则NH3的分压为0.4p0,NO的分压为0.6p0,列三段式有:
则反应的平衡常数
(4)在碱性环境下,ClO2-氧化等物质的量的SO2和NO2,ClO2-变为Cl-,SO2变为SO42-,NO2变为NO3-,利用氧化还原反应规律进行配平,可得离子反应方程式3ClO2-+4SO2+4NO2+12OH-===3Cl-+4SO42-+4NO3-+6H2O,故答案为:
3ClO2-+4SO2+4NO2+12OH-==