物理化学习题解答docWord下载.docx
《物理化学习题解答docWord下载.docx》由会员分享,可在线阅读,更多相关《物理化学习题解答docWord下载.docx(51页珍藏版)》请在冰豆网上搜索。
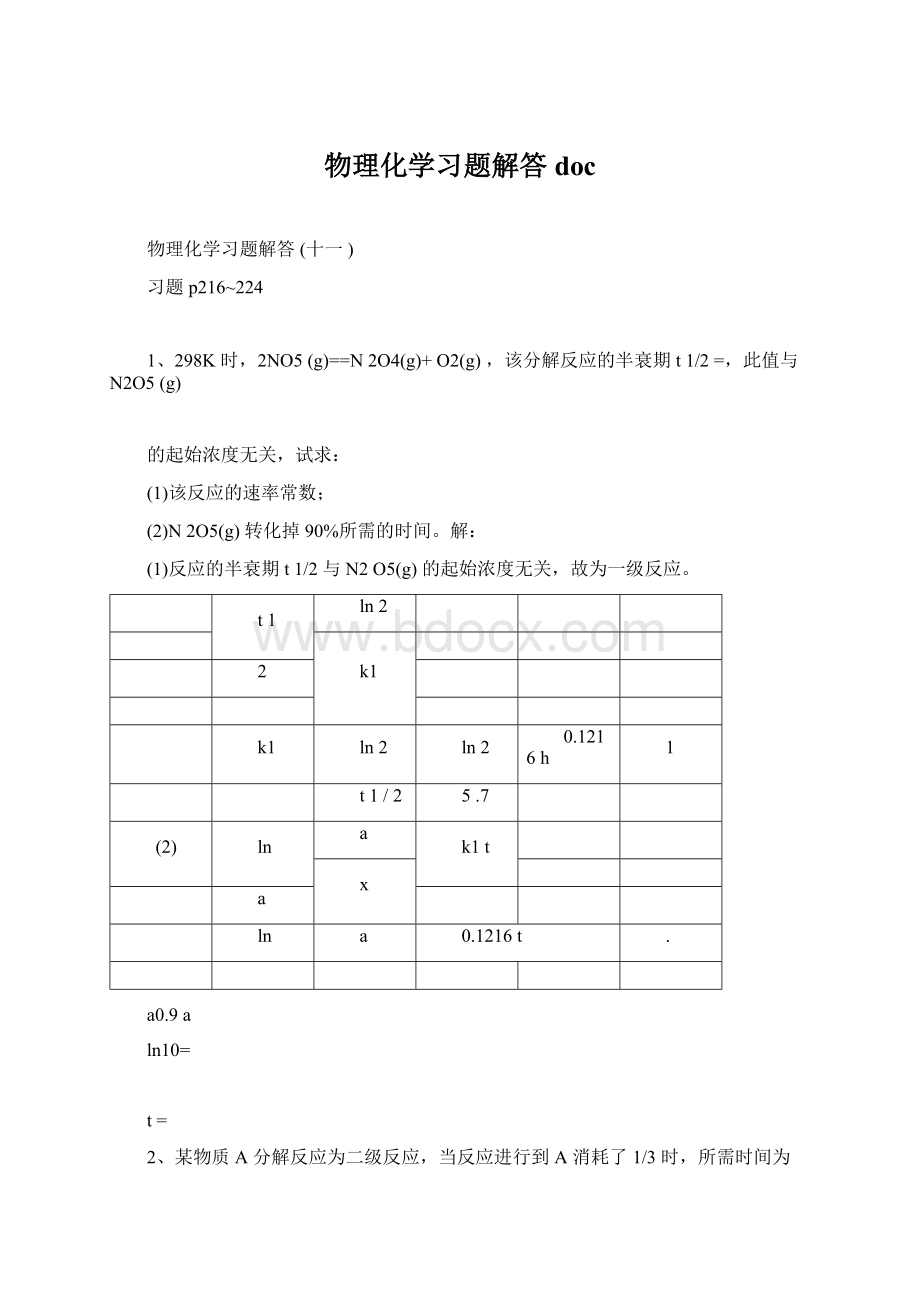
dt
kdt
[A]2
[A]2
2d[A]2
[A]
t
d[A]2
[A]0
2{[A]2
[A]02}
k(t0)
{1[A]0
1kt1
}2
2[A]
0}
(
)[A]0
kt1
(22)[A]0
t12(2
2kt1
1)[A]02
4、在298K时,用旋光仪测定蔗糖的转化率,在不同时间所测得的旋光度αt如
下:
t/min
10
20
40
80
180
300
∞
o
–
αt/()
试求该反应的速率常数
k值。
ln(
)
kt
ln(0
αt–α∞)
由
作图,直线斜率–k
–×
-3
,速率常数k×
-3-1
。
ln(α
–α
)~
=
min
=10
2.2
2.0
1.8
1.6
α∞1.4
-
(nα1.2
斜率=-0.0053
l
1.0
0.8
0.6
0.4
50
100
150
200
250
t/min
5、在298K时,测定乙酸乙酯皂化反应速率。
反应开始时,溶液中酯与碱的浓度
都为,每隔一定时间,用标准酸溶液滴定其中的碱含量,实验所得结果如下:
5
7
15
21
25
[OH]/
(1)证明该反应为二级反应,并求速率常数k值;
(2)若酯与碱的浓度都为,试计算该反应完成95%时所需的时间及该反应的半衰期。
(1)x/(a–x)=akt
x/(a–x)
由x/(a–x)~t作图,得一直线,即证明该反应为二级反应;
直线斜率ak=,反
应速率常数k=.min-1
)x
(/
3.0
2.5
1.5
斜率=0.11796
0.5
0.0
0510152025
(2)(a–=akt19=×
t=
6、含有相同物质的量的A、B溶液,等体积相混合,发生反应A+B→C,在反应经过后,A已消耗了75%;
当反应时间为时,在下列情况下,A还有多少未反应
(1)当该反应对A为一级,对B为零级;
(2)当对A、B均为一级;
(3)当对A、B均为零级。
A+B
C
t=0
t=t
–x
(1)r
k[A][B]0
k[A]
dx
dln(ax)
x)
dln(a
dt
ln(a
x)
lna
k(t
0)
0.75a)
k(t0)
ln(0.25a)
k(1
0)
ln(0.25a/a)
ln0.25
ln0.25(20)
(a
x)/a
0.252
6.25%
(2)r
k[A][B]
k[A]2
x)2
d(a
d(a
x)1
a1
k(t
(0.25a)
k3a
1a1k(10)
(ax)
3a1(20)
7a1
14.285%
(3)r
k[A]0[B]0
dx
0.75a
0.75a
00.75a(2
1.5a
(ax)/a
0.5表明已完全反应。
7、298K时,NaOH和CHCOOCH皂化作用的速率常数k
与NaOH和CHCOOCH皂化
作用的速率常数
k2′的关系为k2
k2′。
试计算在相同的实验条件下,当有
的
90%
CH3COOCH3被分解时,CH3COOC2H5的分解分数(设碱与酯的浓度均相等)。
x/(a–x)=akt
(a–=ak2t
x/(a–x)=ak2′t
9(a–x)/x=
(a–x)/x=14/15
x=15/29a=a
当有90%的CH3COOCH3被分解时,CH3COOC2H5的分解分数52%。
8、设有一n级反应(n≠1)。
若反应物的起始浓度为a,证明其半衰期表示式为(式
中k为速率常数):
2n1
(n1)a
n
(a
x)n
x)1n
(n
1)kdt
1n
d(ax)
(n1)kdt
a1n
(n1)kt
当x=1/2a,t=t1/2
(a1/2a)1na1n(n1)kt1/2
(2n–1–1)
a1–n=(n–1)kt1/2
t1/2=(2n–1–1)a1–n/(n–1)k
,即证。
1)a
n1
当x=3/4a,t=t3/4
(a3/4a)1na1n(n1)kt3/4
(22n–2–1)
a1–n=(n–1)kt3/4
t3/4=(22n–2–1)
a1–n/(n–1)
t3
22n
4
9、对反应2NO(g)+2H(g)→N(g)+2H
O(l)进行了研究,起始时
NO(g)与H(g)的
物质的量相等。
采用不同起始压力p0,相应地有不同的半衰期。
实验数据如下:
p0/kPa
t1/2/min
81
102
140
224
求该反应的级数。
lnt1(1n)lnp0lnA
lnp0
lnt1/2
由lnt1/2~lnp0作图,直线斜率(1–n)=–,反应级数n=
nl
5.4
5.2
5.0
/
4.8斜率=-1.656
4.6
4.4
3.23.33.43.53.63.73.83.94.0
10、已知某反应的速率方程可表示为rkp[A][B][C],请根据下列实验数
据,分别确定反应对各反应物的级数α、β、γ的值和计算速率常数k。
r/
rkp[A][B][C]
=kpαβγ
α=α,α=+α
–α=–α,α=
β=2β,β=ln2+β
–β=–β,β=–1
γ=γ,γ=0
=kp-10
kp=5/{-1}=25mol-1/
11、碳的放射性同位素14C在自然界树木中的分布基本保持为总碳量的×
10-13%,
某考古队在一山洞中发现一些古代木头燃烧的灰烬,经分析14C的含量为总碳量
的×
10-14%。
已知14C的半衰期为5700a,试计算这灰烬距今约有多少年
放射性同位素14C的蜕变是一级反应。
×
10-14%=×
10-13%/2n
–14ln10=–13ln10–nln2
–=––
=––+=
n=
year=×
5700a=
12、某抗菌素在人体血液中分解呈现简单级数反应,如果给病人在上午8点注射
一针抗菌素,然后在不同时t测定抗菌素在血液中的质量浓度ρ[单位以
mg/100cm表示],得如下数据:
t/h
8
12
16
ρ/(mg/100cm3)
试计算:
(1)该分解反应的级数;
(2)求反应的速率常数k和半衰期t1/2;
(3)若抗菌素在血液中质量浓度不低于(100cm3)才有效,求注射第二针的时间。
(1)设为一级反应,ln(a–x)=
–kt
+ln
a,则ln(a–x)~t
作图应为一直线:
lnρ
-0.6
-0.8
-1.0
-1.2
ρ
nl-1.4
截距b=-0.3495
-1.6
斜率=-0.0963
-1.8
-2.0
46810121416
t/h
所以该反应为一级反应。
(2)由直线斜率–k=–,可求得速率常数k=.h-1
半衰期t1/2=ln2/k==
(3)直线方程为lnρ=––
=–
–=––
t=,故注射第二针的时间为14:
42。
13、在一抽空的刚性容器中,引入一定量纯气体A(g),发生如下反应:
A(g)→B(g)+2C(g)
设反应能进行完全,在323K恒温一定时间后开始计时,测定系统的总压随时间
的变化情况,实验数据如下:
t/min03050∞
p总/kPa
求反应的级数和速率常数。
A(g)
→B(g)
+2C(g)
t=0
pA
t=t
pA0–pA
2(pA0–pA)
p总
=3
pA0–pA,pA
pA0–p总
)/2
=(3
pA0=/3=
设反应为二级反应,r=–dpA/dt=kpA2
1/pA–l/pA0=kt,由1/pA~t作图应得一直线:
t0
+30
+0
+50
pA/kPa
1/pA
0.080
0.075
0.070
0.065
0.060
pA
0.055
0.050
斜率=7.50368×
10-5
0.045
0.040
0.035
30
所以该反应为二级反应,速率常数k=×
14、反应[Co(NH3)3F]2++H2O[Co(NH3)3H2O]3++F-是一个酸催化反应,若反应
的速率方程为r=k[Co(NH3)3F2+]α[H+]β,在指定温度和起始浓度条件下,络合物
反应掉1/2和3/4所用的时间分别为
t1/2和t3/4,实验数据如下:
实验编号
T/K
t1/2/h
t3/4/h
298
308
试根据实验数据求:
(1)反应的级数α和β的值;
(2)不同反应温度时的反应常数k值;
(3)反应实验活化能Ea值。
(1)在反应过程中酸的浓度可近似认为不变,因此反应可认为准
α级反应。
t3/4
t1/2
,这是一级反应的特点,故
α。
=2
=1
A1=kβ
A2=kβ
=A1/A2=β/β
1/2=β/{2ββ}=1/2β,故β=1。
E
1,
,
,k
RTa
=ln2/
(298)==ln2/
(308)=
=ln2/A
Ae
Ea
k1/k2
e
8.314
1/2
ln0.5
8.314
、当有
I
2存在作为催化剂时,氯苯
65
与
Cl
2在
298308/=
(CHCl)
CS(l)
溶液中发生如下的平行反应
(均为二级反应):
设在温度和I2的浓度一定时,C6H5Cl与Cl2在CS2(l)溶液中的起始浓度均为,30min后,有15%的C6H5Cl转变为σ—C6H4Cl2,有25%的C6H5Cl转变为p—C6H4Cl2。
试计算两个速率常数k1和k2。
k1/k2=15%/25%=3/5=
1/–×
–1/=30(k1+k2)
k1+k2={1/(1–––1/}/30=2/45
k2+k2=2/45,k2=
k1×
16、有正、逆反应均为一级的对峙反应,
D-R1R2R3CBr
L-R1R2R3CBr,正、逆
反应的半衰期均为t1/2
若起始时
123
的物质的量为
,试计算在
=10min
D-RRRCBr
10min后,生成L-R1R2R3CBr的量。
t1/2=ln2/k
k1=k-1=ln2/10=
k1a–x
–k-1x
d/d
平衡时
a–xe
=k-1xe
k-1
k1
a–xe
)/
xe
dx/dt=k1(a–x)–k1(a–xe)x/xe={k1(a–x)xe–k1(a–xe)x}/xe
=k1a(xe–x)/xe
xe–x
)=(
k1axe
d/(
)d
xe–x
xe
–k1at
k1(a–xe)=k-1xe,xe=a/2=
ln–x)–=–×
1×
10/=–
ln–x)=––=–
–