合肥市高三第二次质检理综化学试题及答案Word文档格式.docx
《合肥市高三第二次质检理综化学试题及答案Word文档格式.docx》由会员分享,可在线阅读,更多相关《合肥市高三第二次质检理综化学试题及答案Word文档格式.docx(11页珍藏版)》请在冰豆网上搜索。
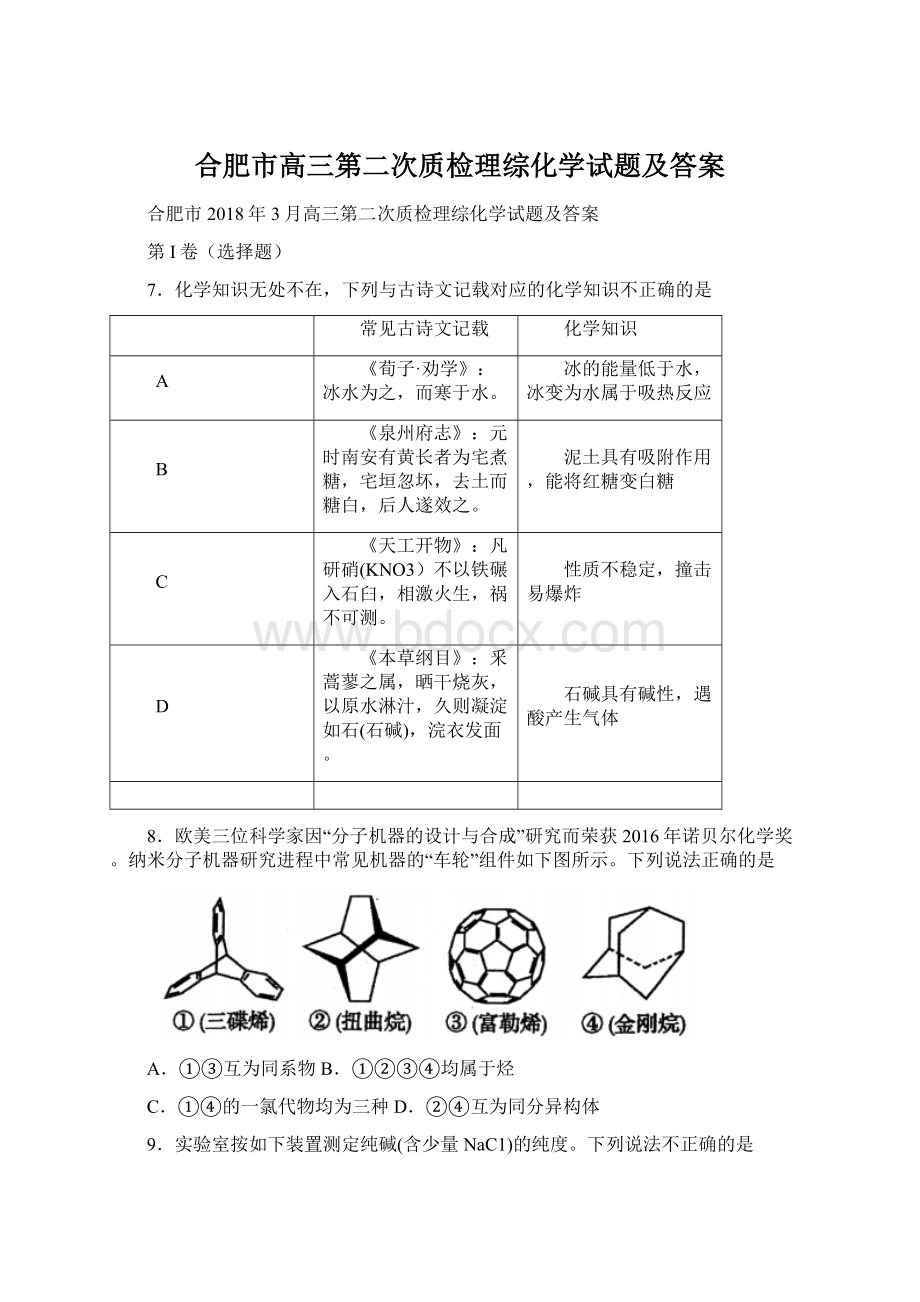
下列说法正确的是
A.①③互为同系物B.①②③④均属于烃
C.①④的一氯代物均为三种D.②④互为同分异构体
9.实验室按如下装置测定纯碱(含少量NaC1)的纯度。
下列说法不正确的是
A.滴入盐酸前,应将装置中含有CO2的空气排尽
B.装置①、④的作用是防止空气中的CO2进入装置③
C.必须在装置②、③间添加盛有饱和NaHCO3溶液的洗气瓶
D.反应结束时,应再通入空气将装置②中CO2转移到装置③中
10.短周期主族元素Ⅹ、Y、Z、W的原子序数依次增大,Ⅹ、W同主族且W原子核电荷数等于X原子核电荷数的2倍,Y、Z原子的核外电子数之和与Ⅹ、W原子的核外电子数之和相等。
下列说法中一定正确的是
A.Ⅹ的原子半径比Y的原子半径大
B.Ⅹ形成的氢化物分子中不含非极性键
C.Z、W的最高价氧化物对应的水化物是酸
D.Y单质与水反应,水可能作氧化剂也可能作还原剂
11.如下图所示,装置(I)是一种可充电电池,装置(Ⅱ)为惰性电极的电解池。
A.闭合开关K时,电极B为负极,且电极反应式为:
2Brˉ-2eˉ=Br2
B.装置(I)放电时,总反应为:
2Na2S2+Br2=Na2S4+2NaBr
C.装置(I)充电时,Na+从左到右通过阳离子交换膜
D.该装置电路中有0.1moleˉ通过时,电极Ⅹ上析出3.2gCu
12.下列实验操作、实验现象和实验结论均正确的是
选项
实验操作
实验现象
实验结论
向一定浓度CuSO4溶液中通入H2S气体
出现黑色沉淀
H2S酸性比H2SO4强
常温下,相同铝片分别投入足量稀、浓硫酸中
浓硫酸中铝片先溶解完
反应物浓度越大,反应速率越大
2mL0.1mol·
L-1MgCl2溶液中滴加2滴1mol·
L-1NaOH溶液,再滴加2滴0.1mol·
L-1FeCl3溶液
先生成白色沉淀,后生成红褐色沉淀
Ksp[Mg(OH)2]>
|Ksp[Fe(OH)3]
向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,振荡后加入几滴有机物Ⅹ溶液,加热
未出现砖红色沉淀
Ⅹ不可能是葡萄糖
13.常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g
的变化如右图所示。
A.稀释相同倍数时:
c(Aˉ)>
c(Bˉ-)
B.水的电离程度:
b=c>
a
C.溶液中离子总物质的量:
b>
c>
D.溶液中离子总浓度:
a>
c
第II卷(非选择题)
26.无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。
实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如下图所示。
已知:
①SnCl2、SnCl4有关物理性质如下表
物质
颜色、状态
熔点/℃
沸点/℃
SnCl2
无色晶体
246
652
SnCl4
无色液体
-33
114
②SnCl4在空气中极易水解生成SnO2·
xH2O。
回答下列问题:
(1)导管a的作用是____________,装置A中发生反应的离子方程式为___________。
(2)当观察到装置F液面上方出现___________现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。
此时继续加热的目的是___________、___________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为___________。
(4)若制得产品中含有少量Cl2,则可采用下列___________(填字母)措施加以除去。
A.加入NaOH萃取分液B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤D.加入饱和食盐水萃取
(5)可用碘量法测定最后产品的纯度,发生如下反应:
Sn2++I2=Sn4++2Iˉ。
准确称取该样品mg放于锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1mol·
L-1碘标准溶液滴定至终点,消耗标准液20.00mL,则产品中SnCl2的含量为___________(用含m的代数式表示);
即使此法测定的操作均正确,但测得的SnCl4含量仍高于实际含量,其原因可能是___________(用离子方程式表示)。
27.二氧化铈(CeO2)是一种重要的稀土化合物。
以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:
i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×
10-6mol·
L-1。
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是__________、__________(写出2种即可)。
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式:
__________。
(3)“萃取”时存在反应:
Ce4++n(HA)2
Ce(H2n-4A2n)+4H+。
D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
)。
保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:
Ce(BF4)3(s)+3K+(aq)
3KBF4(s)+Ce3+(aq)。
若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K=__________(用a、b表示)。
(5)“反萃取”中加H2O2的主要反应离子方程式为__________。
在“反萃取”后所得水层中加入1.0mol·
L-1的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×
10-5mol·
L-1],溶液中c(CO32-)约为__________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。
在尾气消除过程中发生着CeO2
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。
写出CeO2消除CO尾气的化学方程式:
___________。
28.工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
Ⅰ.NOx的消除。
汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:
2NO(g)+2CO(g)
N2(g)+2CO2(g)△H。
(1)已知:
CO燃烧热的△H1=-283.0kJ·
mol-l,
N2(g)+O2(g)
2NO(g)△H2=+180.5kJ·
mol-1,则△H=____________。
(2)某研究小组探究催化剂对CO、NO转化的影响。
将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。
①以下说法正确的是__________________(填字母)。
A.两种催化剂均能降低活化能,但△H不变
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.曲线Ⅱ中催化剂脱氮率比曲线I中的高
②若低于200℃,图中曲线I脱氮率随温度升高而变化不大的主要原因为___________;
判断a点是否为对应温度下的平衡脱氮率,并说明其理由:
____________。
Ⅱ.SO2的综合利用
(3)某研究小组对反应NO2+SO2
SO3+NO△H<
0进行相关实验探究。
在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):
no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。
部分实验结果如右图所示。
①如果将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________________。
②图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:
TC__________TD(填“>
”、“=”或“<
”)。
(4)已知25℃时,NH3·
H2O的Kb=1.8×
10-5,H2SO3的Ka1=1.3×
10-2,Ka2=6.2×
10-8。
若氨水的浓度为2.0mol·
L-1,溶液中的c(OHˉ)=____________mol·
L-1;
将SO2通入该氨水中,当溶液呈中性时溶液中的
=__________。
35.[化学——选修3:
物质结构与性质](15分)
氮(N)、磷(P)、砷(As)等VA族元素化合物在研究和生产中有重要用途。
如我国科研人员研究发现As2O3(或写成As4O6,俗称砒霜)对白血病有明显的治疗作用回答下列问题:
(1)As原子的核外电子排布式为_________________;
P的第一电离能比S大的原因为_______________
(2)写出一种与CNˉ互为等电子体的粒子________(用化学式表示);
(SCN)2分子中σ键和π键个数比为___________
(3)砒霜剧毒,可用石灰消毒生成AsO33-和少量AsO43-,其中AsO33-中As的杂化方式为__________,AsO43-的空间构型为___________
(4)NH4+中H一N一H的键角比NH3中H一N一H的键角大的原因是__________;
NH3和水分子与铜离子形成的化合物中阳离子呈轴向狭长的八面体结构(如下图I),该化合物加热时首先失去水,请从原子结构角度加以分析:
__________
(5)BN的熔点为3000℃,密度为2.25g·
cm-3,其晶胞结构如上图Ⅱ所示,晶体中一个B原子周围距离最近的N原子有__________个;
若原子半径分别为rNpm和rBpm,阿伏加德罗常数值为NA,则BN晶胞中原子的体积占晶胞体积的百分率为__________
36.[化学——选修5:
有机化学基础](15分)
2一氧代环戊羧酸乙酯(K)是常见医药中间体,聚酯G是常见高分子材料,它们的合成路线如下图所示:
①气态链烃A在标准状况下的密度为1.875g·
(1)B的名称为__________;
E的结构简式为__________。
(2)下列有关K的说法正确的是__________。
A.易溶于水,难溶于CCl4
B.分子中五元环上碳原子均处于同一平面
C.能发生水解反应加成反应
D.1molK完全燃烧消耗9.5molO2
(3)⑥的反应类型为__________;
⑦的化学方程式为__________
(4)与F官能团的种类和数目完全相同的同分异构体有__________种(不含立体结构),其中核磁共振氢谱为4组峰,且峰面积之比为1:
2:
3:
4的是__________(写结构简式)。
(5)利用以上合成路线中的相关信息,请写出以乙醇为原料(其他无机试剂任选)制备
的合成路线:
参考答案
题号
7
8
9
10
11
12
13
C
26.使分液漏斗内的液体顺利流下2MnO4-+16H++10C1-=2Mn2++5Cl2↑+8H2O黄绿色气体时加快氯气与锡反应
使SnC14气化,利于从混合物中分离出来SnC14+(x+2)H2O=SnO2·
xH2O+4HClB38/m%4I-+O2+4H+=2I2+2H2O
27.矿石粉碎成细颗粒通入大量空气CeO2+4H++SO42-=[CeSO4]2++2H2O
随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+方向移动,D迅速减小
2Ce4++H2O2=2Ce3++O2↑+2H+1×
10-6mol/L2xCO+CeO2=CeO2(1-x)+2xCO2
28.-746.5kJ/molA、C温度较低时,催化剂的活性偏低不是平衡脱氮率。
因为该反应为放热反应,根据线II可知,a点对温度的平衡脱氮率应该更高降低温度=6.0×
10-32.24
1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3P的p能级是半充满状态,比较稳定,所以第一电离能比硫大CO或N25:
4sp3正四面体NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子与成键电子之间的排斥力强于成键电子与成键电子之间的排斥力,导致NH4+中H-N-H的键角比NH3中大
由于O原子半径小,电负性大,提供孤对电子能力比N原子弱,故水分子形成的配位键弱于氨分子4
1,2-二氯丙烷
C、D取代反应
8
8、这个世界并不是掌握在那些嘲笑者的手中,而恰恰掌握在能够经受得住嘲笑与批忍不断往前走的人手中。
9、障碍与失败,是通往成功最稳靠的踏脚石,肯研究、利用它们,便能从失败中培养出成功。
10、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。