北京市西城区初三化学期末考试题及答案Word文档下载推荐.docx
《北京市西城区初三化学期末考试题及答案Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《北京市西城区初三化学期末考试题及答案Word文档下载推荐.docx(16页珍藏版)》请在冰豆网上搜索。
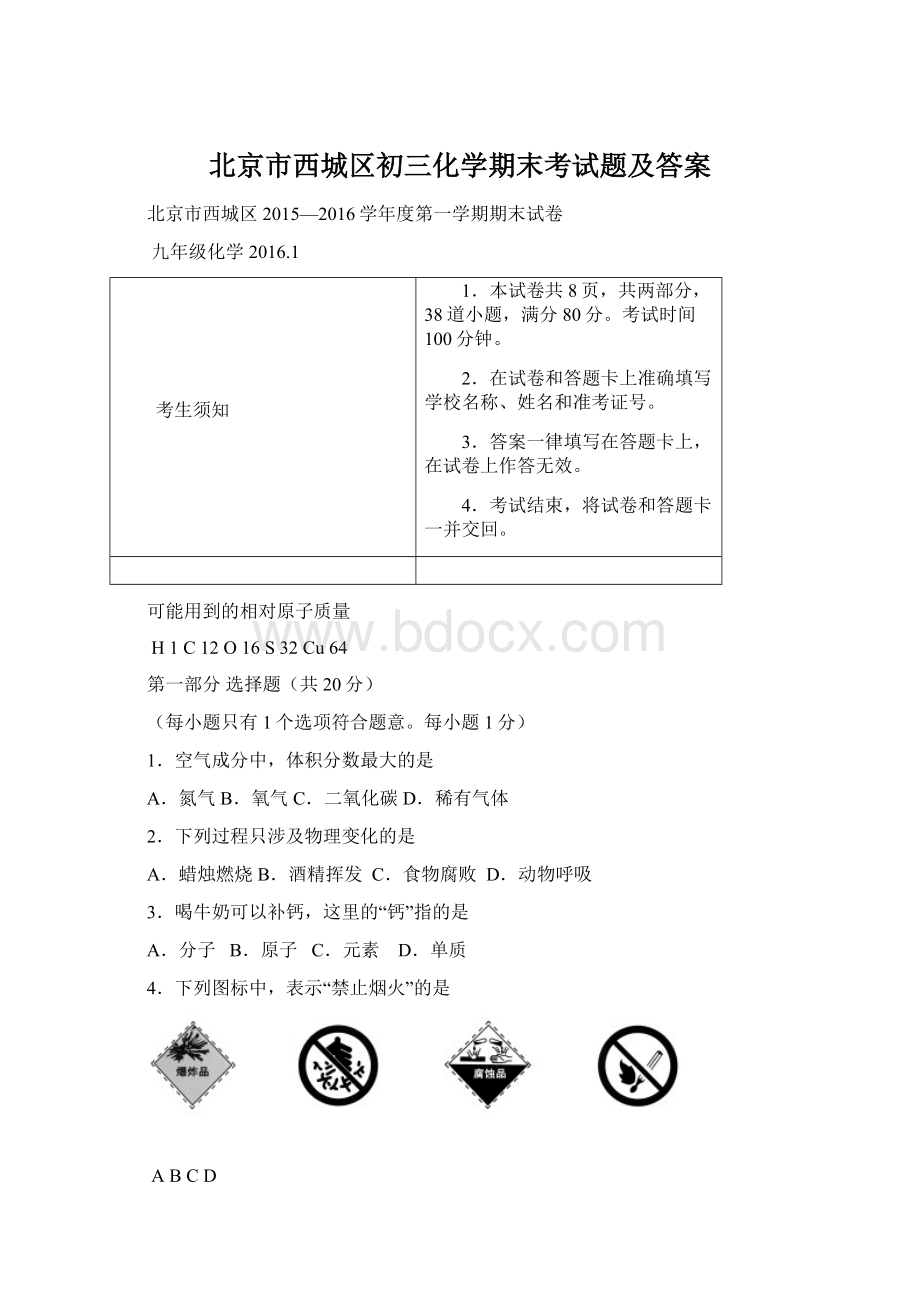
12.下列物质的化学式书写不正确的是
A.氯化钠NaClB.氧化铝Al2O3
C.碳酸钠NaCO3D.氢氧化钾KOH
13.下列物质的用途中,利用其化学性质的是
A.液氮用于冷冻B.天然气用作燃料
C.石墨用作电极D.稀有气体用作电光源
14.下列安全措施不正确的是
A.燃放烟花爆竹时,远离人群和可燃物
B.天然气泄漏,立即关闭阀门并开窗通风
C.正在使用的家用电器着火,立即用水浇灭
D.燃着的酒精灯不慎碰倒,立即用湿布盖灭
15.下列符号中,能表示2个氧分子的是
A.2OB.2O2C.2H2OD.H2O2
16.右图所示装置可用于测定空气中氧气的含量。
下列说法中,不正确的是
A.不能用木炭代替红磷
B.实验时,红磷一定要过量
C.氮气不与红磷反应且难溶于水,是设计该实验的依据之一
D.打开弹簧夹,最终进入集气瓶中水的体积约占集气瓶容积的1/5
17.生产抗疟药“双氢青蒿素”的主要原料是青蒿素。
青蒿素(C15H22O5)是青蒿的提取物,它能溶于酒精、乙醚和石油醚,在水中几乎不溶,其中含有的过氧基团是抗疟作用中最重要的结构。
过氧基团易受湿、热和还原性物质的影响而被破坏。
下列说法不正确的是
A.青蒿素中含有三种元素
B.将青蒿在水中熬煮可提取青蒿素
C.可以用石油醚溶解的方法从青蒿中提取青蒿素
D.制药过程应在低温无水的环境中进行
18.实验小组用右图所示装置进行实验。
打开K,向充满CO2的锥形瓶中加入适量的澄清
石灰水,立即关闭K,振荡,观察现象。
下列有关说法不正确的是
A.澄清石灰水变浑浊
B.长颈漏斗中液面上升
C.装置内气体压强减小,最终与大气压相等
D.该实验说明CO2能与石灰水反应
19.下列操作能达到实验目的的是
选项
实验目的
实验操作
A
除去CO2中的CO
点燃
B
比较黄铜与铜的硬度
将黄铜片和铜片互相刻画
C
分离铁粉与铜粉混合物
加入足量稀硫酸,过滤
D
检验H2中混有的CH4
点燃,在火焰上方罩一个干冷烧杯
Y
20.已知:
C+2CuO2Cu+CO2↑。
右图表示一定量的木炭和氧化铜固体混合物受热过程中,
某变量y随加热时间的变化趋势,其中纵坐标y表示
A.固体的质量B.固体中氧化铜的质量
C.二氧化碳的质量D.固体中铜元素的质量分数
第二部分非选择题(60分)
〖生活现象解释〗
外出旅游是许多人的休闲方式。
请回答21~24题。
21.(3分)出发前购买食品。
(1)食品包装中充入的氮气可以防腐,这利用了氮气的性质是。
(2)雪碧属于“碳酸”饮料。
二氧化碳与水反应的化学方程式是。
(3)右图是某品牌矿泉水的部分标签内容,其中钠离子的符号是。
22.(2分)乘坐汽车。
(1)汽车电路中,常用铜做导线,这利用了铜的延展性和。
(2)车体的主要材料为钢(铁的一种合金),工业上用赤铁矿炼铁的化学方程式是。
23.(3分)到达景区。
(1)景区繁花似锦、鸟语花香。
从分子的角度解释“花香四溢”的原因。
(2)玫瑰花香中含有香茅醇、橙花醇和丁香油酚等物质。
其中丁香油酚(C10H12O2)的相对
分子质量是。
(3)为了维护景区优美的环境,不能随便丢弃垃圾。
下列垃圾应投入可回收垃圾箱的是
(填字母序号)。
A.易拉罐B.果皮C.矿泉水瓶
24.(2分)参观溶洞景观。
【资料卡片】溶洞都分布在石灰岩(主要成分为碳酸钙)组成的山体中,石灰岩遇到溶有二氧化碳的水时,会生成溶解性较大的碳酸氢钙〔Ca(HCO3)2〕。
溶有碳酸氢钙的水遇热或当压强突然变小时,溶解在水里的碳酸氢钙就会分解,重新生成碳酸钙沉积下来,同时放出二氧化碳。
天长日久就会形成形态各异的石笋和钟乳石。
(1)石灰岩属于(填“混合物”或“纯净物”)。
(2)形成碳酸氢钙的原因是(用化学方程式表示)。
25.(2分)空气是我们赖以生存的宝贵资源。
(1)医疗急救时需要用到纯氧,这利用了氧气的性质是。
(2)二氧化碳可用于灭火,这利用了二氧化碳的性质是。
26.(2分)生石灰可与水反应,其化学方程式是。
此反应可用于(填字母序号)。
A.吸收水分B.加热食物
27.(2分)能源与环境已成为人们日益关注的问题。
(1)天然气的主要成分是甲烷,甲烷完全燃烧的化学方程式是。
(2)开发和利用新能源是解决能源问题的重要途径。
目前使用的新能源有(举1例)。
28.(4分)水是一种重要的资源。
(1)地下水多为硬水,生活中降低水硬度的方法
是。
(2)右图为污水处理过程的示意图。
一级处理中,
“格栅”可除去水中大块悬浮物,相当于化学
实验操作中的;
“沉砂池”和“初沉池”
可用来分离污水中的杂质,该杂质是。
(3)请你提出一条防止水污染的措施:
。
〖科普阅读理解〗
29.(4分)阅读下列科普短文。
温室效应,又称“花房效应”,是大气保温效应的俗称。
自工业革命以来,人类向大气中排入的二氧化碳等吸热性强的温室气体逐年增加,大气的温室效应也随之增强。
防止温室效应进一步增强的根本对策是全球参与控制大气中二氧化碳的含量。
为此科学家提出:
制定措施限制过多的二氧化碳的排放;
有效利用过多的二氧化碳。
具体做法有:
将二氧化碳捕获并使之隔离于地下或海底;
将二氧化碳催化转化成有价值的碳资源,研究人员借助氧化铜纳米棒和阳光,将水溶液中的CO2转化成甲醇(CH4O)和氧气,这项技术减少了二氧化碳向空气中的排放,同时获得了燃料。
除二氧化碳外,还有一些气体也可以产生温室效应。
下面是主要温室气体对全球气候变暖的影响程度对照表。
温室气体
空气中浓度mg/m3
年增长率
(%)
温室强度
(CO2为1)
对全球气候变暖
的贡献率(%)
1750年
1990年
CO2
280
353
0.5
1
55
氯氟烃
0.00085
2.2
3400—15000
24
CH4
0.8
1.72
0.9
21
15
N2O
0.00029
0.00031
0.25
270
6
为缓解全球气候变暖,各国采取各种措施控制其他温室气体排放量的增长。
如新西兰从2004年开始征收牛、羊和鹿等的“放屁税”。
某研究发现,袋鼠的屁中不含甲烷,是因为它的胃里有一种特别的细菌。
若把这种细菌移植到能释放大量甲烷的动物体内,可以减少甲烷的排放。
总之,我们要积极采取有效措施,保护好人类赖以生存的大气环境。
依据文章内容,回答下列问题。
(1)甲醇(CH4O)属于(填字母序号,下同)。
A.单质B.氧化物C.化合物
(2)新西兰地区收取“放屁税”,针对的温室气体是。
(3)依据表格中的数据,分析“二氧化碳对全球气候变暖的贡献率最大”的主要原因是。
A.二氧化碳的年增长率大于其他温室气体
B.二氧化碳的浓度远高于其他温室气体
C.二氧化碳的温室强度大于其他温室气体
(4)请你提出一条减少空气中二氧化碳的措施:
〖生产实际分析〗
30.(3分)钛是银白色金属,具有硬度大、熔点高、耐腐蚀等许多优良性能,被誉为“未来金属”。
由钒钛磁铁矿提取金属钛的主要流程如下:
(1)钛铁矿的主要成分是钛酸亚铁(FeTiO3),其中钛的化合价为。
(2)高温时,通过反应II可制得TiCl4和一种可燃性气体,该反应的化学方程式是。
(3)反应III为置换反应,该反应在高温下进行,其化学方程式是。
31.(3分)合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。
合成氨工艺的主要流程如下:
(1)合成塔中的反应在高温、高压、催化剂条件下进行,其化学方程式是。
(2)生产过程中可循环使用的物质是。
(3)根据表中的数据回答问题。
物质
H2
N2
O2
NH3
沸点/℃(1.01×
105Pa)
–252
–195.8
–183
–33.35
在1.01×
105Pa时,欲将NH3与N2、H2分离,适宜的方法是。
〖物质组成和变化分析〗
32.(4分)甲、乙、丙、丁4种气体,由氢、碳、氧3种元素中的1~2种组成。
(1)甲是最清洁的燃料。
甲是。
(2)乙和丙均为氧化物,在一定条件下可以相互转化,它们相互转化的化学方程式是、。
(3)在一定条件下,丁与氧气反应生成乙和水,参加反应的丁、氧气和生成水的质量比为13︰40︰9。
则丁中各元素的质量比是。
〖基本实验〗
33.(6分)根据下图回答问题。
(1)仪器a的名称是。
(2)实验室制取二氧化碳的化学方程式是。
(3)实验室用高锰酸钾制取氧气的化学方程式是,所选用的发生装置是(填字母序号,下同),收集装置是或E。
在加入药品前,应进行的操作是。
34.(4分)“铁丝在氧气中燃烧”的装置如右图所示,回答表格中的问题。
实验步骤
(1)预先在集气瓶中放入少量水,其作用是。
(2)待火柴快燃尽时,再将铁丝伸入盛有氧气的集气瓶中。
“火柴快要燃尽时再伸入集气瓶中”的目的是。
实验现象
铁丝剧烈燃烧,,放出大量热,生成一种黑色固体。
实验结论
该反应的化学方程式是。
35.(3分)通过电解水实验可以研究水的组成。
(1)电解水的装置如右图所示,该反应的化学方程式是。
检验a管中气体的操作:
先,再打开活塞。
(2)电解水的微观示意图如下,请在方框中补全相应微粒的图示。
+
〖实验原理分析〗
36.(4分)利用下图装置进行实验。
实验装置
实验过程
【实验1】探究可燃物燃烧的条件
①在A、B中各放一小块白磷(着火点为40℃),A中加入约1/3试管的80℃水,A、B中白磷均不燃烧;
②从a处通入O2使A中热水恰好完全进入B中,A中白磷燃烧,B中白磷不燃烧;
③,B中白磷燃烧。
【实验2】探究MnO2在H2O2分解中的作用
①A中加入约1/3试管的H2O2溶液,B中放入一面粘有MnO2的玻璃片,A、B中均无明显现象;
②从c处抽气,使A中液体进入B中,观察到玻璃片上粘有MnO2的一面产生大量气泡,另一面无明显变化。
回答下列问题:
(1)实验1:
步骤③中的操作是。
能说明“可燃物燃烧需要温度达到着火点”的实验现象是。
(2)实验2:
B中反应的化学方程式是。
该实验能否得
“MnO2是H2O2分解的催化剂”的结论?
你的判断及理由是。
〖科学探究〗
37.(5分)化学兴趣小组同学对“铁生锈的条件”进行实验探究。
【进行实验】
实验
AB
一段时间后,
A中铁丝表面有红色固体生成
B中铁丝无明显变化
2
CD
C中
D中铁丝无明显变化
铁生锈需要与O2接触
某同学在家中发现,炒完菜的铁锅表面容易生锈。
【猜想与假设】可能是食盐对铁生锈的速率产生了影响。
【进行实验】该小组用实验装置E、F同时进行实验。
其中集气瓶的容积相同,量筒内盛有等体积的水,F中集气瓶内另加入了某种物质。
EF
一段时间后,打开止水夹,记录实验过程中量筒内剩余水的体积(每次测量时间间隔不等,实验数据见下表)。
E中铁丝和F中另加入的物质表面均出现红色物质。
食盐可以加速铁的生锈
实验记录表
次数
3
4
5
量筒中剩余水的体积/mL
E
68
57
44
30
F
71
65
56
a
(1)实验装置F中,集气瓶内另加入的物质是。
(2)实验记录表中,a的取值范围是。
【反思与应用】结合上述实验,谈谈你对家中铁锅使用的建议:
〖实际应用定量分析〗
38.(4分)秸秆是一种相对清洁的可再生能源,平均含硫量只有0.38%,而煤的平均含硫量为1%。
某地燃烧秸秆的发电厂一年燃烧秸秆约2.0×
105t,相当于燃烧1.0×
105t煤。
假设燃料中硫元素经燃烧后都转化为SO2,试计算该发电厂燃烧秸秆比燃烧煤每年少排放多少SO2?
九年级化学参考答案及评分标准2016.1
第一部分选择题
题号
l
7
8
9
10
答案
1l
12
13
14
16
17
18
19
20
说明:
以下每空1分,其他合理答案均给分。
第二部分非选择题
〖生活现象解释〗
21.(3分)
(1)化学性质稳定
(2)CO2+H2OH2CO3(3)Na+
22.(2分)
(1)导电性
(2)3CO+Fe2O33CO2+2Fe
23.(3分)
(1)分子不断运动
(2)164(3)AC
24.(2分)
(1)混合物
(2)CO2+H2O+CaCO3Ca(HCO3)2
25.(2分)
(1)O2能供给呼吸
(2)一般情况下,不可燃,也不支持燃烧;
密度大于空气
26.(2分)CaO+H2OCa(OH)2AB
27.(2分)
(1)CH4+2O2CO2+2H2O
(2)太阳能等
28.(4分)
(1)煮沸
(2)过滤砂粒(3)不使用含磷洗衣粉等
29.(4分)
(1)C
(2)甲烷(3)B(4)减少使用化石燃料等
30.(3分)
(1)+4
(2)TiO2+2Cl2+2CTiCl4+2CO
(3)TiCl4+2MgTi+2MgCl2
31.(3分)
(1)N2+3H22NH3
(2)N2、H2
(3)控制温度:
–33.35℃>
温度>
–195.8℃
32.(4分)
(1)氢气
(2)2CO+O22CO2CO2+C2CO
(3)m(C)︰m(H)=12︰1
〖基本实验〗
33.(6分)
(1)试管
(2)CaCO3+2HClCaCl2+H2O+CO2↑
(3)2KMnO4K2MnO4+MnO2+O2↑AC检查装置气密性
34.(4分)实验步骤:
(1)防止高温物质溅落使集气瓶炸裂
(2)防止火柴燃烧消耗瓶中的O2
实验现象:
火星四射实验结论:
3Fe+2O2Fe3O4
35.(3分)
(1)2H2O2H2↑+O2↑用带火星的木条接近a管尖嘴部分
(2)
36.(4分)
(1)从a(或c)通入O2步骤①B中白磷不燃烧,步骤③B中白磷燃烧
(2)2H2O22H2O+O2↑
不能,因为没有证明MnO2在反应前后的质量和化学性质都不发生改变
37.(5分)
铁生锈需要与水接触
银白色铁丝表面出现红色物质,试管内液面上升
(1)蘸有水的铁丝
(2)30≤a<
56
【反思与应用】用完后要及时洗净擦干
---------1分
38.(4分)秸秆中硫元素的质量=2.0×
105t×
0.38%=760t
煤中硫元素的质量=1.0×
1%=1000t
设秸秆中760t硫元素转化为二氧化硫的质量为x
S+O2SO2
3264
760tx
x=1520t
设煤中1000t硫元素转化为二氧化硫的质量为y
1000ty
y=2000t
该发电厂燃烧秸秆比燃烧煤每年少排放SO2的质量为2000t-1520t=480t
答:
该发电厂燃烧秸秆比燃烧煤每年少排放SO2的质量为480t。