探究实例Word下载.docx
《探究实例Word下载.docx》由会员分享,可在线阅读,更多相关《探究实例Word下载.docx(14页珍藏版)》请在冰豆网上搜索。
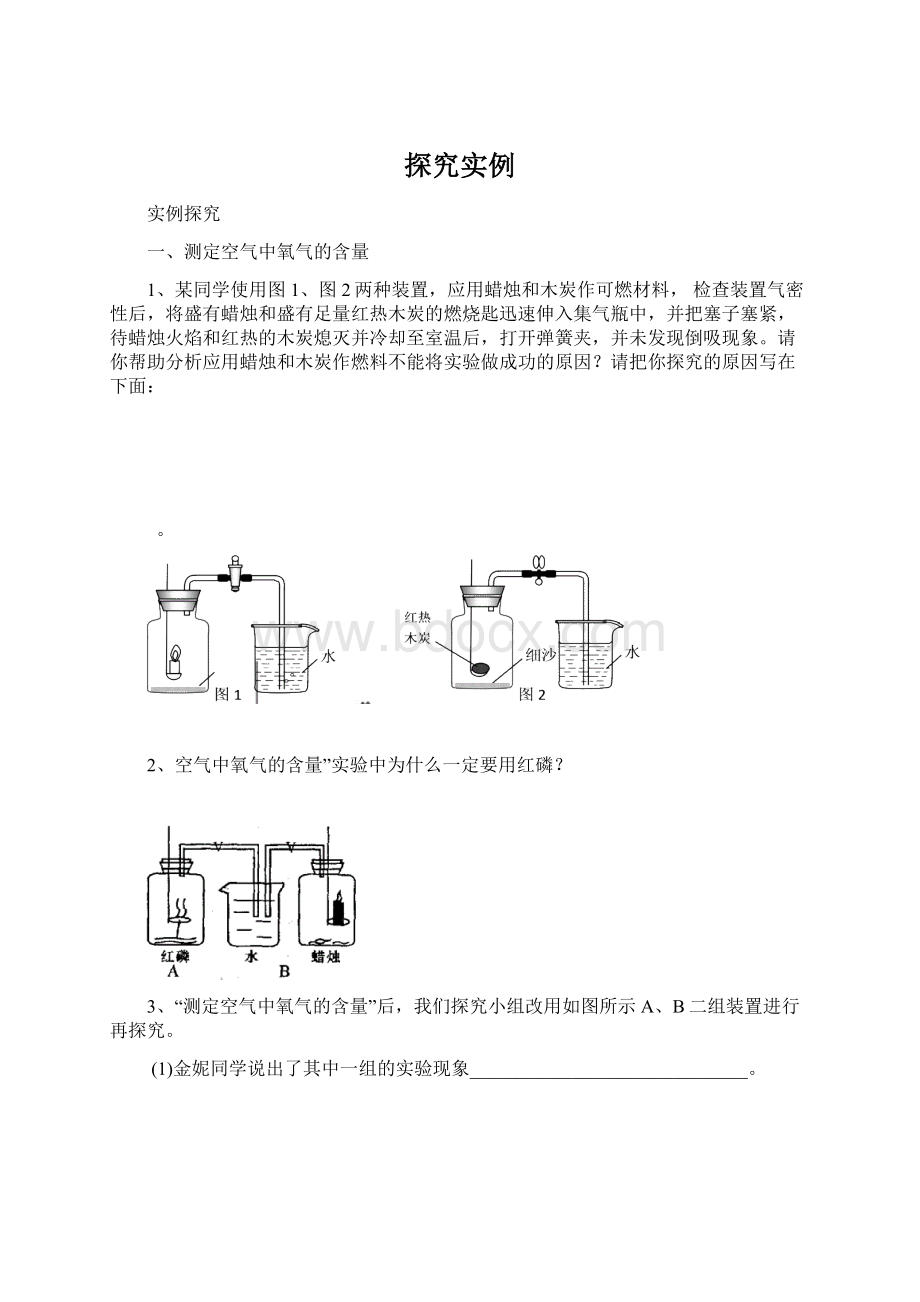
5、右图是测定空气中氧气含量的实验装置,请根据实验回答问题:
(1)可观察到的主要实验现象是什么?
(2)燃烧结束后,钟罩内剩余的气体主要是氮气,请结合本实验推测氮气的物理性质和化学性质。
6、某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如下图所示的实验装置。
实验步骤如下:
①如图所示,连接仪器,检查装置的气密性。
发现
装置的气密性良好。
②在集气瓶里装进适量a体积的水,燃烧匙里放
一块白磷(其着火点是40℃),并在酒精灯上把玻璃
棒下端加热,按图示装置把集气瓶中的空气密封起来,
把长导管的另一端放入盛有足量水的烧杯中。
(注:
集气瓶内的长导管已伸到了瓶底)
③用力把预先加热过的玻璃棒按下与白磷接触,观察到白磷立即着火燃烧,产生大量白烟,同时放出大量的热。
白磷与红磷燃烧的产物相同)
④待白磷燃烧熄灭后,稍加振荡,白烟消失。
⑤待集气瓶完全冷却至室温,量出集气瓶中水的体积是b,整个集气瓶的体积是c。
⑥根据a、b、c三个数据,计算出空气中氧气的体积分数。
根据以上信息,回答下列问题。
(1)在白磷开始燃烧到最后熄灭的过程中,集气瓶内水面的变化情况是___________
________________________。
(2)若实验非常成功,请写出a、b、c三个数据应满足的一个等式关系式:
___________
(3)组内成员小葛为了证明实验完成后的集气瓶内是否还有氧气剩余,他没有利用其它的仪器和药品,仍是利用了上述实验涉及的仪器和药品,设计了一个实验,最后得出了瓶内一定没有氧气剩余的结论。
你知道他是如何实验的吗?
写出简要的实验步骤和实验现象。
实验步骤
实验现象
(4)组内成员小张对“实验前集气瓶里要装进适量a体积的水”非常不理解。
咨询了组长小明之后,他终于明白“a体积的水”的作用,其一是为了加快⑤步骤中集气瓶的冷却速度;
其二则主要是_________________________________________________________。
(5)组内成员小杭性格好动,无意间他发现向⑤步骤集气瓶内的水中滴加几滴紫色石蕊试液,水会变红。
这一现象使组内成员积极地展开了讨论,成员小葛是由于二氧化碳溶于水,使溶液显酸性而导致的,但小明马上作出反对,原因是空气中二氧化碳的含量极少,而实验过程中又没有产生二氧化碳,短时间内不可能会使溶液显酸性。
你认为谁的观点正确?
________。
若你认为小明的观点正确,那么请你对“变红”现象提出大胆地猜想:
____________________________________。
(若你认为小葛的观点正确,此空不填)
(6)在上述实验中,下列操作的实施和实验现象的出现,会导致实验最后产生的实际值大于理论值的是()
A.装置气密性不好B.实验前集气瓶里没有装a体积的水
C.集气瓶没有冷却到室温D.用红磷代替白磷(红磷的着火点在240℃左右)
7、通过红磷燃烧测定空气中氧气约占空气总体积的分数时,为什么有时气体减少的体积小于1/5呢?
有时气体减少的体积大于1/5,导致结果偏低的原因可能有?
8、将足量的下列物质分别放在燃烧匙上点燃(或灼烧),分别放入四只图中所示装置的广口瓶中,立即塞紧橡皮塞,反应结束待冷却后,打开止水夹,导管中水柱上升最少的是放入哪种物质的装置?
()
A.铁粉B.磷
C.木炭D.镁
9、某校化学兴趣小组就空气中氧气的含量进行实验探究:
[集体讨论]:
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体。
他们应该选择()
A.蜡烛B.红磷C.硫粉
为了充分消耗容器中的氧气,药品的用量应保证。
(2)小组同学共同设计了如图的两套装置,你认为合理的是(填编号)。
为了确保实验的成功,在装药品之前应该。
[分组实验]在讨论的基础上,他们分组进行了实验。
[数据分析]实验结束后,整理数据如下:
集气瓶容积为100mL)
组别
1
2
3
4
5
6
进入集气瓶中水的体积(mL)
20
21
19
22
18
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的。
通过实验还可以推断集气瓶中剩余气体的性质是。
[实验拓展]
(4)小组的同学做完实验后又尝试用木炭重新做了以上实验,发现水几乎没有进入集气瓶。
经讨论,同学们一致认为如果事先在集气瓶内注入少量溶液来吸收气体,实验也能取得较好的效果。
(5)某同学对实验进行反思后,提出了改进方法
(图中所示),你认为改进后的优点是:
10、为测定空气中氧气所占的体积分数,某同学设计了如图所示的实验,在一个耐热活塞的底部放一小块(足量)白磷(白磷在空气中燃烧的温度为40℃),然后迅速将活塞下压,可以观察到的现象为;
冷却至原来温度时,松开手,活塞最终将回到刻度处,试回答白磷燃烧的原因。
11、某同学用右图所示的装置粗略地测定空气中氧气的体积分数,图中烧杯上方玻璃管(预先固定好)中部有一可左右滑动的活塞,活塞左端管内密封有空气,活塞右端的玻璃管口跟空气连通,实验开始前活塞处在刻度5cm处。
已知生石灰与水反应能产生大量的热;
可燃物燃烧必须同时具备二个条件,一是有一定的温度;
二是有充足的氧气。
⑴向烧杯内加入适量水,与生石灰反应的目的是。
⑵可观察到玻璃管内开始发生的现象:
白磷(足量),活塞向(填“左”或“右”)移动。
⑶实验结束,恢复到常温后,活塞应停在约cm处,据此可得出的结论是:
12、为粗略测量空气中O2与N2的体积比,某学生设计了下图所示的实验装置进行实验。
实验时,先关闭弹簧夹a,将螺旋状的铜丝在酒精灯的灼烧后迅速插入大试管,接触试管底部的过量的白磷,然后立即塞紧橡皮塞。
由于白磷的着火点比红磷低得多,因此反应很容易发生,可观察到大试管中产生大量的白烟。
试回答以下问题:
(1)待试管冷却后打开弹簧夹,此时可观察到的现象为,据此可证实空气中O2与N2的体积比大约为。
(2)如果装置气密性不好,则测出的O2与N2的体积比将。
(填“偏大”、“偏小”、或“不变”)。
13、某同学用如图所示装置测定空气中氧气的含量,实验后发现所测定氧气的体积分数低于1/5。
针对这一事实,你认为下列做法或想法不准确的是()
A、查看实验装置是否漏气
B、将红磷改为蜡烛再重做实验
C、实验中红磷的量可能不足,没有将瓶内的氧气消耗完全
D、反应后未冷却至室温就打开水夹,使瓶内的水的体积减少
14、某研究性学习小组设计了如下图所示的装置,探究空气中氧气的体积分数,其中A是底面积为50cm2、高20cm的圆筒状玻璃容器(带密封盖),上面标有以cm为单位的刻度,B是带刻度的敞口玻璃管(其他辅助装置略)。
他们的操作过程如下:
a.检查装置的气密性;
b.加入水并调整B的高度,使A中的液面至刻度15cm处;
c.将过量的铜粉平铺在惰性电热板上,盖紧密封盖;
d.通电加热铜粉,待充分反应后,冷却到原来的状况,调整B的高度使容器A、B中的液面保持水平,记录液面刻度。
A容器内固态物质所占的体积忽略不计)
(1)在操作a中检查装置气密性的方法是。
(2)在上述实验中,下列物质不能代替铜粉的是(填字母)。
A.红磷B.木炭C.铁粉
(3)在操作d结束时,装置A中液面的刻度约为cm(填整数)。
如果在操作d结束时,装置A中液面刻度在11cm处,则实验结果比理论值(填“偏大”或“偏小”)。
(4)该小组中有同学提出,用木炭代替铜粉也能测定空气中氧气的体积分数,只要将水换成一种溶液,则该溶液是。
15、为测定空气中氧气的含量,小华同学打算设计如下方案:
选用实际容积为40mL的试管作反应容器,将过量的白磷放入试管,用橡皮
塞塞紧试管口,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成如右图的实验装置。
假设此实验能按照小华的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答
下列问题:
(1)实验前,打开弹簧夹,将注射器的活塞前沿从20mL刻度处推至15mL刻度处,然后松手,若活塞仍能返回至20mL刻度处,则说明____________________。
(2)若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹。
可观察到的现象为
_______________________________________________。
(3)若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却。
可观察到的现象为________
(4)若按小华的设想进行实验,实际可能遇到诸多问题而发生危险,造成实验失败。
例如
______________________________________________________________________。
16、某班同学用右图装置测定空气里氧气的含量。
先用弹簧夹夹住乳胶管。
点燃红磷伸
入瓶中并塞上瓶塞。
待红磷熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况。
实验完毕,甲同学的广口瓶内水面上升明显小于瓶内空气体积的1/5,乙同学的广口瓶内水面上升显
大于瓶内空气体积的1/5。
下列对这两种现象解释合理的是(
)
①甲同学可能使用的红磷量不足,瓶内氧气没有消耗完
②甲同学可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内
③乙同学可能没夹紧弹簧夹,红磷燃烧时瓶内空气受热从导管逸出
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内空气受热逸出
A.只有①③
B.只有②④
C.只有①②③
D.①②③④
二、二、有关NaOH化学性质的探究题
1. 实验探究:
氢氧化钠溶液中哪一种粒子(H2O、Na+、OH-)能使指示剂无色酚酞试液变红。
实验步骤:
①
在第一支试管中加入约2mL蒸馏水,滴入几滴无色酚酞试液,观察现象;
②
在第二支试管中加入约2mLNaCl(pH=7)溶液,滴入几滴无色酚酞试液,观察现象;
③
在第三支试管中加入约2mLNaOH溶液,滴入几滴无色酚酞试液,观察现象。
通过上述实验的探究回答下列问题(下述“现象”是指无色酚酞是否变红):
(1)实验①看到的现象是
;
你得出的结论是
。
(2)实验②看到的现象是
;
说明钠离子
。
(3)实验③看到的现象是
2.环境问题是人类可持续发展必须解决的一个重要问题,温室效应被列为21世纪人类面临的最大威胁之一,已引起人们的广泛关注。
旨在限制发达国家温室气体排放量、抑制全球范围内气候持续变暖的《京都议定书》,已于2005年2月16日正式生效。
(1).二氧化碳是大气中的主要温室气体,我国二氧化碳的排放量位居世界第二,为减少二氧化碳这种温室气体的排放,我们可以采取的措施有(只填2种):
(2).为减缓二氧化碳使全球变暖的趋势,有科学家提出大胆设想:
将排放到空气中的二氧化碳压缩使其液化,然后将其压入到冰冷的深海中。
但也有科学家担心海水中富含二氧化碳后酸度会增加,可能会杀死一些海洋生物,甚至会溶解掉部分海床,同时气候变化也可能改变海洋环流,把海底的二氧化碳又带回海面,另外把二氧化碳压入海底所消耗的能源可能会再增加二氧化碳的排放。
⑴二氧化碳气体转变为液体时将会能量(填“释放”或“消耗”);
⑵二氧化碳使海水酸度增加的原理用化学方程式表示为:
;
⑶二氧化碳在深海中的溶解度比在通常状况下的水中的溶解度,原因是
(3).常温常压下1体积水约溶解1体积二氧化碳气体,氢氧化钠溶液与二氧化碳反应时没有明显的现象变化。
某研究小组设计了下列实验装置(所有装置的气密性良好),试图通过观察现象来间接证明二氧化碳与氢氧化钠发生了反应。
⑴请根据上图实验装置和下表的操作方法,将可能观察到的实验现象填入下表中:
所选
装置
操作方法
A
将充满二氧化碳的试管倒扣在水中
试管内的液面略有上升
B
将充满二氧化碳的试管倒扣在氢氧化钠溶液中
C
将氢氧化钠溶液滴入烧瓶
D
将氢氧化钠溶液滴入锥形瓶
E
将胶头滴管中氢氧化钠溶液挤入烧瓶
⑵若再分别向A、B装置的烧杯中滴入少量氯化钙溶液,将会看到的现象是:
A:
B:
(4).二氧化碳在化学家的眼里是可以利用的重要资源,只要有合适的条件,可以像发生光合作用那样将二氧化碳转变为所需要的产物。
二氧化碳可以为化工合成提供足够的碳元素,既可以减少化工产业对煤和石油的消耗,又可以缓解大气中二氧化碳含量的增加。
⑴二氧化碳和水通过光合作用转变为葡萄糖和氧气的化学方程式为:
⑵化肥厂用二氧化碳与氨气在一定条件下反应生成尿素[CO(NH2)2]和水的化学方程式为:
(5).我国科学家陈乾旺等最新研究成果表明,在440℃和800大气压条件下,二氧化碳和金属钠反应产生金刚石和碳酸钠,合成的金刚石最大达1.2mm,完全可以满足工业用途。
⑴二氧化碳与金属钠反应生成金刚石和碳酸钠的化学方程式为:
⑵请从人类生存的角度分析,金刚石与水相比谁更宝贵?
,
理由是:
3.研究性学习小组中的小张同学在学习中发现:
通常检验CO2用饱和石灰水,吸收CO2用浓NaOH溶液。
【实验探究】在体积相同盛满CO2的两集气瓶中,
分别加入等体积的饱和石灰水和浓NaOH溶液。
甲
乙
实验装置和现象如图所示。
请你一起参与。
【现象结论】甲装置中产生的实验现象(用化学方
程式表示) ,解释通常用石灰水而不用NaOH溶
液检验CO2的原因;
乙装置中的实验现象是 ,吸收CO2较多的装置是。
【计算验证】另一位同学小李通过计算发现,等质量的Ca(OH)2和NaOH吸收CO2的质量,Ca(OH)2大于NaOH。
因此,他认为通常吸收CO2应该用饱和石灰水。
【思考评价】请你对小李同学的结论进行评价:
4.做中和反应实验时,我将稀盐酸滴入氢氧化钠溶液中,意外看到有气泡产生。
小伟提醒我:
是不是拿错了药品?
我查验后确认药品没错,只是在瓶口发现了有白色粉末状物质。
我认为是氢氧化钠溶液变质了。
做了一下探究活动:
(1)
氢氧化钠溶液变质的原因是
(2)
设计实验确认氢氧化钠溶液已变质
实验结论
(3)我想知道该氢氧化钠溶液是部分变质还是全部变质?
小伟设计了如下实验,请帮我们完成
该氢氧化钠溶液
变质。
写出第三步中涉及到的一个化学方程式
(4)如何用该变质的氢氧化钠溶液来制取氢氧化钠溶液?
简述实验步骤。
学课上,在氢氧化钠溶液与稀硫酸能否发生反应的实验中,小宇同学发现向氢氧化钠溶液中滴加几滴酚酞试液,溶液变红色,当向该溶液中连续滴加稀硫酸,溶液红色又褪去。
(1)根据实验现象,你认为氢氧化钠溶液与稀硫酸(填“能”或“不能”)发生化学反应,理由是有。
(2)针对上述实验,你还想探究的问题是有。
5.小明家购买了一瓶白醋,标签上注明醋酸的质量分数≥5%。
小明想,这瓶白醋中醋酸的含量是否与标签的标注相符?
请你与小明一起,用有关酸碱的知识,定量测定白醋中醋酸的含量。
【实验原理】
(1)用已知浓度的氢氧化钠溶液和醋酸反应,反应的化学方程式为:
CH3COOH+NaOH=CH3COONa+H2O。
(2)在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加1滴氢氧化钠溶液,溶液就呈碱性,而1滴氢氧化钠溶液约为0.05mL,对测定结果的影响很小,可忽略不计。
【实验步骤】
用取12.0mL白醋(密度近似为1.0g/mL),倒入烧杯中,再加入20mL蒸馏水稀释。
②量取45.0mL溶质质量分数为1.0%的氢氧化钠溶液(密度近似为1.0g/mL),用胶头滴管取该氢氧化钠溶液,逐滴地滴加到稀释后的白醋中,同时不断地搅拌烧杯中的溶液。
滴至恰好完全反应,剩余氢氧化钠溶液5.0mL。
【交流反思】
(1)在实验步骤
中,加适量水稀释白醋,对实验结果有无影响?
(2)在实验步骤
中,小明如何确定醋酸和氢氧化钠已完全中和?
三、图形图片也可以探究:
如对溶解度曲线的探究