第四章试题2Word文件下载.docx
《第四章试题2Word文件下载.docx》由会员分享,可在线阅读,更多相关《第四章试题2Word文件下载.docx(16页珍藏版)》请在冰豆网上搜索。
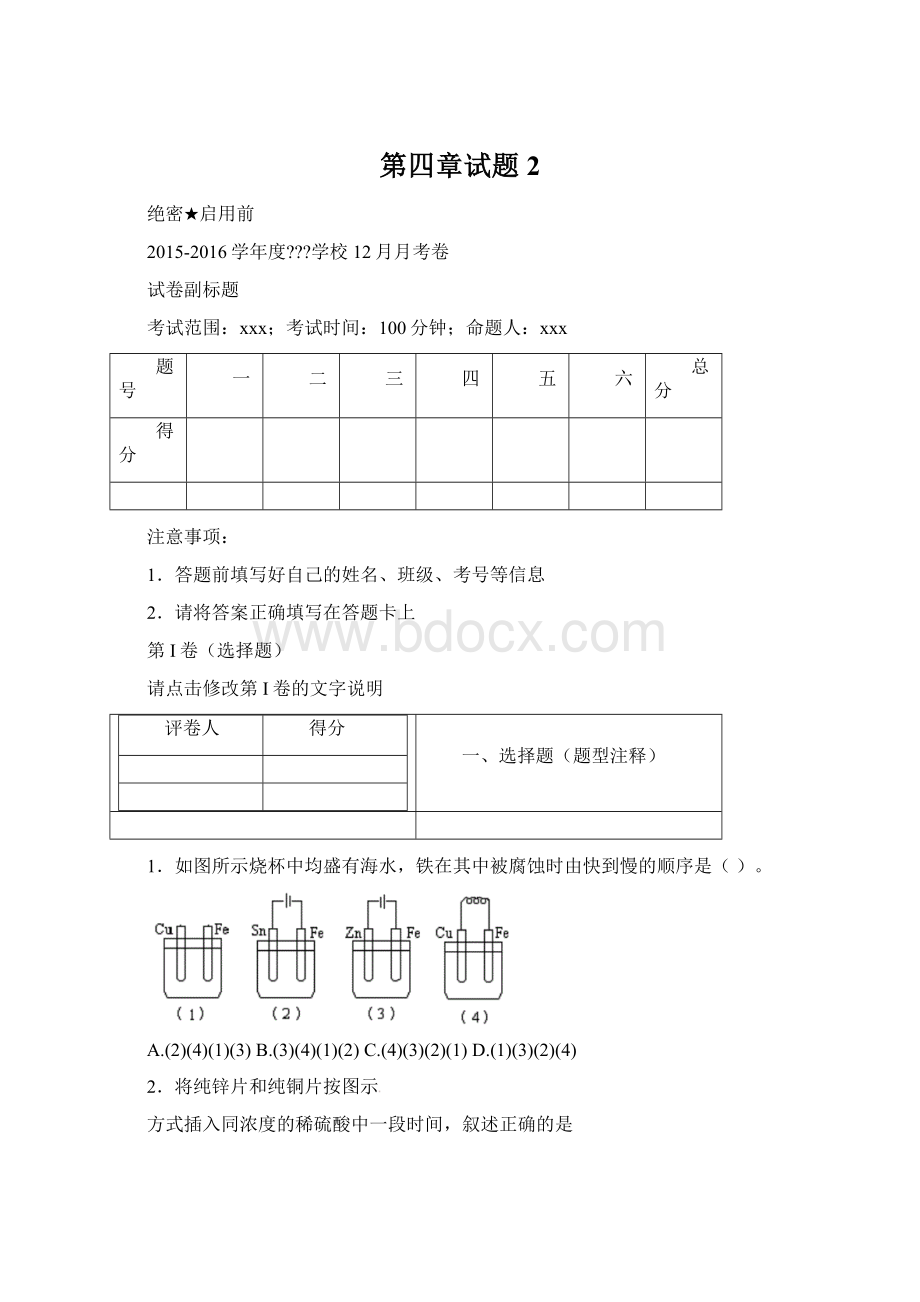
3.下列有关铜锌原电池(下图)的叙述正确的是
A.正极反应为Zn-2e-===Zn2+B.取下盐桥,原电池仍可工作
C.在外电路中,电子从正极流向负极D.电池反应为Zn+Cu2+===Zn2++Cu
4.用惰性电极电解未精制的饱和食盐水(其中含有Ca2+、Mg2+、
),食盐水装在U形管中,结果很快在某一电极附近出现食盐水浑浊的现象。
造成浑浊的难溶物主要是…()
A.碳酸钙和碳酸镁B.氢氧化镁
C.碳酸钙D.碳酸钙和氢氧化镁
5.钢铁发生吸氧腐蚀时,正极上发生的电极反应是()
A.2H++2e-===H2B.Fe2++2e-===Fe
C.2H2O+O2+4e-===4OH-D.Fe3++e-===Fe2+
6.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。
下列有关氢氧燃料电池的说法正确的是
A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:
7.下列有关说法正确的是()
A.测定反应的中和热时,所用的酸和碱是恰好完全反应,并测量其最高温度。
B.碱性锂电池的比能量比铅蓄电池的大,能量密度高,质量轻体积小,储存时间长。
C.镀锌铁皮表面破损后,铁皮的腐蚀速度会加快。
D.工业上常用铁作阴极电解饱和NaCl溶液来制纯碱、氢气、氯气。
8.用惰性电极电解某无色溶液时,有如下实验现象:
阳极上有无色气体产生;
阴极附近有白色沉淀生成。
则原溶液中可能大量共存的离子组是
A.Na+、Ba2+、NO3-、Cl-B.H+、Mg2+、Na+、SO42-
C.CO32-、K+、Cl-、Na+D.Fe2+、NO3-、SO42-、Na+
9.若某池(电解池或原电池)的总反应离子方程式是Cu+2H+===Cu2++H2↑,关于此池的有关说法正确的是
A.该池只能是电解池,且金属铜为该电解池的阳极
B.该池只能是原电池,且电解质溶液为硝酸
C.该池可能是原电池,也可能是电解池
D.该池只能是电解池,电解质溶液可以是硫酸铜
10.甲、乙两个电解池均以Pt为电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.24g金属,则乙池中溶质可能是()
A.KNO3B.CuSO4C.MgSO4D.Na2SO4
11.如下图所示装置中,观察到电流计指针偏转;
M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是(
)
M
N
P
A
锌
铜
稀硫酸溶液
B
铁
稀盐酸
C
银
硝酸银溶液
D
硝酸铁溶液
12.以石墨做电极,电解1mol/L下列物质的水溶液,下列表述正确的是
A.若为盐酸,pH减小B.若为氢氧化钠溶液,pH减小
C.若为硫酸钠溶液,pH不变D.若为氯化钠溶液,pH不变
13.用石墨作电极电解200mLCuSO4溶液,电解过程中电子转移的物质的量n(e-)与产生气体的体积V(g)(标准状况)的关系如图所示,下列说法正确的是( )
A.电解前CuSO4溶液的物质的量浓度为2mol/L
B.电解后所得溶液中c(H+)=2mol/L
C.当n(e-)=0.6mol时,V(H2):
V(O2)=2:
3
D.向电解后的溶液中加入16gCuO,则溶液可恢复为电解前的浓度
14.如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L。
下列说法正确的是
A.电源N极为正极
B.D、E两极都发生氧化反应
C.F极是以粗铜板为材料作阴极
D.B池中E极质量增加12.8g
15.化学镀铜废液中含有一定量的CuSO4,任意排放会污染环境,利用电化学原理可对废液进行回收处理,装置如图,其中质子交换膜只允许H+通过。
已知:
①Cu2++HCHO+3OH-=Cu+HCOO-+2H2O;
②还原性:
HCHO>
M(—种金属)>
Cu。
A.反应之前,应将含OH-的HCHO溶液加人到装置的左侧
B.右侧发生的电极反应式:
HCHO-2e-+H2O=HCOO-+3H+
C.若将质子交换膜换成阴离子交换膜,放电过程中,大量的OH-将向左侧迁移
D.放电一段时间后打开开关,移去质子交换膜,装置中可能会有红色固体、蓝色絮状物出现
16.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。
高铁电池的总反应为:
3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH。
下列叙述不正确的是
A.放电时负极反应为:
3Zn-6e-+6OH-====3Zn(OH)2
B.充电时阳极反应为:
Fe(OH)3-3e-+5OH-
FeO42-+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被还原
D.充电时阴极溶液的碱性减弱
第II卷(非选择题)
请点击修改第II卷的文字说明
二、填空题(题型注释)
17.用化学式简要表示下面的反应,并在括号里指出基本反应类型(化合反应或分解反应):
(1)磷在空气中燃烧:
(2)铁丝在氧气中燃烧:
(3)电解水:
.
18.(12分)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。
某研究小组将两个甲烷燃料电池串联后作为电源,进行氯化铜溶液电解实验,如图所示:
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为、。
(2)闭合K开关后,b电极的名称是,电解氯化铜溶液的化学方程式为。
(3)若电解池中b电极增重3.2g,则理论上a电极产生的气体体积为L(标准状况),通过电解池的电子的物质的量为mol。
19.(8分)切过咸菜的钢刀未及时清洗,第二天刀上便出现锈斑,试用有关电极反应式、化学方程式表示Fe(OH)3的生成过程。
(1)负极______________________;
正极______________________。
(2)化学方程式;
。
20.科研、生产中常涉及铁及其化合物
(1)实验室配制FeSO4溶液时,常向溶液中加入的物质有__________________。
(2)高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾(K2FeO4)是一种理想的水处理剂,处理水时所起的作用是________________________。
(3)高铁电池是一种新型可充电、能长时间保持稳定放电电压的电池。
该电池总反应式为3Zn(OH)2+2Fe(OH)3+4KOH
3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
(4)高炉炼铁过程中发生下列反应:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)ΔH=-47.2kJ/mol
③3Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)ΔH=+640.4kJ/mol
请你写出用CO还原FeO固体制得Fe和CO2的热化学方程式:
________________。
三、实验题(题型注释)
21.碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。
它通常是以碘为原料与过量KOH溶液通过下列反应制得:
3I2+6KOH=5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I―转化为IO3―,装置如图。
(1)在反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为。
(2)电解前,将KI和KIO3混合溶液加入阳极区;
将氢氧化钾溶液加入阴极区。
电解槽用水冷却。
电解时,阳极上的电极反应;
阴极上得到的气体产物为;
(3)某同学查资料获知:
KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子反应方程式为,为确定电解是否完成,需检验阳极区电解液中是否含有I―,该同学选用淀粉溶液和稀硫酸进行实验,其它仪器及用品自选,请完成其方案:
实验操作
现象及结论
(4)电解完毕,从电解液中得到KIO3晶体的过程为:
步骤①的操作名称,步骤④中洗涤晶体的目的。
四、计算题(题型注释)
五、简答题(题型注释)
22.从化工厂铬渣中提取硫酸钠的工艺如下:
①铬渣含有Na2SO4及少量Cr2O72-、Fe3+
;
②Fe3+、Cr3+完全沉淀(c≤1.0×
10-5mol·
L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以
,滤渣A为
(填化学
式)。
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为
(填
字母序号)
A.蒸发浓缩,趁热过滤
B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为:
;
酸C为
,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=
(4)根据2CrO42-+2H+
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的
极,其电极反应式为
六、推断题(题型注释)
参考答案
1.B
【解析】
试题分析:
金属的腐蚀程度:
电解>
原电池>
化学反应>
电极保护。
故选B。
考点:
金属的腐蚀
点评:
本题考查的是金属的腐蚀程度的知识,难度中等,掌握以下规律便很容易解答此类问题,金属的腐蚀程度:
2.D
3.D
A、锌比铜活泼,锌是负极失去电子,A错误;
B、取下盐桥,不能形成闭合回路,原电池不能再工作,B错误;
C、在外电路中,电子从负极流向正极,C错误;
D、正极是铜,溶液中的铜离子放电,总反应式为Zn+Cu2+=Zn2++Cu,D错误,答案选D。
考查原电池原理的应用与判断
4.D
【解析】用惰性电极电解未精制的饱和食盐水时,首先发生反应2NaCl+2H2O
2NaOH+H2↑+Cl2↑,在阴极区产生了氢氧化钠,未精制的饱和食盐水中有Ca2+、Mg2+、
,此时就发生反应
+OH-====
+H2O,Mg2++2OH-====Mg(OH)2↓,
+Ca2+====CaCO3↓,MgCO3的溶解度大于Mg(OH)2的,故浑浊溶液中没有碳酸镁。
5.C
【解析】原电池中正极是得到电子的,所以钢铁发生吸氧腐蚀时,正极上发生反应的物质是氧气,因此正确的答案选C。
6.D
【解析】氢氧燃料电池工作时,氢电极失电子,顺导线向向氧电极,化学能转化为电能。
7.B
A.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量其中一个一个稍微过量,错误;
B.碱性锂电池的比能量比铅蓄电池的大,能量密度高,质量轻体积小,储存时间长,正确。
C.镀层破损后由于锌的金属性比铁强,和铁构成原电池,锌作负极,保护铁不被腐蚀,错误;
D.电解饱和食盐水制烧碱,不能制的纯碱,错误。
考查原电池、电解原理及应用。
8.B
A.Na+、Ba2+、NO3-、Cl-用惰性电极电解时,阴极上不会生成白色沉淀,故A错误;
B.H+、Mg2+、Na+、SO42-之间不发生反应,且都是无色离子,且用惰性电极电解时阳极生成氧气、阴极生成氢氧化镁沉淀,满足题干要求,故B正确;
C.CO32-、K+、Cl-、Na+离子用惰性电极电解时,阴极上不会生成白色沉淀,故C错误;
D.Fe2+为有色离子,不满足溶液无色的要求,故D错误;
答案为B。
【考点定位】考查离子反应与离子共存
【名师点晴】本题考查了离子共存的判断,题目难度中等,注意掌握离子反应发生条件,需要明确题干限制条件:
无色溶液中不能存在有色离子、阳极上有无色气体产生、阴极上有白色沉淀生成,溶液中必须存在与氢氧根离子反应生成难溶物的离子。
9.A
铜和盐酸或稀硫酸不能自发的进行氧化还原反应,铜和硝酸能自发的进行氧化还原反应,但生成的气体是氮氧化物而不是氢气,所以该反应只能是电解池反应而不是原电池反应,所以该装置只能构成电解池不能构成原电池;
该电解池中,阳极上铜失电子发生氧化反应,阴极上氢离子得电子发生还原反应,所以该电解池的阳极必须是铜电极,故选A。
考查原电池和电解池的工作原理。
10.B
惰性电极电解硝酸钾、硫酸镁、硫酸钠溶液的实质均是电解水,不可能有金属析出,只有电解硫酸铜溶液才能析出金属铜,答案选B。
考查电极产物判断
11.C
【解析】A选项可组成原电池,其中M溶解变细,N棒上有气泡产生;
B选项组成的原电池中,N变细,M棒上有气泡产生;
D选项组成的原电池中,M变细,N变粗。
12.C
A、以石墨做电极电解盐酸,溶液中氢离子、氯离子放电,HCl的浓度逐渐减小,PH值逐渐变大,错误;
B、以石墨做电极电解氢氧化钠溶液,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中氢氧化钠的浓度增大,溶液的PH值增大,错误;
C、以石墨做电极电解硫酸钠溶液,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中硫酸钠的浓度增大,但溶液中氢离子和氢氧根离子的浓度不变,溶液的pH值保持不变,正确;
D、以石墨做电极电解氯化钠溶液,溶液中氢离子和氯离子放电,溶液中氢离子浓度逐渐减小,氢氧根浓度增大,PH值变大,错误。
考查电解原理及离子的放电顺序。
13.C
【解析】从图上可看出,电解分为两个阶段;
第一阶段电解CuSO4溶液,第二阶段电解水。
当n(e-)=0.4mol时,Cu2+消耗完,因而Cu2+的物质的量为0.2mol,电解前其浓度为1mol/L,A错误。
B项忽略了溶液体积的变化。
当n(e-)=0.6mol时,得到O20.15mol,而H2只在第二阶段产生,该阶段电子转移0.2mol,得到H20.1mol,C正确。
D项没有补充消耗的水,显然不对。
14.D
由A池中D极产生具有氧化性的气体在标准状况下为2.24L,D为阳极,4OH――4e―=2H2O+O2↑
A.电源N极为负极
B.D极都发生氧化反应,E极发生还原:
Cu2++2e―=Cu
C.F极是以粗铜板为材料作阳极:
Cu―2e―=Cu2+
E极发生:
Cu2++2e―=Cu
2mol64g
2.24/22.4×
4mol12.8g
故D正确。
15.D
A、根据①的反应方程式,得出:
正极:
Cu2++2e-=Cu,负极:
HCHO+OH--2e-=HCOO-+H2O,根据②HCHO>
Cu,则将含OH-的HCHO溶液加人到装置的右侧,错误;
B、经过A分析,电极反应式:
HCHO+OH--2e-=HCOO-+H2O,错误;
C、换成阴离子交换膜,放电过程中,根据原电池的工作原理,阴离子向负极移动,阳离子向正极移动,左侧是正极,右侧是负极,错误;
D、移去质子交换膜,Cu2++HCHO+3OH-=Cu+HCOO-+2H2O有红色沉淀,Cu2+和OH-结合生成Cu(OH)2蓝色絮状沉淀,正确。
考查原电池的工作原理。
16.D
由电池反应知,Zn从0价变为+2价的Zn(OH)2失去电子,作为原电池的负极,A项正确;
充电时,Fe(OH)3中的+3价的铁被氧化为K2FeO4中的+6价的铁,B项正确;
放电时,生成OH-,对应的溶液碱性增强,C项正确;
此反应共转移6mole-,对应有2molFeO42-被还原,D项错误。
考查原电池等相关知识。
17.
(1)4P+5O22P2O5;
化合反应;
(2)3Fe+2O2Fe3O4;
(3)2H2O2H2↑+O2↑;
分解反应.
【解析】首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写;
再根据反应特征确定反应类型.
解:
(1)磷在空气中燃烧生成五氧化二磷,反应的化学方程式为:
4P+5O22P2O5;
该反应符合“多变一”的特征,属于化合反应.
(2)铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为3Fe+2O2Fe3O4;
(3)水通电分解生成氢气和氧气,反应的化学方程式为:
2H2O2H2↑+O2↑;
该反应符合“一变多”的特征,属于分解反应.
18.(12分)
(1)2O2+4H2O+8e-===8OH-(2分),CH4+10OH--8e-===CO32-+7H2O(2分)
(2)阴极(2分)CuCl2
Cu+Cl2↑(2分)
(3)1.12L(2分)0.1(2分)
(1)在碱性溶液中,甲烷燃料电池的总反应式为:
CH4+2O2+2OH-=CO32-+3H2O,正极是:
2O2+4H2O+8e-═8OH-,负极是:
CH4-8e-+10OH-═CO32-+7H2O.
(2)闭合K开关后,b电极连接电源的负极,电极的名称是阴极,电解池中发生反应的化学方程式为:
CuCl2
Cu+Cl2↑
(3)若电解池中b电极增重3.2g,说明生成铜的物质的量为0.05mol,电路中转移电子数为0.1mol,a电极理论上生成的Cl2也是0.05mol,体积为1.12L;
原电池与电解池的综合应用,涉及电极反应、电极产物判断及计算等。
19.
(1)2Fe–4e-==2Fe2+O2+2H2O+4e-==4OH-
(2)2Fe+2H2O+O2==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)3
【解析】考查铁的电化学腐蚀
铁与碳形成了原电池,发生了吸氧腐蚀(中性电解质溶液)
(1)负极:
2Fe–4e-==2Fe2+正极:
O2+2H2O+4e-==4OH-
(2)总反应为2Fe+2H2O+O2==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)3
Fe(OH)3脱水形成铁锈Fe2O3·
xH2O
20.
(1)稀硫酸和铁粉
(2)杀菌剂(强氧化剂)和吸附剂(净水剂)
(3)Zn+2OH--2e-=Zn(OH)2变小
(4)FeO(s)+CO(g)=Fe(s)+CO2(g)ΔH=-218kJ/mol
(1)FeSO4是强酸弱碱盐,易发生水解使溶液呈酸性,配制溶液时,需加入稀硫酸抑制Fe2+水解,FeSO4具有较强的还原性,还需加入铁粉,防止Fe2+被氧化。
(2)高铁酸钾中铁为+6价,具有很强的氧化性,可用于杀菌,高铁酸钾的还原产物是Fe3+,易水解生成氢氧化铁胶体,具有较强的吸附杂质的能力,可用于净水。
(3)该电池放电时,Zn失电子,为电池的负极,结合产物Zn(OH)2,可写出放电时的负极反应式为Zn+2OH--2e-=Zn(OH)2,正极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-。
充电时,充电电池的阳极与电源的正极相连,阳极反应式为Fe(OH)3+5OH--3e-=FeO42-+4H2O,pH变小。
(4)根据反应FeO(s)+CO(g)=Fe(s)+CO2(g)与高炉炼铁的反应可知:
3×
①-②-2×
③得到6FeO(s)+6CO(g)=6Fe(s)+6CO2(g)ΔH=-1308kJ/mol,简化成FeO(s)+CO(g)=Fe(s)+CO2(g)ΔH=-218kJ/mol。
21.
(1)5:
1
(2)I-+6OH--6e-=IO3-+3H2O氢气
(3)IO3-+5I-+6H+=3I2+3H2O
【实验操作】取少量阳极区电解液于试管中,加稀硫酸酸化后,加入几滴淀粉溶液,观察是否变蓝
【现象及结论】如果不变蓝,说明没有I-(如果变蓝,说明有I-)
(4)蒸发浓缩,洗去吸附在碘酸钾晶体表面的氢氧化钾等杂质
(1)碘元素由0价升为+5价,则I2是还原剂,KIO3是氧化产物,碘元素还由0价降为—1价,则I2还是氧化剂,KI是还原产物;
根据系数之比等于物质的量之比,由于氧化产物KIO3为1mol,则还原剂I2为1/2mol,还原产物KI为5mol,则氧化剂I2为5/2mol,所以该反应中氧化剂和还原剂的物质的量之比为5/2∶1/2=5∶1;
(2)阳极发生氧化反应,根据题意可知其主要反应物和产物是I―→IO3―;
碘元素由—1价升为+5价,根据化合价升高总数等于失去电子数可知,I―—6e―→IO3―;
根据KOH溶液显碱性可知,应用OH―使左右电荷守恒,则I―—6e―+6OH―→IO3―;
根据氢或氧原子个数守恒可知,I―—6e―+6OH―=IO3―+3H2O;
溶液中的阳离子移向阴极,H+优先得到电子,发生还原反应,产生氢气,则阴极得到的气体产物是H2;
(3)碘元素由+5价降为0价,说明KIO3是氧化剂,I2是还原产物,碘元素由—1价升为0价,说明I―是还原剂,I2还是氧化产物;
根据化合价升降总数相等,则IO3―+5I―→3I2;
酸性介质中可用H+使左右电荷守恒,则IO3―+5I―+6H+→3I2;
根据氢或氧原子守恒可知,该反应为IO3―+5I―+6H+=3I2+3H2O;
检验阳极区电解液中I―时,需要借助上述反应中碘离子的氧化产物(碘单质)遇淀粉变蓝的特性,就是要设法使碘离子转化为碘单质;
因此实验时先取少量阳极区电解液于试管中,加稀硫酸酸化后,再加入几滴淀粉溶液,观察是否变蓝,若不变蓝,说明无碘离子;
若变蓝,说明有碘离子;
(4)根据混合物分离提纯的方法可知,从KIO3溶液中制KIO3晶体的过程分别为蒸发浓缩、冷却结晶、过滤、洗涤、干燥