《化学8套汇总》上海市闵行区届高一上学期化学期末模拟学业水平测试试题Word格式文档下载.docx
《《化学8套汇总》上海市闵行区届高一上学期化学期末模拟学业水平测试试题Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《《化学8套汇总》上海市闵行区届高一上学期化学期末模拟学业水平测试试题Word格式文档下载.docx(69页珍藏版)》请在冰豆网上搜索。
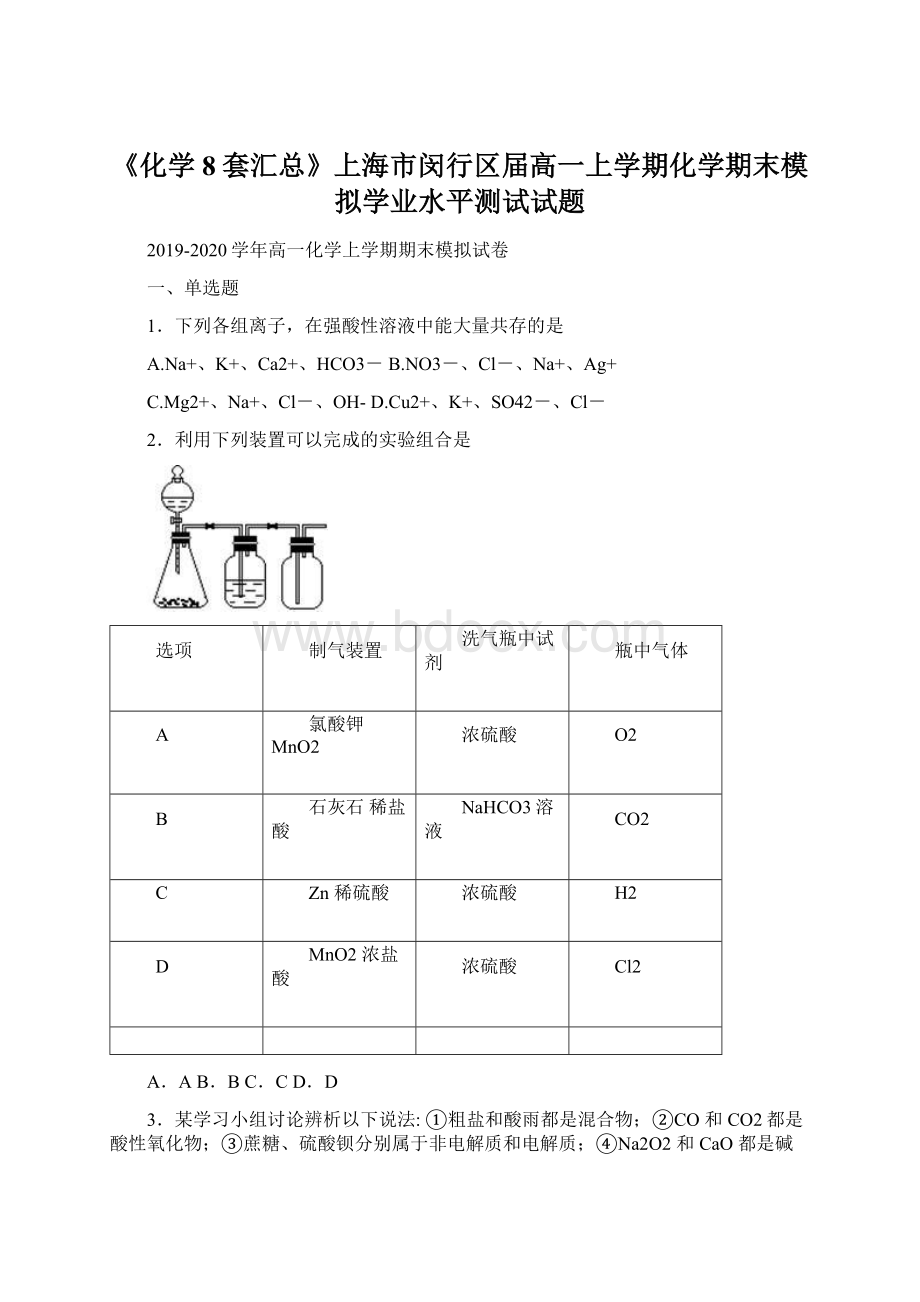
A.3:
5B.1:
2C.8:
11D.18:
8
5.X、Y、W、Q四种元素在元素周期表中的位置如下,下列叙述错误的是
A.Y的氢化物沸点高于Q的氢化物沸点
B.最高正价与最低负价之和为0的元素只有W
C.原子半径顺序为:
r(W)>r(Q)>r(Y)>r(X)
D.X、Y、Q三元素形成的分子中,原子最外层电子数之和最大为32
6.下列化学反应中,不是氧化还原反应的是
A.Cl2通入NaOH溶液制漂白液B.CO使CuO固体变为红色
C.Na2CO3与HCl溶液生成气体D.CO2使Na2O2固体变为白色
7.NA表示阿伏加德罗常数,下列说法中正确的是
A.17gNH3中含有的原子总数为4NA
B.1molFe溶解于足量的盐酸转移的电子数为3NA
C.标况下,22.4LH2O中含有的分子数为NA
D.1mol/LNaOH溶液中含有的Na+数为NA
8.常温下,在溶液中可以发生反应:
X+2Y3+===X2++2Y2+,有下列解释:
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物 ⑤Y2+具有还原性 ⑥Y3+的氧化性比X2+的氧化性强。
其中正确的是
A.②④⑥B.①③④C.②⑤D.①③⑤⑥
9.在无色的强酸性溶液中能大量共存的是()
A.Mg2+、Na+、Cl-、SO42-B.K+、Na+、Cl-、Cu2+
C.K+、Fe2+、NO3-、CO32-D.Na+、Ba2+、OH-、SO42-
10.硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质
A.锌粉B.镁粉C.铁粉D.铝粉
11.下列物质不属于合金的是( )
A.黄铜B.青铜C.不锈钢D.水银
12.要证明某溶液中不含Fe3+而可能含有Fe2+,则进行如下实验操作的最佳顺序为()
①加入少量氯水②加入少量KMnO4溶液③加入少量KSCN
A.①③B.③②C.③①D.①②③
13.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,48gO3含有氧原子数为NA
B.标准状况下,1.8g的H2O中含有的电子数为NA
C.常温常压下,11.2L氧气所含的原子数为NA
D.2.8g铁与足量盐酸反应失去的电子数为0.15NA
14.在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是
A.加入AgNO3后,再加稀硝酸酸化,有白色沉淀产生,说明有Cl-
B.新制氯水使红玫瑰变为白玫瑰,说明有Cl2
C.将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO
D.光照新制氯水有气泡逸出,该气体一定是Cl2
15.根据
的微粒结构示意图,下列说法中错误的是
A.它们属于不同元素B.它们都具有稳定结构
C.它们都是离子D.它们核外电子排布相同
16.下列说法正确的是()
A.节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B.将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是a%和b%的两种溶液,则a和b的关系是a=b
C.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,说明金属铝的熔点较低
D.用如图装置进行实验,将装置①中的AlCl3溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生
17.下列分散系,能产生丁达尔效应的是
A.Na2SO4溶液B.Fe(OH)3胶体
C.FeCl3溶液D.NaOH溶液
18.下列变化过程中,需要加入氧化剂的是
A.HCl→H2B.HCl→FeCl2C.H2SO4→SO2D.Fe→Fe2O3
19.等体积的两份稀酸溶液,一份为amol.L-1的硝酸溶液;
另一份为硝酸和硫酸的混合溶液,其中硝酸浓度为amol.L-1、硫酸的浓度为bmol.L-1。
若分别向两份溶液加入过量的铜粉,产生的气体体积为1:
2(都只生成NO),则a:
b的值是()
A.1:
1B.1:
2C.2:
1D.3:
2
20.将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示。
下列说法错误的是()
A.Cl2和苛性钾溶液在不同温度下可能发生不同反应
B.反应中转移电子数为是0.42NA
C.原苛性钾溶液中KOH的物质的量为0.3mol
D.生成物中Cl-的物质的量为0.21mol
21.对3NO2+H2O=2HNO3+NO反应的下列说法正确的是()
A.氧化剂与还原剂的质量比为1:
B.氧化产物与还原产物的物质的量之比为1:
C.NO2是氧化剂,H2O是还原剂
D.在反应中若有6molNO2参与反应时,有3mol电子发生转移
22.下列相关反应的离子方程式书写正确的是
A.Al2O3与过量氨水:
Al2O3+2NH3·
H2O═2AlO
+2NH4++H2O
B.钠与水反应:
2Na+2H+═2Na++H2↑
C.铝粉投入到NaOH溶液中:
2Al+2OH-=2AlO
+H2↑
D.Na2CO3溶液中滴加少量的稀盐酸:
H++CO
═HCO
23.下列各组离子在指定溶液中可能大量共存的是( )
A.能使碘化钾淀粉试纸变蓝的溶液:
Na+、NH4+、Cl−、I−
B.能使酚酞变红的溶液:
Mg2+、Fe3+、Na+、ClO−
C.含有大量Fe2+的溶液:
Na+、NH4+、SO42−、OH−
D.加入铝粉有氢气放出的溶液:
K+、Cu2+、SO42−、Cl−
24.在含有大量H+、Ba2+、Cl—的溶液中,还可能大量共存的离子是
A.Ag+B.Ca2+C.CO32-D.SO42-
25.1.92g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况)。
将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积可能是
A.504mLB.168mLC.336mLD.224mL
二、填空题
26.Na、Fe、Cl、Al是中学化学常见的元素。
回答下列问题:
(1)①含上述元素的常见化合物中,呈淡黄色的是____________(填化学式)。
②焰色反应的实验中,Na元素燃烧时的焰色为________色,观察K元素燃烧时的焰色需要透过_____________。
③实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是__________。
反应化学方程式为__________________________________________
(2)饮用水质量是关系人类健康的重要问题。
①在我国,一些贫困山区的农民至今还饮用井水,但暴雨过后井水混浊,无法饮用。
为了能让暴雨过后井水尽快变的澄清,你会建议他们最好向井水中投入下列中的__________(填序号)。
A.NaClB.Na2CO3C.KAl(SO4)2·
12H2OD.CuSO4
②氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为:
__________________________________________。
③写出工业上制取漂白粉的化学反应方程式:
__________________________。
④ClO2是一种广谱型的消毒剂,将逐渐取代Cl2成为生产自来水的消毒剂。
工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,反应中NaClO3和Na2SO3的物质的量之比为_________________。
三、推断题
27.无色气体A在一种黄绿色气体B中可以安静的燃烧,发出苍白色火焰,反应生成气体C。
B与金属D反应可生成白色固体E,D在空气中燃烧生成浅黄色固体F,F与CO2反应可得到气体G,D与水反应可生成A,A在G中燃烧生成水。
推断出各种物质后,回答下列问题:
(1)写出下列物质的化学式:
B_______、C_______、E_______。
(2)写出下列化学方程式:
a.由D生成F:
___________________________________________________;
b.F与CO2反应:
__________________________________________________;
c.D与水反应:
____________________________________________________。
四、综合题
28.硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。
(1)常温下,可用铁或者铝制的容器盛放浓硝酸,说明浓硝酸具有________性
A.酸性B.强氧化性C.吸水性D.脱水性
(2)浓H2SO4能够用于干燥某些气体,是由于它具有_____性;
下列气体能用浓硫酸来进行干燥的是_____
①Cl2②H2S③CO2④NH3⑤SO2
(3)浓H2SO4能使纸片变黑,是由于它具有____性;
(4)在加热条件下铜与浓硫酸反应,浓硫酸表现性质为________
五、实验题
29.某校化学兴趣小组的同学分别对氯气和氯水的性质进行探究。
Ⅰ.下图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略)。
(1)制备氯气选用的药品为二氧化锰和浓盐酸,A中反应的化学方程式为
__________________________________。
(2)装置B中饱和食盐水的作用是______;
同时装置B还能监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处最好依次放入________(填序号)。
①干燥的有色布条②湿润的有色布条③碱石灰④无水氯化钙⑤浓硫酸
(4)当向D中缓缓通入一定量氯气时,D中溶液逐渐变为______色;
再打开D装置活塞,将装置D中少量溶液滴入锥形瓶E中,振荡,观察到的现象是___________________。
(5)有人提出,装置F中可改用足量的饱和NaHSO3溶液吸收氯气,请判断是否可行________(填“是”或“否”),理由是__________________________________(用离子反应方程式表示)。
30.下图是实验室制取二氧化硫并验证二氧化硫的某些性质的装置,试回答:
(1)在①中发生反应的化学方程式为_____________。
(2)②中的实验现象为紫色石蕊试液_________,此实验证明二氧化硫是_____气体。
(3)③中的品红溶液_________,证明二氧化硫有________性。
(4)④中的实验现象是______________,证明二氧化硫有__________性。
(5)⑤中的实验现象是________________,证明二氧化硫有____________性。
(6)⑥的作用是________,反应的化学方程式为________。
【参考答案】***
题号
1
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
答案
19
20
21
22
23
24
25
26.Na2O2黄蓝色钴玻璃白色沉淀迅速变成灰绿色,最终变成红褐色沉淀4Fe(OH)2+O2+2H2O=4Fe(OH)3CCl2+H2O=H++Cl-+HClO2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O2∶1
27.(9分)
(1)Cl2HClNaCl(每空1分)
(2)2Na+O2
Na2O2
2Na2O2+2CO2===2Na2CO3+O2
2Na+2H2O===2NaOH+H2↑(每空2分)
28.B吸水性①③⑤脱水性氧化性和酸性
29.MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
除去Cl2中的HClB中长颈漏斗中液面上升,形成水柱②、④、①黄E中溶液分为两层,上层(苯层)为紫红色否4HSO3―+Cl2=SO42―+2Cl―+3SO2+2H2O
30.Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑变红酸性褪色漂白有淡黄色沉淀生成氧化高锰酸钾溶液褪色还原吸收二氧化硫,防止二氧化硫污染环境SO2+2NaOH=Na2SO3+H2O
1.化学与社会、生活密切相关,对下列现象或事实解释正确的是
现象或事实
解释
与水反应时,钠浮在水面上
钠与水反应是放热反应
FeCl3溶液可用于腐蚀废旧铜线路板
Fe3+的氧化性比Cu2+强
用铁槽车运输浓硫酸
常温下铁和浓硫酸不反应
漂白粉在空气中久置变质
漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
2.下列说法正确的是( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钠和水分别属于非电解质、强电解质和弱电解质
C.点燃的镁条不能在二氧化碳气体中继续燃烧
D.含0.2molH2SO4的浓硫酸与足量的铜反应,生成标准状况下的气体2.24L
3.下列有关NO的叙述正确的是()
A.NO是一种红棕色气体
B.常温常压下,NO不能与空气中的氧气直接化合
C.空气中的N2和O2在放电条件下可以发生反应生成NO
D.NO易溶于水,不能用排水法收集
4.在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法
现象
结论
观察氯水颜色
氯水呈黄绿色
氯水中含Cl2
向饱和NaHCO3溶液中加入足量氯水
有无色气体产生
氯水中含HClO
向红色纸条上滴加氯水
红色纸条褪色
氯水具有漂白性
向FeCl2溶液中滴加氯水
溶液变成棕黄色
氯水具有氧化性
5.NA表示阿伏加德罗常数的值,下列叙述正确的是
A.在常温常压下,1.7gNH3含有的原子数为0.4NA
B.标准状况下,11.2L水中含有的原子数为1.5NA
C.0.2mol/LNaSO4溶液中含Na+数为0.4NA
D.50ml12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
6.含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL1mol·
L−1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
A.a曲线表示的离子方程式为:
AlO2-+H++H2O===Al(OH)3↓
B.b和c曲线表示的离子反应是相同的
C.M点时,溶液中沉淀的质量为3.9g
D.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
7.已知反应①2BrO3-+Cl2=Br2+2ClO3-;
②5Cl2+I2+6H2O=2HIO3+10HCl
③ClO3-+5Cl-+6H+=3Cl2+3H2O,下列物质氧化能力强弱顺序正确的是()C
A.ClO3->BrO3->IO3->Cl2B.BrO3->Cl2>C1O3->IO3-
C.BrO3->ClO3->Cl2>IO3-D.Cl2>BrO3->C1O3->IO3-
8.下列关于科学家及其提出的学说或贡献叙述不正确的是()
A.汤姆生发现电子,并提出轨道模型
B.卢瑟福根据α粒子散射现象,提出了带核的原子结构模型
C.侯德榜发明的侯氏制碱法可制备碳酸钠
D.门捷列夫发明了元素周期表
9.生活中的下列物质,属于硅酸盐产品的是
A.陶瓷B.水晶C.玛瑙D.沙子
10.某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0.2mol该离子恰好能使0.6mol的SO32-离子完全氧化,则X2O72-离子还原后X的化合价为
A.+1B.+2C.+3D.+4
11.向一定量的盐酸中逐滴加入NaAlO2溶液,生成沉淀Al(OH)3的量随NaAlO2加入量的变化关系如图所示。
生成的沉淀过滤除去后,则下列离子组在对应的溶液中一定能大量共存的是
A.a点对应的溶液中:
Na+、K+HCO3-Cl-
B.b点对应的溶液中:
Na+、OH-、SO42-、Cl-
C.c点对应的溶液中:
Na+、K+、Ag+、NO3-
D.d点对应的溶液中:
Na+、K+、OH-、Cl-
12.检验铵盐的一般方法是将待检物质取出少量放入试管中,然后()
A.直接加热,用湿润的红色石蕊试纸在试管口处检验
B.加水溶解,向溶液中滴加紫色石蕊溶液
C.加入氢氧化钠溶液并加热,后再滴入酚酞溶液
D.加氢氧化钠加热,用湿润的红色石蕊试纸在试管口处检验
13.下列说法正确的是
A.石墨能导电,所以石墨是电解质
B.固体氯化钠不导电,所以氯化钠是非电解质
C.CH3COOH易溶于水,所以CH3COOH是强电解质
D.氨水的导电能力比等浓度的NaOH溶液弱,所以NH3·
H2O是弱电解质
14.下列说法不正确的是()
A.向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.氮氧化物可导致光化学烟雾
D.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
15.设NA代表阿伏加德罗常数,下列说法正确的是
A.室温下,32gO2和O3的混合气体中含有的氧原子数为2NA
B.铜与浓硫酸共热产生22.4LSO2时,转移电子数为2NA
C.标准状况下,2.24LC12溶于足量NaOH溶液中,转移的电子数目为0.2NA
D.18gNH4+中所含的质子数为10NA
16.设NA为阿伏加德罗常数的数值。
下列有关叙述正确的是
A.1L1mol/L的盐酸中含有HCl分子数为NA
B.8.8g由CO2和N2O组成的混合气体中含有的原子总数为0.3NA
C.标准状况下,11.2LSO3所含的分子数为0.5NA
D.Na2O2与H2O反应生成1.12LO2(标准状况),反应中转移的电子数为0.1NA
17.用25mL18.4mol/L的浓硫酸与铜共热一段时间后,冷却,过滤除去多余的铜,将滤液稀释到100mL,所得溶液中SO42-浓度为3mol/L,则此时溶液中CuSO4的物质的量浓度为
A.0.5mol/LB.1.6mol/LC.1.8mol/LD.3mol/L
18.设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24LH2O中含有共价数目为2NA
B.NA个氧气分子与NA个氢分子的质量比为8:
C.8gCuO与足量H2充分反生成Cu,该反应转移的电子数为0.2NA
D.4.6g金属钠与500mL0.2mol/L的盐酸充分反应,转移电子数为0.1NA
19.化学在生产和生活中有重要的应用,下列说法正确的是()
A.苏打在生活中可用做发酵粉B.磁性氧化铁可用于制备颜料和油漆
C.石灰石既是制玻璃的原料又是制水泥的原料D.二氧化硅可用于制作硅芯片和光电池
20.下列说法正确的是( )
A.6.02×
1023个分子的体积约是22.4L
B.0.5molH2的体积为11.2L
C.标准状况下,1molH2O的体积为22.4L
D.标准状况下,体积相同的气体所含的分子数相同
21.某无色气体,可能含HCl、CO2、HI、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液。
把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;
另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。
对于原无色气体推断一定正确的是()
A.一定存在HClB.一定存在SO2C.肯定没有CO2D.不能肯定是否含有HI
22.下列各反应中,氧化反应与还原反应在同种元素中进行的是()
A.Cl2+2NaOH=NaCl+NaClO+H2OB.2KClO3
2KCl+3O2↑
C.2KMnO4
K2MnO4+MnO2+O2↑D.2H2O
2H2↑+O2↑
23.对3NO2+H2O=2HNO3+NO反应的下列说法正确的是()
24.下列离子方程式书写正确的是
A.Na投入水中:
Na+H2O=Na++OH-+H2↑
B.氯气通入NaOH稀溶液中:
Cl2+2OH-=Cl-+ClO-+H2O
C.向NaHSO4溶液中滴入Ba(OH)2:
溶液:
H++OH-=H2O
D.向碳酸钙中加醋酸溶液;
CaCO3+2H+=Ca2++CO2↑+2H2O
25.下列气体中,可以用来冷却镁蒸气的是
A.空气B.二氧化碳C.氩气D.氧气
26.完成下列化学方程式:
(1)碳酸氢钠受热分解的方程式________________________________________
(2)NO2溶于水发生的反应____________________________________________
(3)NH3与O2的反应_________________________