江苏省洪泽县新区中学届九年级下学期质量调研考试化学试题Word文档下载推荐.docx
《江苏省洪泽县新区中学届九年级下学期质量调研考试化学试题Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《江苏省洪泽县新区中学届九年级下学期质量调研考试化学试题Word文档下载推荐.docx(13页珍藏版)》请在冰豆网上搜索。
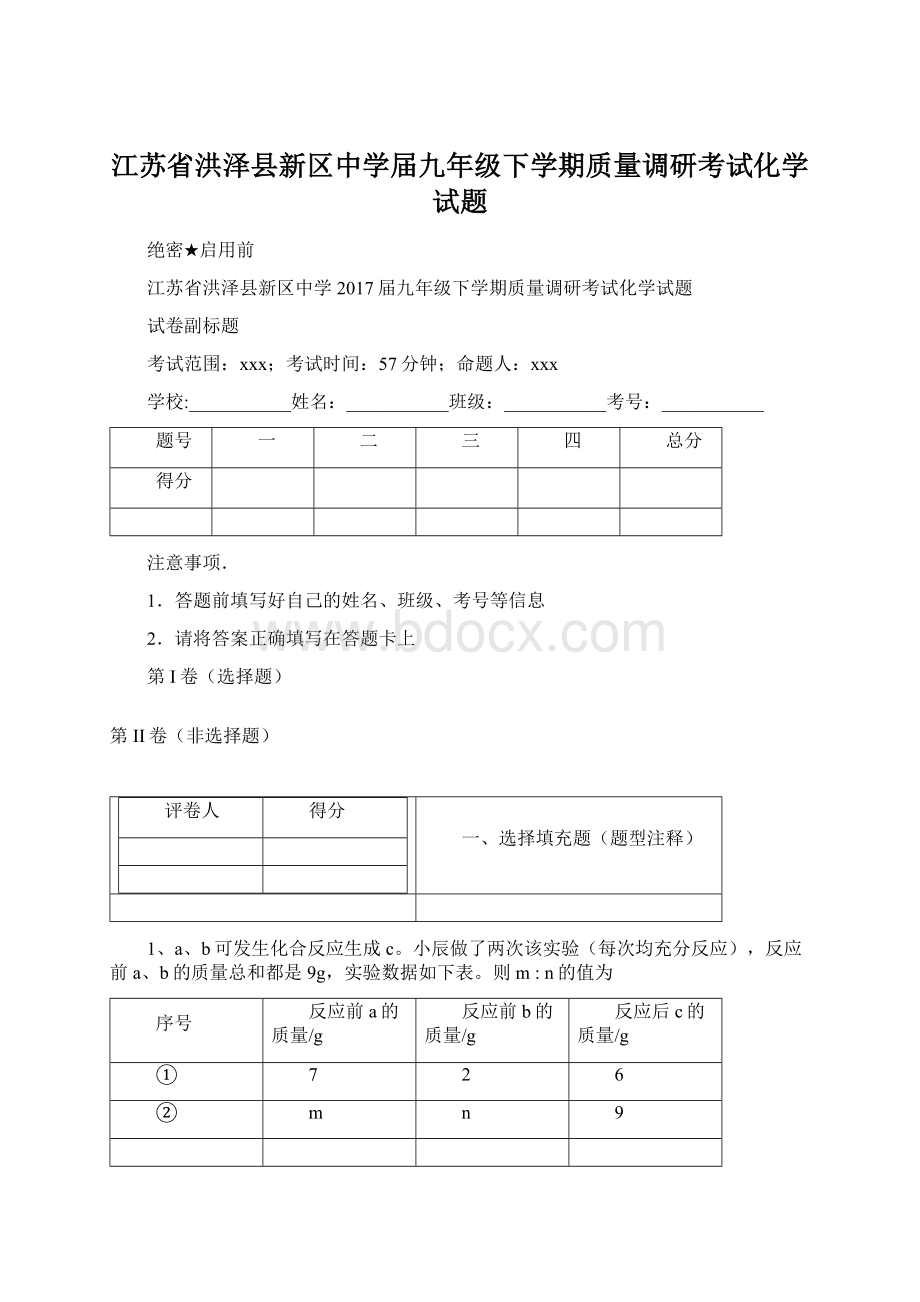
A.5:
4
B.2:
7
C.2:
1
D.1:
8
2、为除去下列物质中的杂质,下列操作方法能达到目的的是
选项
物质(杂质)
操作方法
A
CO2(H2O)
将气体通过盛有火碱的干燥管
B
CuO(CuSO4)
加入过量稀硫酸并加热
C
CaO(CaCO3)
加足量的水再过滤
D
FeCl2(CuCl2)
加入足量铁屑,充分搅拌应后过滤
A.A
B.B
C.C
D.D
3、下列对聚氯乙烯(PVC)的有关描述错误的是
A.性质:
能被点燃
B.用途:
可用于包装食品
C.组成:
碳元素、氢元素和氯元素
D.填埋处理会破坏土壤结构
4、小明用洁净干燥的玻璃棒蘸取待测液滴到湿润的pH试纸上,测得pH=3,他判断这是一种酸性溶液。
对他的操作方法、测量结果及结论的评价,正确的是
A.方法错误,结果偏大,结论正确
B.方法正确,结果正确,结论正确
C.方法错误,结果偏小,结论错误
D.方法正确,结果正确,结论错误
5、硫代硫酸钠(Na2S2O3)是一种重要的工业原料,其中硫(S)元素的化合价为
A.+4
B.+3
C.+2
D.-5
6、下列实验操作错误的是
A.
滴加液体
B.
稀释浓硫酸
C.
加热液体
D.
放置试管
7、以下固体的颜色为白色的是
A.二氧化锰
B.硫粉
C.氢氧化铜
D.氧化镁
8、中国著名的化工专家侯德榜先生通过“联合制碱法”制得的“碱”是
A.Na2CO3
B.NaOH
C.Ca(OH)2
D.NaCl
9、下列变化属于化学变化的是
A.汽油挥发
B.瓷碗破碎
C.酒精燃烧
D.冰川融化
10、空气中氧气的体积分数约为
A.78%
B.21%
C.0.96%
D.0.03%
二、简答题(题型注释)
11、有一瓶标签被腐蚀的稀硫酸,小江为了测定溶液中溶质的质量分数,用NaOH固体和水配制40g10%的NaOH溶液于烧杯中,然后往烧杯中滴加稀硫酸,反应过程中溶液的pH与滴入稀硫酸的质量关系下图所示:
请计算:
(已知:
2NaOH+H2SO4=Na2SO4+2H2O)
(1)配制40g10%的NaOH溶液,需要水的质量为
g;
(2)该稀硫酸中H2SO4质量分数(写出计算过程)。
三、探究题(题型注释)
12、某兴趣小组同学准备进行常见酸、碱、盐性质实验时,发现实验台上有一瓶失去瓶塞并且标签破损的液体药品(如图),于是决定对这瓶溶液的成分进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含钠元素的物质是氯化钠、氢氧化钠、碳酸钠。
【提出猜想】这瓶溶液可能是:
①氯化钠溶液;
②氢氧化钠溶液;
③碳酸钠溶液。
【实验推断】
实验
实验操作
实验现象
实验结论和解释
(1)
取样于试管中,滴加无色酚酞试液。
溶液呈红色
该溶液不可能是___________溶液,
理由是____________。
(2)
另取样于试管中,滴加足量稀盐酸。
_________
该溶液为碳酸钠溶液
(3)小青认为上述实验
(2)的结论不完全正确,小组同学讨论后一致认为还需要进行如下实验:
另取样于试管中,加入过量的中性CaCl2溶液,观察到有白色沉淀产生,设计这一步骤的目的是_______________;
静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液原来是____________。
13、据统计,我国每年报废的手机超过1亿部,若不进行回收利用,会造成巨大的浪费和污染。
同学们对废旧手机中的金属回收产生兴趣。
【提出问题】从废旧手机中可以回收到哪些有价值的金属?
如何回收?
【查阅资料】
Ⅰ.手机电路板中的金属及其价格如下表所示:
种类
Fe
Cu
Al
Ni
Au
Ag
Pd(钯)
市场价格/($/t)
365
7175.5
1710.5
14235
4.7×
107
7.6×
105
2.7
×
107
矿石中含量
72.4
0.87
29.1
1.02
4
120
0.4
手机电路板中含量
5
13
1
0.1
350
1380
210
说明:
Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;
Pd的金属活动性位于氢后;
NiCl2溶液为绿色。
Ⅲ.2Cu+O2+2H2SO4
2CuSO4+2H2O
【实验方案】
第一步:
选择值得回收的金属
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:
①_____________;
②它们的市场价格较高。
第二步:
设计实验分离、回收部分金属
实验步骤
I
取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出
焊锡熔化
II
将金属电路放入烧杯中,加入过量稀盐酸浸泡
……
III
取II中未溶解的金属电路,用蒸馏水洗净后,放入如图所示装置中,进行实验。
溶液逐渐变成蓝色,仍有微量金属固体未溶解
IV
过滤III中烧杯中的物质,洗涤滤纸上的物质
滤纸上仍有微量金属固体
V
【问题讨论】
(1)由步骤I中的现象,可推知的焊锡的物理性质是____________。
(2)步骤II对应的实验现象有___________。
(3)步骤II所得溶液中,至少含有溶质有_____________种。
(4)步骤V的操作是:
“向步骤Ⅳ获得滤液中加入一定量铁粉”,若该实验过程加入铁粉前后溶液中主要离子变化示意图如下图所示:
①图中“
”所代表微粒的符号为____________;
②充分反应后过滤,滤纸上固体物质是____________(写化学式)。
四、信息分析题(题型注释)
14、根据下列装置回答:
(1)仪器a的名称是________。
(2)实验室用氯酸钾和二氧化锰的混合物制取并收集氧气,可选择的一组装置是_____(填编号),该反应的化学方程式为____________。
(3)用大理石和稀盐酸制取二氧化碳,反应的化学方程式为__________。
选用装置C制取二氧化碳的优点是____________。
15、下图是某反应前后分子变化的微观示意图:
请回答以下问题:
(1)四种物质中,属于化合物的有________(填图中字母)。
(2)该反应中,没有发生变化的微粒是_______(用微粒符号表示)。
(3)在该反应中,参加反应的A和B的质量比为______(计算结果用最简整数比表示)。
16、化学与生活密切相关,在厨房里蕴藏着许多化学知识。
(1)下列食物中,能提供大量维生素的是_______(填字母序号)。
A.蔬菜
B.牛奶
C.大米
(2)身体缺钙,可能患有的疾病是________(填“骨质疏松”或“贫血”)。
(3)厨房中的下列物品中,所使用的主要材料属于天然纤维的是______(填字母序号)。
(4)生活中碗筷用沸水消毒的化学原理是________。
17、如图表示某些物质间转化关系。
A为有机物,G为常见金属,E为红棕色固体;
C、F是由相同元素组成的无色气体,且C有毒;
D、H为无色气体单质,B为无色液体。
请回答下列问题:
(1)反应①的化学方程式为________。
(2)反应②可以说明电能可以转化为________能。
(3)自然界中普遍存在反应③,该反应的化学方程式为________。
18、下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃
10
20
30
40
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
碳酸钠
12.2
21.8
39.7
53.2
(1)40℃时,氯化钠的溶解度为________g。
(2)碳酸钠溶液中混有少量的氯化钠,可通过________结晶方法提纯。
(3)在20℃时,在100g水中加入25g碳酸钠,充分搅拌后得到的是_____(填“饱和”或“不饱和”)溶液,将上述溶液升温到30℃,所得溶液的溶质质量分数为________。
19、现有四种物质:
①活性炭、②甲烷、③硝酸钾、④二氧化硫,请用序号填写:
(1)引起酸雨的气体是________;
(2)天然气的主要成分是________;
(3)可作复合肥的是_________;
(4)可吸附水中异味的是________。
参考答案
1、C
2、D
3、B
4、A
5、C
6、B
7、D
8、A
9、C
10、B
11、
(1)36g;
(2)24.5%
12、
氯化钠
氯化钠溶液呈中性,不能使酚酞变红色
有气泡产生
除尽碳酸钠
氢氧化钠溶液
13、
电路板中含量比矿石中要高
熔点低
固体表面有气泡、溶液变为绿色
四
Fe2+
14、
铁架台
AD或AF
方程式略
可控制反应的发生或停止
15、
AD
H、O、N
17:
24
16、
A
骨质疏松
C
高温下、细菌体内蛋白质发生了化学变化
17、
3CO+Fe2O3
2Fe+3CO2
化学
6CO2+6H2O
C6H12O6+6O2
18、
36.6
降温
饱和
20%
19、
④
②
③
【解析】
1、7x+2y=6,mx+ny=9,m:
n=2:
1。
点睛∶本题主要考查质量守恒定律的应用。
2、
应将气体通过盛有浓硫酸洗气瓶。
故A错误。
应加入过量水溶解并过滤。
故B错误。
应煅烧。
故C错误。
加入足量铁屑与氯化铜反应,生成硫化亚铁和铜,充分搅拌应后过滤。
故D正确。
点睛∶本题主要考查有关除杂知识。
3、A.性质:
能被点燃。
故A正确。
B.用途:
有毒,不可用于包装食品。
碳元素、氢元素和氯元素。
故C正确。
D.填埋处理会破坏土壤结构。
点睛∶本题主要考查物质的性质。
4、不应湿润pH试纸。
A.方法错误,结果偏大,结论正确。
点睛∶本题主要考查pH试纸的应用。
5、根据正负总价代数和为零原则,硫代硫酸钠(Na2S2O3),﹙+1﹚×
2+2x+﹙-2﹚×
3=0,x=C.+2.
点睛∶本题主要考查根据化学式判断某元素化合价。
6、A.滴加液体,滴管悬空竖直。
B.稀释浓硫酸,浓硫酸应倒入水中。
C.加热液体。
D.放置试管。
点睛∶本题主要考查实验的基本操作。
7、A.二氧化锰,黑色。
B.硫粉,黄色。
C.氢氧化铜,蓝色。
D.氧化镁,白色。
点睛∶本题主要考查固体的颜色。
8、侯德榜先生通过“联合制碱法”制得的“碱”是A.Na2CO3。
点睛∶本题主要考查联合制碱法。
9、A.汽油挥发,B.瓷碗破碎,D.冰川融化,均没有新物质生成,属于物理变化。
C.酒精燃烧,有新物质生成,属于化学变化。
点睛∶本题主要考查物理变化和化学变化的概念。
10、空气中氧气的体积分数约为B.21%。
点睛∶本题主要考查空气中各成分的体积分数。
11、
(1)配制40g10%的NaOH溶液,需要水的质量为∶40g-40g×
10%=36g;
(2)解∶设该稀硫酸中H2SO4质量分数为x,
2NaOH+H2SO4=Na2SO4+2H2O
80
98
40g×
10%
20g×
x
=
x=24.5%.
答∶
(1)配制40g10%的NaOH溶液,需要水的质量为36g;
(2)该稀硫酸中H2SO4质量分数是24.5%。
点睛∶本题主要考查溶液的组成以及根据化学方程式进行计算。
12、【提出问题】这瓶溶液是什么溶液?
该溶液不可能是氯化钠溶液,
理由是氯化钠溶液呈中性,不能使酚酞变红色。
(3)认为上述实验
(2)的结论不完全正确,小组同学讨论后一致认为还需要进行如下实验:
另取样于试管中,加入过量的中性CaCl2溶液,观察到有白色沉淀产生,设计这一步骤的目的是除尽碳酸钠
;
【实验结论】这瓶溶液原来是氢氧化钠溶液。
点睛∶本题是一道推断题,主要考查物质成分的探究和推断。
13、Ⅰ.【提出问题】从废旧手机中可以回收到哪些有价值的金属?
【查阅资料】Ⅱ.Ni的金属活动性位于氢前;
2CuSO4+2H2O。
【实验方案】第一步:
选择值得回收的金属。
①电路板中含量比矿石中要高;
②它们的市场价格较高。
设计实验分离、回收部分金属。
【问题讨论】1)由步骤I中的现象,可推知的焊锡的物理性质是熔点低
。
(2)步骤II对应的实验现象有固体表面有气泡、溶液变为绿色。
(3)步骤II所得溶液中,至少含有溶质有
种。
“向步骤Ⅳ获得滤液中加入一定量铁粉”,若该实验过程加入铁粉前后溶液中主要离子变化示意图。
”所代表微粒的符号为.Fe2+
,②充分反应后过滤,滤纸上固体物质是Cu。
点睛∶本题是一道实验探究题,主要考查对废旧手机中的金属回收。
14、
(1)仪器a的名称是铁架台;
(2)实验室用氯酸钾和二氧化锰的混合物制取并收集氧气,可选择的一组装置是AD或AF。
该反应的化学方程式为
2KClO3
2KCl+3O2↑。
(3)用大理石和稀盐酸制取二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑。
选用装置C制取二氧化碳的优点是可控制反应的发生或停止。
点睛∶本题主要考查实验室制取氧气,二氧化碳的装置,原理,收集方法等知识。
15、
(1)四种物质中,属于化合物的有AD;
(2)该反应中,没有发生变化的微粒是H、O、N;
(3)在该反应中,参加反应的A和B的质量比为4×
17∶3×
32=17:
24。
点睛∶本题主要考查化学反应前后分子变化的微观示意图的含义。
16、
(1)能提供大量维生素的是A.蔬菜。
(2)身体缺钙,可能患有的疾病是骨质疏松。
(3)厨房中的下列物品中,所使用的主要材料属于天然纤维的是C.棉布,A.塑料保鲜膜和B.橡胶手套,属于合成材料。
点睛∶本题主要考查营养元素,微量元素,材料的知识。
17、由题中信息知,A为有机物,G为常见金属,E为红棕色固体;
A是葡萄糖,B是水,C是一氧化碳,D是氢气,E是氧化铁,F是二氧化碳,G是铁。
(1)反应①的化学方程式为3CO+Fe2O3
(2)反应②可以说明电能可以转化为化学能。
3)自然界中普遍存在反应③,该反应的化学方程式为6CO2+6H2O
C6H12O6+6O2。
18、根据所学知识和题中信息知,
(1)40℃时,氯化钠的溶解度为36.6g.
(2)碳酸钠溶液中混有少量的氯化钠,可通过降温结晶方法提纯。
(3)在20℃时,碳酸钠溶解度是21.8个,在100g水中加入25g碳酸钠,充分搅拌后得到的是饱和溶液,将上述溶液升温到30℃,碳酸钠溶解度是39.7个,所得溶液的溶质质量分数为∶
×
100%=20%。
点睛∶本题主要考查有关溶解度的知识。
19、
(1)引起酸雨的气体是④二氧化硫;
﹙2)天然气的主要成分是②甲烷;
(3)可作复合肥的是③硝酸钾;
(4)可吸附水中异味的是①活性炭。