化学计算题Word文档格式.docx
《化学计算题Word文档格式.docx》由会员分享,可在线阅读,更多相关《化学计算题Word文档格式.docx(12页珍藏版)》请在冰豆网上搜索。
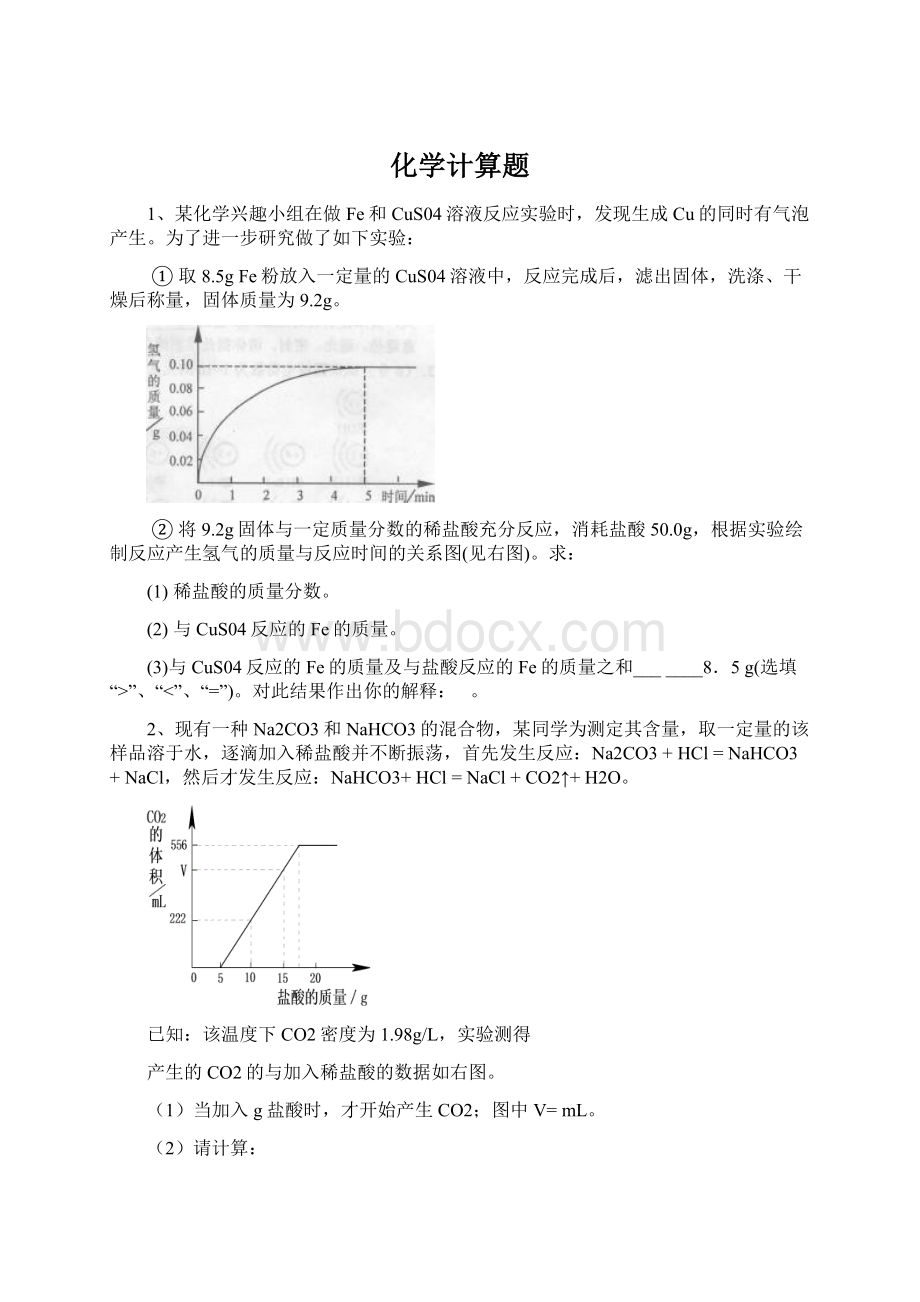
(3)小刚和小勇根据不同的数据求得蛋壳中碳酸钙的质量分数有明显差别,请你分析其中可能的原因。
4、为了对氯化钾样品(含少量KNO3)进行分组分析,甲、乙、丙三位同学分别进行实验,他们的实验数据如下表,请仔细观察和分析数据,回答下列问题:
甲
乙
丙
所取固体样品的质量/g
20
10
加入AgNO3溶液的质量/g
100
150
反应后所得的沉淀质量/g
14.35
⑴三位同学中,哪一位所用的KCl和AgNO3刚好互相完全反应(填写编号)。
⑵三位同学分别把反应后的溶液过滤(操作中的损失可忽略不计),其中有一位同学所得的滤液中只含有一种溶质,此溶液的溶质质量分数是多少?
(小数点后保留两位数字)
5、取4份质量不同的石灰石样品,分别与27.0g相同溶质质量分数的稀盐酸充分反应后(石灰石样品中的杂质既不溶于水,也不与盐酸反应),经过滤、干燥,称量剩余固体的质量。
剩余固体的质量与所取样品质量的关系如下表所示。
试计算:
实验序号
石灰石样品质量/g
稀盐酸的质量/g
剩余固体质量/g
1
1.0
27.0
0.1
2
2.0
0.2
3
3.0
0.3
4
4.0
1.3
1灰石样品中碳酸钙的质量分数。
⑵所用稀盐酸中溶质的质量分数。
6、为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
第一次
第二次
第三次
所取合金的质量/g
所用稀硫酸的质量/g
50
80
生成氢气的质量/g
⑴计算该铜锌合金中金属锌的质量。
⑵从上表数据分析,当所取合金与所用稀硫酸的比为____时,表明合金中的锌与稀硫酸恰好完全反应。
⑶所用合金与稀硫酸恰好完全反应时所得溶液中溶质的质量分数。
7、将14g不纯的氢氧化钾样品(杂质不溶于水)放入115.8g水中,充分溶解后过滤(假设操作过程中氢氧化钾和水均无损失)。
在所得滤液中加入一定质量的稀盐酸恰好完全反应,得到溶质质量分数为7.45%的氯化钾溶液200g。
⑴氢氧化钾样品中氢氧化钾的质量分数;
⑵稀盐酸中溶质的质量分数。
8、长久使用的热水壶底部有一层水垢,主要成分是CaCO3和Mg(OH)2,某学校化学研究性学习小组的同学通过实验测定水垢中的CaCO3含量:
取200g水垢,加入过量的稀盐酸,同时测量5分钟内生成CO2的质量,结果如下表:
时间/分钟
5
质量/g
30
60
66
试回答:
⑴4分钟后,水垢中CaCO3是否反应完全?
⑵该水垢中的CaCO3质量分数是多少?
9、为测定混有少量氯化钠的碳酸氢钠(NaHCO3)固体的质量分数。
现进行如下实验:
向盛有13.6g该混合物的烧杯中加入109.5g盐酸,恰好完全反应。
反应的化学方程式为:
NaHCO3+HCl=NaCl+H2O+CO2↑。
反应过程用精密仪器测得烧杯和药品的质量与反应时间的数据记录如下:
反应时间
t0
t1
t2
t3
t4
t5
烧杯和药品质量/g
210.0
206.7
204.6
203.9
203.4
求:
⑴混合物中NaHCO3的质量分数⑵反应后溶液中溶质的质量分数
10、某校科学兴趣小组为测定某样品中氯化铵的质量分数,将6g样品溶于18g水后,再加入7.6g氢氧化钠浓溶液共热,两者恰好完全反应(样品中的杂质不与氢氧化钠反应,也不溶于水,氯化铵与氢氧化钠的反应方程式为:
NH4Cl+NaOH△NaCl+H2O+NH3↑)。
把产生的所有NH3用足量的硫酸溶液完全吸收,同时测量120秒内硫酸溶液增加的质量,结果如下表所示。
时间/s
40
120
硫酸溶液增
加的质量/g
0.7
1.2
1.5
1.6
1.7
试回答下列问题:
(1)请在右图中画出产生气体的质量随反应时间变化关系曲线;
(2)样品中氯化铵的质量分数为;
(3)求反应后所得氯化钠溶液的溶质质量分数(不考虑反应过程中水分的损失)。
11、做实验时,小科取了40mL的Ba(OH)2溶液,并随手倒人等量的稀盐酸(均未知浓度)。
老师发现后,递给他一瓶未知质量分数的K2CO3溶液,让小科来
检测混合溶液的酸碱性。
小科在混合液中慢慢滴入K2CO3,
溶液,获得相关数据并绘成如图所示图像。
;
(1)刚加入K2CO3溶液时,发现没有沉淀生成,却有气泡产
生,则原混合溶液呈
(填“酸性”、“碱性”或“中性”),
其中所含的溶质有(用化学式表示);
(2)计算K2CO3溶液中溶质的质量分数。
12、某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:
取该石灰石样品16克放入烧杯,把80克稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,也不与稀盐酸反应)。
请计算:
序号
加入稀盐酸的质量/克
剩余固体的质量/克
11
6
2.8
第四次
n
(1)上表中n的数值为。
(2)样品中碳酸钙的质量分数为。
(3)小明同学计算所用盐酸的溶质质量分数,计算过程如下:
解:
设盐酸的溶质质量分数为x
CaCO3+2HCl=CaCl2+H20+C02↑
10073
13.2g80x
100:
73=13.2:
80x
x=12%
小明的计算过程中存在明显错误,你能通过列式计算进行纠正吗?
13、在一密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件
下充分反应。
测得反应前后各物质的质量如下:
物质
氧气
二氧化碳
水蒸气
M
反应前质量/g
46
反应后质量/g
89
55
x
(1)表中x的值为;
(2)已知未知物质M的相对分子质量为46,推出其化学式为;
(3)该反应的化学方程式为。
14、某钙片的标签如右下图所示,此钙片成分中只有碳酸钙含有钙元素。
(1)请通过计算说明此标签中的含钙量是否错误。
(2)为测定这种钙片含钙量,小东每次取10片钙片放入已称量的盛有足量盐酸的烧杯中。
充分反应后再称量烧杯和剩余物的总质量。
小东做了三次实验,数据如右下表:
①请计算每片此钙片含碳酸钙的质量。
(相对原子质量:
H1O16C12Ca40)
②你认为应该建议厂家如何更改标签?
15、六朝古都南京的一些古代建筑保存完好,这与所用的建筑材料有关。
该小组从某古代建筑维修现场搜集了一些旧墙灰进行研究。
取12.Og旧墙灰(主要成分是碳酸钙)放入烧杯中,并加入足量稀盐酸(假设其他杂质不参加反应,不考虑H20、HCl逸出)。
反应开始,烧杯及所盛物质的总质量为300.0g。
实验数据记录如下:
反应时间/min
8
12
14
16
18
烧杯及所盛物质总质量/g
300.0
299.0
298.0
297.2
296.5
296.0
295.7
295.6
①该小组因故没有记录反应时间为16min时的数据M。
你由表中数据推测,M=g
②反应生成CO2的总质量为g。
③根据实验数据,在右边的坐标纸上绘制生成CO2质量与反应时间关系的曲线。
前3min生成CO2的质量为g。
④该旧墙灰中CO32-离子的质量分数为。
5g1分444mL1分
HCl_______CO2
36.544
5g*x0.44g解得x=7.3% ---------2分
NaCO3_____HCl
10636.5
y5g*7.3%解得y=1.06g ---------1分
NaHCO3_____CO2
8444
z0.556L*1.89g/L
解得Z=2.1g ---------1
39.(1)二氧化碳
(2)57%
小勇的计算过程为:
设碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
10044
x3.3g
X:
3.3g=100:
44X=7.5g
碳酸钙的百分含量为:
7.5g/10g=75%
(3)小刚计算所用的蛋壳残渣可能未干燥,实际蛋壳残渣质量小于4.3g
或小勇计算所用的数据“3.3g”中包含了反应过程中盐酸挥发了的氯化氢气体的质量,即实际生成的二氧化碳气体质量小于3.3g
1、⑴乙(1分)⑵10.56%(4分)
答:
(1)石灰石样品中碳酸钙的质量分数为90%;
(2)稀盐酸中溶质的质量分数为7.3%。
设合金中锌的质量为x,生成硫酸锌质量为y。
Zn+H2SO4=ZnSO4+H2↑
65 161 2
x y 0.2g
x=6.5g
(2)1∶5
(3)由
(1)得:
,y=16.1g
所得溶液中ZnSO4的质量分数:
×
100%=28.6%
200g溶液中氯化钾的质量:
200g×
7.45%=14.9g
设样品中含氢氧化钾的质量为x;
盐酸中氯化氢的质量为y。
KOH+HCl=KCl+H2O
56 36.5 74.5
x y 14.9g
x=
y=
(1)样品中氢氧化钾的质量分数:
(2)稀盐酸中溶质的质量分数:
12、⑴已反应完全⑵答:
水垢中CaCO3的质量分数为:
100%=75%。
14、
(1)92.6%
(2)8.4%
7.
(1)如右图(2分)
(2)89.1%(2分)
(3)解:
设样品中NH4Cl的质量为x,生成的氯化钠质量为y。
NH4Cl+NaOH==NaCl+H2O+NH3↑
53.558.517
xy1.7g
x=5.35g…………1分
y=5.85g……………………1分
反应后溶液质量=5.35g+18g+7.6g-1.7g=29.25g……………………1分
则氯化钠溶液的溶质质量分数=5.85g/29.25g×
100%=20%……………………1分
答:
氯化钠溶液的溶质质量分数为20%.
酸性、HCLBaCl2、23%
37、
(1)2.8g;
(2)82.5%;
(3)解:
设盐酸的溶质质量分数为x(选第一次或第二次的数据进行计算)
5g20x
73=5g:
20x
x=18.25%
答:
盐酸的溶质质量分数为18.25%。
26、(6分)⑴0⑵
⑶
38.(5分)
(1)本品若为纯碳酸钙,其含钙量为:
40g×
=16g
则每片含钙量为:
16g/50=0.32g
因此本品每片不可能含钙0.75g。
(2分)
(2)①设10片钙片含碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑(1分)
100 44
x (22+8-26.7)g
x=7.5g,因此每片此钙片含碳酸钙0.75g(1分)
②每片此钙片的含钙量=0.75g×
=0.3g
建议厂家将含钙量:
“每片含钙0.75g”改为“每片含钙0.3g”
37、M=295.6g(2分)
②4.4g(2分)。
③1.5g。
(2分)
④50%。