化学化学溶液的除杂分离和提纯的专项培优 易错 难题练习题含答案及答案解析Word文档格式.docx
《化学化学溶液的除杂分离和提纯的专项培优 易错 难题练习题含答案及答案解析Word文档格式.docx》由会员分享,可在线阅读,更多相关《化学化学溶液的除杂分离和提纯的专项培优 易错 难题练习题含答案及答案解析Word文档格式.docx(18页珍藏版)》请在冰豆网上搜索。
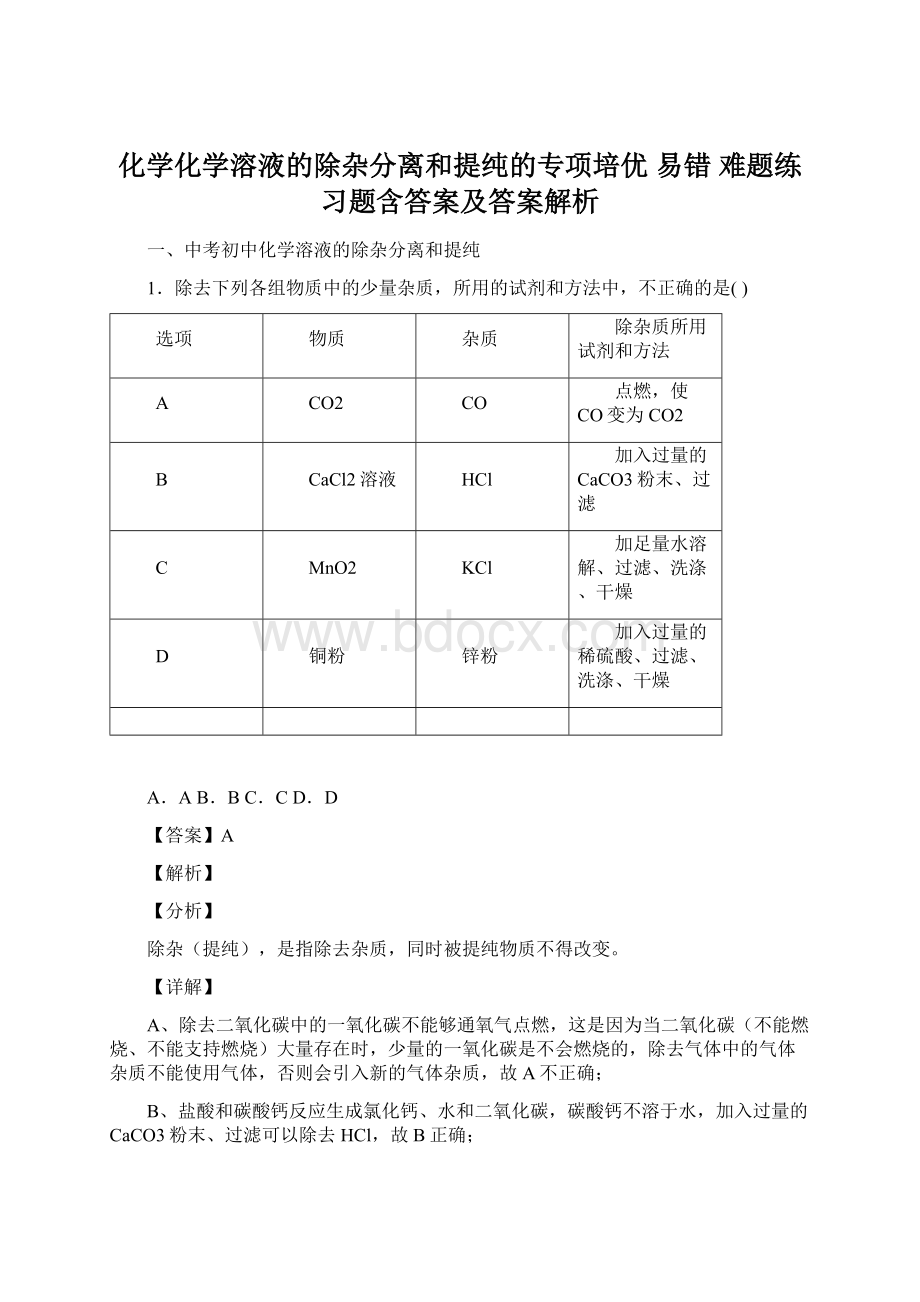
故选A。
【点睛】
除杂条件:
①加入的试剂只能与杂质反应,不能与原物质反应;
②反应后不能引入新的杂质。
2.除去下列物质中的少量杂质,所选用的试剂及操作方法不正确的是( )
杂质(少量)
试剂和操作方法
O2
水蒸气
通过浓H2SO4
稀盐酸
稀硫酸
加入适量BaCl2溶液,过滤
通过氢氧化钠溶液
KNO3溶液
Ba(NO3)2溶液
加入适量的Na2SO4溶液,过滤
【答案】D
A、浓硫酸具有吸水性,可以去除氧气中水蒸气,正确。
B、稀硫酸和氯化钡反应生成硫酸钡沉淀和盐酸,过滤后只剩下盐酸,即除去杂质又未引入新杂质,正确。
C、氢氧化钠和二氧化碳反应生成碳酸钠和水,一氧化碳不能与氢氧化钠反应,又未引入新的杂质,正确。
D、Ba(NO3)2溶液加入适量的Na2SO4溶液,反应生成硫酸钡沉淀和硝酸钠,引入了新的杂质硝酸钠,方法不正确,符合题意。
故选:
3.去下列各物质中混有的少量杂质,所用试剂及操作方法均正确的是()
物质
杂质
除杂试剂或操作方法
NaNO3溶液
AgNO3
加入适量NaCl溶液,过滤
NaCl溶液
Na2CO3
加入过量的BaCl2溶液,过滤
H2O
通过灼热的铜网
氯化钙
盐酸
加入过量氧化钙,过滤
A、硝酸银和氯化钠反应生成氯化银沉淀和硝酸钠,过滤得到硝酸钠溶液,该选项正确;
B、碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,除去碳酸钠后引入氯化钡(过量)新杂质,该选项不正确;
C、高温条件下铜和氧气反应生成氧化铜,该选项不正确;
D、氧化钙和盐酸反应生成氯化钙和水,过量的氧化钙和水反应生成氢氧化钙,除去盐酸后引入新杂质氢氧化钙,该选项不正确。
A。
4.除去下列物质中的杂质(括号中物质为杂质),所用试剂和操作方法都正确的是()
A.CaCl2溶液(HCl):
过量CaCO3过滤B.Cu(CuO):
O2加热
C.KCl(KOH):
水蒸发D.ZnCl2溶液(CuCl2)过量镁粉过滤
选择分离与提纯方法应遵循的原则:
①不增:
指不能引入新的杂质。
②不减:
指应尽可能减少被分离与提纯的物质的损失。
③易分离:
指如果使用试剂除去杂质时,要求反应后的产物跟被提纯的物质容易分离。
④易复原:
指分离物或被提纯的物质都要容易复原。
A、除去CaCl2溶液中的HCl:
加CaCO3,HCl会与CaCO3反应生成氯化钙、水和二氧化碳,过量的碳酸钙再通过过滤除去,符合除杂原则,故选项正确;
B、除去铜中的氧化铜,加热,主成分铜会和氧气反应,杂质氧化铜不反应,不符合除杂的原则,可以通入一氧化碳还原氧化铜,故选项错误;
C、除去氯化钾中的氢氧化钾,加入水,两者都能溶于水,操作不可行,可以加入适量稀盐酸,氢氧化钾会与盐酸反应生成氯化钾和水,故选项错误;
D、除ZnCl2溶液中的CuCl2,加过量镁粉,ZnCl2和CuCl2都会和镁反应,不符合除杂原则,可以加入过量锌过滤,选故项错误;
5.下列物质的鉴别和除杂方案中,能达到目的的是
实验目的
实验方案
鉴别黄铜和黄金
观察颜色
鉴别棉花和羊绒
灼烧闻气味
除去二氧化碳中混有的氯化氢
将气体通过足量的氢氧化钠溶液
除去硫酸钠溶液中的稀硫酸
加入过量的碳酸钠溶液,过滤
【答案】B
A、黄铜和黄金都是黄色固体,不能通过观察颜色的方法进行鉴别,该选项不能达到实验目的;
B、灼烧时,产生烧焦羽毛气味的是羊绒,另一种是棉花,可通过灼烧闻气温的方法鉴别两种物质,该选项能够达到实验目的;
C、氢氧化钠和二氧化碳反应生成碳酸钠和水,氢氧化钠和氯化氢反应生成氯化钠和水,将气体通过足量的氢氧化钠溶液,不但能除去杂质,也会把原物质除去,该选项不能达到实验目的;
D、碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,向混有稀硫酸的硫酸钠溶液中加入过量的碳酸钠溶液,能除去硫酸,但引入的新的杂质碳酸钠,该选项不能达到实验目的。
故选B。
6.为除去下列物质中的杂质,下列操作方法能达到目的的是
物质(杂质)
操作方法
CO2气体(H2O)
将气体通过盛有足量火碱的干燥管
CuO固体(CuSO4)
加入过量稀硫酸并加热
FeCl2溶液(CuCl2)
加入过量的铁粉,振荡,过滤
Na2SO4溶液(Na2CO3)
加稀盐酸至恰好不再产生气泡为止
【答案】C
A、除去CO2气体中少量的H2O,将气体通过盛有足量火碱的干燥管,虽然能把水除去,但氢氧化钠也能吸收二氧化碳气体,A不正确;
B、除去CuO固体少量的CuSO4,加入过量稀硫酸并加热,硫酸铜不能被除去,但氧化铜却被硫酸除去,B不正确;
C、除去FeCl2溶液中少量的CuCl2,加入过量的铁粉,振荡,铁能与氯化铜溶液反应,生成氯化亚铁和铜,把铜过滤得到氯化亚铁溶液,C正确;
D、除去Na2SO4溶液中少量的Na2CO3,加稀盐酸至恰好不再产生气泡为止,盐酸与碳酸钠反应生成氯化钠、水和二氧化碳,虽然把碳酸钠除去,但也引进了氯化钠,D不正确。
故选C。
7.下列除去杂质的方法中,正确的是
除杂质的方法
硝酸钾
硝酸钡
加入适量的硫酸钠溶液
二氧化碳
一氧化碳
点燃
铁粉
加入足量的稀盐酸溶解、过滤、洗涤
碳酸钠
碳酸钙
加入盐酸
A、硝酸钡能与适量的硫酸钠溶液反应生成硫酸钡沉淀和硝酸钠,能除去杂质但引入了新的杂质硝酸钠,不符合除杂原则,故选项所采取的方法错误。
B、除去二氧化碳中的一氧化碳不能够点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的,故选项所采取的方法错误。
C、铁粉能与足量的稀盐酸反应生成氯化亚铁溶液和氢气,铜不能与稀盐酸反应,再过滤、洗涤、干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
D、碳酸钙和碳酸钠均能与盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
C。
物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键。
8.下列实验操作中不能达到实验目的是()
目的
主要实验操作
CO2和N2
鉴别
分别通入澄清石灰水,观察现象
NaOH固体中含有Na2CO3
检验
取样,配成溶液加入少量盐酸,观察现象
KCl和MnO2的混合物
分离
溶解、过滤,蒸发结晶,固体洗涤并烘干
CaCl2溶液混有HCl杂质
除杂
先加入过量的碳酸钙固体反应后过滤
A、将CO2和N2分别通入澄清石灰水,CO2能使澄清石灰水变浑浊,N2不能使澄清石灰水变浑浊,所以可以鉴别,不符合题意;
B、NaOH固体中含有Na2CO3,取样,配成溶液加入少量盐酸,少量盐酸只和氢氧化钠反应生成氯化钠和水,无法检验是否含有Na2CO3,符合题意;
C、KCl和MnO2的混合物,KCl易溶于水,MnO2不溶于水,溶解、过滤,蒸发结晶,固体洗涤并烘干,可以分离KCl和MnO2,不符合题意;
D、CaCl2溶液混有HCl杂质,加入过量的碳酸钙固体,盐酸和碳酸钙反应生成氯化钙、二氧化碳和水,过滤后得到纯净的氯化钙溶液,不符合题意。
9.稀硝酸中混有少量的硫酸,为了除去硫酸,可加入适量的物质是( )
A.Ba(NO3)2B.AgNO3C.NaClD.CuO
A、硫酸能与硝酸钡溶液反应生成硫酸钡沉淀和硝酸,能除去杂质且没有引入新的杂质,符合除杂原则,故A正确;
B、硫酸能与硝酸银溶液反应生成微溶于水的硫酸银沉淀和硝酸,能除去杂质但引入了新的杂质硫酸银(微溶于水),不符合除杂原则,故B不正确;
C、硫酸与氯化钠不反应,加入氯化钠,引入了氯化钠杂质,不符合除杂原则,故C不正确;
D、稀硝酸和硫酸均能与氧化铜反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故D不正确。
加入的试剂只能与杂质反应,不能与原物质反应;
反应后不能引入新的杂质。
10.下列除杂方法正确的是
除杂试剂与方法
氯化钙溶液
加入过量的氢氧化钙
硫酸钾
碳酸钾
加入过量的稀硫酸
氧化钙
高温煅烧
A.一氧化碳在二氧化碳的环境中,不能燃烧,故选项错误;
B.“过量”一词,决定了反应后溶液会增加氢氧化钙新杂质,故选项错误;
C.依旧是“过量”一词,决定了反应后溶液会增加硫酸新杂质,故选项错误;
D.碳酸钙高温煅烧后生成氧化钙和二氧化碳,故选项正确。
D。
11.除去下列物质中的少量杂质(括号内为杂质)所用的试剂和操作方法均正确的是
除去杂质的方法
铜(铁粉)
加入足量稀盐酸,过滤、洗涤、干燥
氯化钙溶液(碳酸钠)
加入适量的稀盐酸,过滤
水(有异味的物质)
加热煮沸
二氧化碳(一氧化碳)
A、铜与稀盐酸不反应,铁与稀盐酸反应生成氯化亚铁和氢气,经过过滤后得到固体铜,最终经过洗涤干燥得到纯净的铜,选项A正确;
B、碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,引入了新的杂质氯化钠,选项B不正确;
C、煮沸只能去除钙、镁离子形成的可溶性化合物,无法去除异味,选项C不正确;
D、二氧化碳不支持燃烧,其中混有少量一氧化碳不能被点燃,所以无法去除,选项D不正确。
去除物质的杂质时,既要保证原物质不被消耗,同时不能引入新的杂质。
12.下列物质提纯或除杂所用试剂和分离方法正确的是()
物质(括号内为杂质)
除杂试剂
分离方法
Ca(OH)2(CaCO3)
溶解、过滤
NaCl(Na2SO4)
过量BaCl2溶液
过滤
KCl(MnO2)
溶解、过滤、洗涤、干燥
H2(HCl)
NaOH溶液
洗气
A.氢氧化钙中混有碳酸钙,加入盐酸,碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,氢氧化钙也会和盐酸反应生成氯化钙和水,不符合题意;
B.氯化钠中混有硫酸钠,加入过量氯化钡溶液,硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠,但是引入了新杂质氯化钡,不符合题意;
C.氯化钾中混有二氧化锰,先加水溶解,氯化钾溶于水,二氧化锰不溶于水,过滤,得到的固体时二氧化锰,滤液是氯化钾溶液,再经过蒸发结晶即可得到氯化钾晶体,不符合题意;
D.氢气中混有氯化氢气体,将气体通入氢氧化钠溶液,氯化氢和氢氧化钠反应生成氯化钠和水,氢气不与氢氧化钠反应,即可得到纯净的氢气,符合题意。
故选D。
13.下表中,除去物质中所含少量杂质的方法不正确的是
所含杂质
除去方法
加水溶解、过滤、洗涤、干燥
H2O2
加无水硫酸铜固体,过滤
N2
缓缓通过灼热的铜丝网
NaCl溶液
Na2SO4
加适量的氯化钡溶液,并过滤
A、氯化钾可溶于水,二氧化锰难溶于水,加水溶解、过滤,除去氯化钾,洗涤、干燥得到二氧化锰,不符合题意;
B、无水硫酸铜吸收水,但同时硫酸铜溶液可以作为过氧化氢分解的催化剂,催化过氧化氢分解生成水和氧气,除去了原物质,符合题意;
C、氧气可以和灼热的铜网反应,变成黑色的固体氧化铜,氮气与铜不反应,不符合题意;
D、适量的氯化钡可以和硫酸钠反应,生成硫酸钡沉淀和氯化钠,过滤,除去硫酸钡,不符合题意。
除杂选择试剂的原则是:
不增(不引入新的杂质)、不减(不能将原物质反应掉)、不繁(整个过程不繁琐)。
14.分离、提纯是化学实验的重要环节,下列实验设计不能达到实验目的是()
实验设计
除去铜粉中混有的少量铁粉
用磁铁吸引
除去NaCl固体中的少量Na2CO3
先加足量水溶解,再加适量稀盐酸,蒸发结晶
除去KNO3溶液中的少量K2SO4
加入适量的Ba(NO3)2溶液,过滤
除去CO中的少量H2O和CO2
先通过浓硫酸,再通过足量氢氧化钠溶液
A、铜不能被磁铁吸引,铁能被磁铁吸引,除去铜粉中混有的少量铁粉可用磁铁吸引,故A正确。
B、碳酸钠和稀盐酸反应生成氯化钠二氧化碳和水,除去NaCl固体中的少量Na2CO3可先加足量水溶解,再加适量稀盐酸,蒸发结晶,故B正确。
C、硫酸钾和硝酸钡反应生成硫酸钡沉淀和硝酸钾,除去KNO3溶液中的少量K2SO4可加入适量的Ba(NO3)2溶液,过滤,故C正确。
D、除去CO中的少量H2O和CO2,应先通过足量氢氧化钠溶液,再通过浓硫酸,否则水去除不干净,故D错误。
15.下列实验操作中不能达到实验目的是()
实验操作
鉴别NaC1和NH4NO3
分别加入少量水溶解
鉴别NaOH溶液和澄清石灰水
分别通入二氧化碳
除去Cu(NO3)2溶液中混有的少量AgNO3
加入适量的铜粉,过滤
除去K2SO4溶液中混有的少量KOH
加入适量稀盐酸
A、NH4NO3溶于水吸热,使温度降低,氯化钠溶于水温度几乎无变化,可以鉴别,故选项实验操作中能达到实验目的,故A正确,不符合题意;
B、二氧化碳能使石灰水变浑浊,与氢氧化钠溶液反应生成碳酸钠和水,但无明显变化,可以鉴别,故选项实验操作中能达到实验目的,故B正确,不符合题意;
C、适量的铜粉能与硝酸银溶液反应生成硝酸铜溶液和银,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项实验操作中能达到实验目的,故C正确,不符合题意;
D、KOH能与适量稀盐酸反应生成氯化钾和水,能除去杂质但引入了新的杂质氯化钾,不符合除杂原则,故选项实验操作中不能达到实验目的,故D错误,符合题意。
根据两种物质与同种试剂反应产生的不同现象来鉴别它们,若两种物质与同种物质反应的现象相同,则无法鉴别它们。
除杂过程中注意反应后不能引入新的杂质。
二、中考初中化学推断题
16.某固体物质可能含有Na2SO4、Na2CO3、CaCl2、CuSO4、KCl和KOH中的一种或几种。
为探究其组成,进行如下实验,流程和现象记录如下:
(资料)CaCl2、BaCl2、KCl三种溶液均呈中性。
(1)依据步骤①的实验现象得出固体物质中一定不含__________(填化学式)。
(2)步骤②中发生反应的化学方程式为________________________________。
(3)根据上述实验得出固体物质中一定含有__________(填化学式,下同),可能含有______。
为进一步确定可能含有的物质,采用的方法是_____________________(写出实验的操作、现象和结论)。
【答案】CuSO4Na2CO3+BaCl2=BaCO3↓+2NaClNa2CO3、KOHKCl取少量无色溶液A于试管中,加入足量的稀硝酸,然后滴加硝酸银溶液,若产生白色沉淀,则固体中一定含有KCl,否则不含KCl
(1)因为步骤①得到的溶液呈无色,而硫酸铜溶液呈蓝色,所以固体物质中一定不含硫酸铜;
(2)因为步骤③中白色沉淀溶于稀硝酸,可见该白色沉淀不是硫酸钡,所以步骤②中产生的白色沉淀为碳酸钡。
因此原混合物中一定含有碳酸钾,一定不含氯化钙、硫酸钠,因为溶液显碱性,所以一定含有氢氧化钾,故步骤②中发生反应的化学方程式为:
BaCl2+Na2CO3=BaCO3↓+2NaCl;
(3)根据上述实验得出固体物质中一定含有Na2CO3、KOH,可能含有KCl。
为进一步确定可能含有的物质,根据氯离子的性质,采用的方法是:
取少量无色溶液A于试管中,加入足量的稀硝酸,然后滴加硝酸银溶液,产生白色沉淀,则固体中一定含有氯化钾,反之不含氯化钾。
17.甲、乙、丙、丁均为中学化学中的常见物质,其中甲是大理石的主要成分,乙是造成温室效应的主要气体,它们之间的转化关系如图.请根据相关信息回答问题:
(1)写出有关物质的化学式:
甲,丁。
(2)写出反应③的化学方程式,该反应属于(填基本反应类型)反应。
(3)生活中,物质丙的用途之一为。
【答案】
(1)甲CaCO3,丁Ca(OH)2
(2)CO2+Ca(OH)2=CaCO3↓+H2O;
复分解(3)干燥剂
试题分析:
甲是大理石的主要成分,说明甲是碳酸钙;
乙是造成温室效应的主要气体,说明乙是二氧化碳;
碳酸钙受热分解生成乙(二氧化碳)和丙,则丙是氧化钙;
丙的用途之一干燥剂,丙为氧化钙和水反应生成丁,则丁是氢氧化钙。
反应③为二氧化碳和氢氧化钙的反应,化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;
该反应属于复分解反应。
考点:
物质的性质和变化反应的类型
18.某未知溶液,可能含有Na+、Cu2+、Ba2+、SO42-、Cl-中的几种,为确定溶液中含有的离子,实验如下:
①取未知溶液2~3mL于试管中,滴加足量BaCl2溶液,有白色沉淀生成,静置;
②取①中上层清液,滴加AgNO3溶液,有白色沉淀生成;
③另取未知溶液2~3mL于试管中,滴加NaOH溶液,有蓝色沉淀生成。
分析实验过程,回答:
(1)溶液中一定存在的离子是__________________。
(2)溶液中一定不存在的离子是__________________。
(3)溶液中可能存在的离子是__________________。
【答案】Cu2+、SO42-Ba2+Na+、Cl-
硫酸根离子能与钡离子结合生成白色沉淀硫酸钡,步骤①中向未知溶液中滴加足量BaCl2溶液后,有白色沉淀生成,所以未知溶液中一定含有SO42-,一定不含Ba2+;
氯离子能与银离子结合生成白色沉淀氯化银,步骤②中取①中上层清液,滴加AgNO3溶液后,有白色沉淀生成,则①中上层清液中一定含有氯离子,但步骤①加入BaCl2溶液后引入了Cl-,所以未知溶液中可能含有Cl-;
铜离子能与氢氧根离子结合生成蓝色沉淀氢氧化铜,步骤③中向未知溶液中滴加NaOH溶液后,有蓝色沉淀生成,则未知溶液中一定含有Cu2+;
由上述实验步骤和实验现象无法得出未知溶液中是否含有Na+,则未知溶液中可能含有Na+。
(1)由上述分析可知,溶液中一定存在的离子是Cu2+、SO42-。
(2)由上述分析可知,溶液中一定不存在的离子是Ba2+。
(3)由上述分析可知,溶液中可能存在的离子是Na+、Cl-。
19.如图所示,A是金属氧化物,B是金属单质,C是黄色溶液,D是浅绿色溶液,E是红褐色沉淀,反应③是物质F与氧气、水发生的化合反应,请回答下列问题:
(1)写出C的化学式_____。
(2)化学反应①的基本类型是_____。
(3)写出反应②和③的化学方程式:
②_____;
③_____。
【答案】 FeCl3 复分解反应 Fe+2HCl=FeCl2+H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
A是金属氧化物,A能和稀盐酸反应生成C,C是黄色溶液,所以A是氧化铁,C是氯化铁;
氯化铁能和试剂X反应生成红褐色沉淀,则试剂X是氢氧化钠,沉淀E是氢氧化铁;
A能反应生成B,B是金属单质,则B是铁单质;
B能和稀盐酸反应生成D,D是浅绿色溶液,则D是氯化亚铁;
D能和氢氧化钠反应生成氢氧化亚铁白色沉淀,则沉淀F是氢氧化亚铁;
氢氧化亚铁能和水、氧气反应生成氢氧化铁沉淀。
(1)C是氯化铁,化学式是FeCl3;
(2)反应①是氯化铁和氢氧化钠相互交换成分生成氯化钠和氢氧化铁,是复分解反应;
(3)反应②是铁和稀盐酸反应生成氯化亚铁和氢气,反应③是氢氧化亚铁能和水、氧气反应生成氢氧化铁沉淀,反应的化学方程式是Fe+2HCl=FeCl2+H2↑,4Fe(OH)2+O2+2H2O=4Fe(OH)3。
20.A—I是初中化学中常见的物质。
它们之间有如下图所示的转化关系。
已知A为铝土矿的主要成分,通常情况下F是一种液体,C、D、H、I为气体,H能参与绿色植物的光合作用,G为黑色固体。
请回答下列问题:
(1)G的化学式是_______________。
(2)H+单