最新高考化学经典真题精选训练电解质溶液及答案Word格式.docx
《最新高考化学经典真题精选训练电解质溶液及答案Word格式.docx》由会员分享,可在线阅读,更多相关《最新高考化学经典真题精选训练电解质溶液及答案Word格式.docx(28页珍藏版)》请在冰豆网上搜索。
.c(H+)+c(NH4+)=c(OH﹣)+c(HO3﹣)+2c(O32﹣)
D.c(﹣)>c(NH4+)>c(HO3﹣)>c(O32﹣)
5.(2015•广东)水溶液中能大量共存的一组离子是( )
A.NH4+、B2+、Br﹣、O32﹣B.﹣、SO32﹣、F2+、H+
.+、N+、SO42﹣、MO4﹣D.N+、H+、NO3﹣、HO3﹣
6.(2015•四川)下列有关SO4溶液的叙述正确的是( )
A.该溶液中N+、NH4+、NO3﹣、Mg2+可以大量共存
B.通入O2气体产生蓝色沉淀
.与H2S反应的离子方程式:
2++S2﹣=S↓
D.与过量浓氨水反应的离子方程式:
2++2NH3•H2O=(OH)2↓+2NH4+
7.(2015•上海)某无色溶液含有下列离子中的若干种:
H+、NH4+、F3+、B2+、A3+、O32﹣、﹣、OH﹣、NO3﹣.向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有( )
A.3种B.4种.5种D.6种
8.(2014•江苏)水是生命之,2014年我国家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )
A.水是弱电解质
B.可燃冰是可以燃烧的水
.氢氧两种元素只能组成水
D.0℃时冰的密度比液态水的密度大
9.(2014•重庆)下列叙述正确的是( )
A.浓氨水中滴加F3饱和溶液可制得F(OH)3胶体
B.H3OON溶液中滴加少量浓盐酸后c(H3OO﹣)增大
.(HO3)2溶液与过量NOH溶液反应可制得(OH)2
D.25℃时(OH)2在水中的溶解度大于其在(NO3)2溶液中的溶解度
10.(2014•上海)向饱和澄清石灰水中加入少量2,充分反应后恢复到原的温度,所得溶液中( )
A.c(2+)、c(OH﹣)均增大B.c(2+)、c(OH﹣)均保持不变
.c(2+)、c(OH﹣)均减小D.c(OH﹣)增大、c(H+)减小
11.(2014•海南)以石墨为电极,电解I溶液(其中含有少量酚酞和淀粉).下列说法错误的是( )
A.阴极附近溶液呈红色B.阴极逸出气体
.阳极附近溶液呈蓝色D.溶液的pH变小
12.(2014•四川)下列溶液中粒子的物质的量浓度关系正确的是( )
A.01/LNHO3溶液与01/LNOH溶液等体积混合,所得溶液中:
c(N+)>c(O32﹣)>c(HO3﹣)>c(OH﹣)
B.20L01/LH3OON溶液与10L01/LH溶液混合后溶液呈酸性,所得溶液中:
c(H3OO﹣)>c(﹣)>c(H3OOH)>c(H+)
.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:
c(﹣)+c(H+)>c(NH4+)+c(OH﹣)
D.01/LH3OOH溶液与01/LNOH溶液等体积混合,所得溶液中:
c(OH﹣)>c(H+)+c(H3OOH)
13.(2014•天津)下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1的NHSO4溶液:
c(H+)=c(SO42﹣)+c(OH﹣)
B.含有Ag和AgI固体的悬浊液:
c(Ag+)>c(﹣)=c(I﹣)
.O2的水溶液:
c(H+)>c(HO3﹣)=2c(O32﹣)
D.含等物质的量NH2O4和N22O4的溶液:
3c(N+)=2[c(H2O4﹣)+c(2O42﹣)+c(H22O4)]
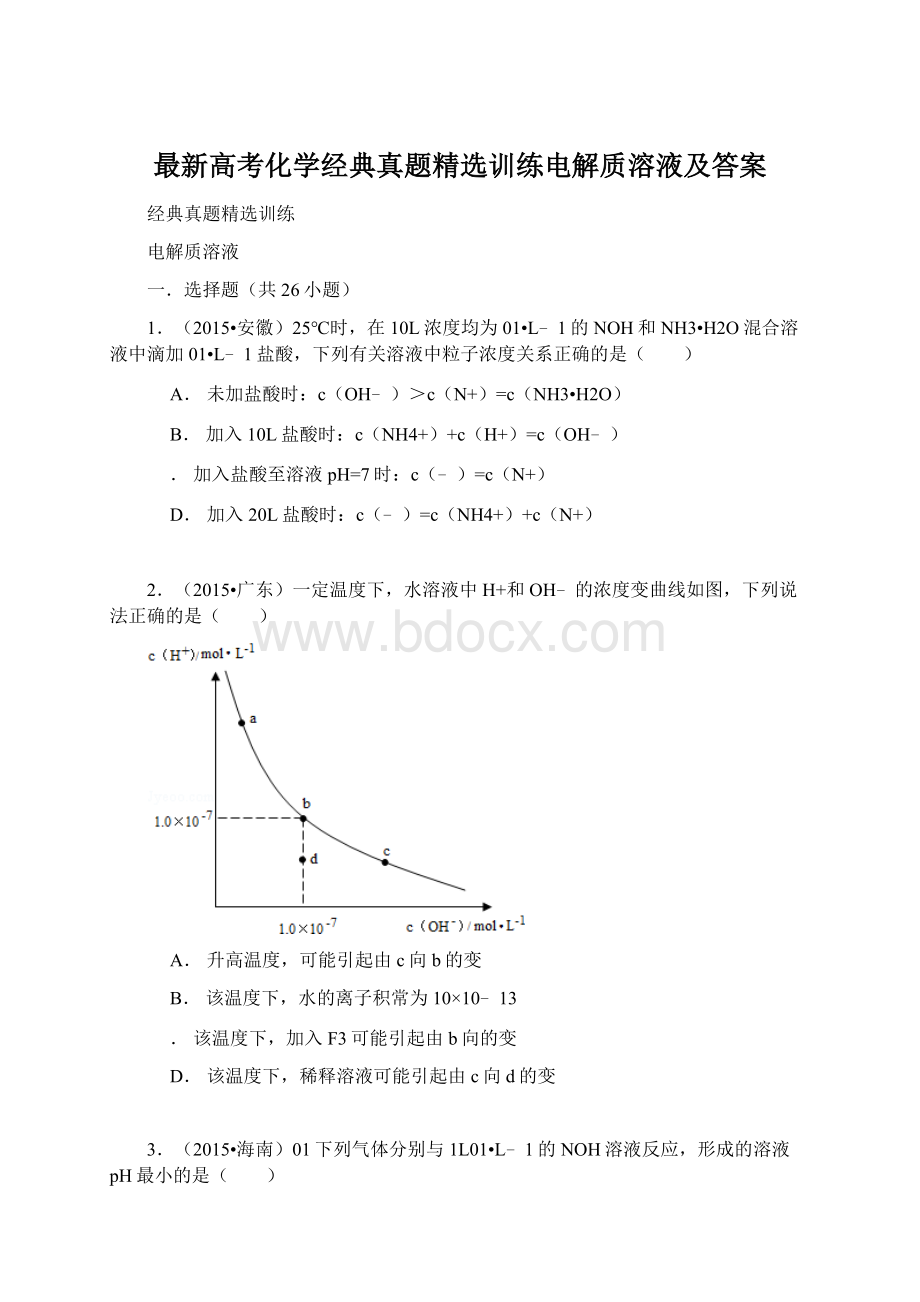
14.(2014•广东)常温下,02/L的一元酸HA与等浓度的NOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
A.HA为强酸
B.该混合液pH=7
.图中表示HA,Y表示OH﹣,表示H+
D.该混合溶液中:
c(A﹣)+c(Y)=c(N+)
15.(2014•山东)已知某温度下H3OOH和NH3•H2O的电离常相等,现向10L浓度为01•L﹣1的H3OOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.
先增大再减小
.c(H3OOH)与c(H3OO﹣)之和始终保持不变
D.当加入氨水的体积为10L时,c(NH4+)=c(H3OO﹣)
16.(2014•广东)水溶液中能大量共存的一组离子是( )
A.N+、2+、﹣、SO42﹣B.F2+、H+、SO32﹣、O﹣
.Mg2+、NH4+、﹣、SO42﹣D.+、F3+、NO3﹣、SN﹣
17.(2014•安徽)下列有关F2(SO4)3溶液的叙述正确的是( )
A.该溶液中,+、F2+、6H5OH、Br﹣可以大量共存
B.和I溶液反应的离子方程式:
F3++2I﹣═F2++I2
.和B(OH)2溶液反应的离子方程式:
F3++SO42﹣+B2++3OH﹣═F(OH)3↓+BSO4↓
D.1LO1•L﹣1该溶液和足量的充分反应,生成112gF
18.(2013•重庆)下列说法正确的是( )
A.O3和SO3溶于水后能导电,故O3和SO3为电解质
B.25℃时,用醋酸溶液滴定等浓度NOH溶液至pH=7,V醋酸<VNOH
.向NAO2溶液中滴加NHO3溶液,有沉淀和气体生成
D.Ag沉淀易转为AgI沉淀且(Ag)=c(Ag+)•c(﹣),故(AgI)<(Ag)
19.(2013•天津)下列有关电解质溶液的说法正确的是( )
A.在蒸馏水中滴加浓H2SO4,不变
B.O3难溶于稀硫酸,也难溶于醋酸
.在N2S稀溶液中,c(H+)=c(OH﹣)﹣2c(H2S)﹣c(HS﹣)
D.N溶液和H3OONH4溶液均显中性,两溶液中水的电离程度相同
20.(2012•天津)下列单质或合物性质的描述正确的是( )
A.NHSO4水溶液显中性
B.SO2与酸、碱均不反应
.NO2溶于水时发生氧还原反应
D.F在足量2中燃烧生成F2和F3
21.(2012•浙江)下列说法正确的是( )
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NHA溶液的pH.若pH>7,则H2A是弱酸;
若pH<7,则H2A是强酸
.用02000/LNOH标准溶液滴定H与H3OOH的混合溶液(混合液中两种酸的浓度均约为01/L),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯银固体分别放入相同体积的①蒸馏水、②01/L盐酸、③01/L氯镁溶液、④01/L硝酸银溶液中,Ag+浓度:
①>④=②>③
22.(2012•上海)水中加入下列溶液对水的电离平衡不产生影响的是( )
A.NHSO4溶液B.F溶液.A(SO4)2溶液D.NI溶液
23.(2012•江苏)常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.01•L﹣1NOH溶液:
+、N+、SO42﹣、O32﹣
B.01•L﹣1N2O3溶液:
+、B2+、NO3﹣、﹣
.01•L﹣1F3溶液:
+、NH4+、I﹣、SN﹣
D.c(H+)/c(OH﹣)=1×
1014的溶液:
2+、N+、O﹣、NO3﹣
24.(2011•福建)常温下01•L﹣1醋酸溶液的pH=,下列能使溶液pH=(+1)的措施是( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
.加入等体积02•L﹣1盐酸
D.提高溶液的温度
25.(2011•四川)25℃在等体积的①pH=0的H2SO4溶液,②005•L﹣1的B(OH)2溶液,③pH=10的N2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1:
10:
1010:
109B.1:
5:
5×
109:
109
.1:
20:
109D.1:
104:
考点:
弱电解质在水溶液中的电离平衡;
真题集萃.
分析:
氢氧钠为强碱,在水溶液中完全电离,一水合氨为弱碱,在水溶液中部分电离,相同体积与浓度的氢氧钠与一水合氨其中和能力是相同的,据此分析解答即可.
解答:
解:
A、NOH和NH3•H2O混合溶液中,NOH完全电离,NH3•H2O部分电离,因此c(OH﹣)>01/L,c(N+)=01/L,c(NH3•H2O)<01/L,故c(OH﹣)>c(N+)>c(NH3•H2O),故A错误;
B、在此混合溶液中加入10L盐酸,存在电中性原则:
c(NH4+)+c(H+)+c(N+)=c(OH﹣)+c(﹣),由于等体积等浓度混合,故c(N+)=c(﹣),即c(NH4+)+c(H+)=c(OH﹣),故B正确;
、加入盐酸至pH=7时,溶液呈中性,即c(H+)=c(OH﹣),那么c(NH4+)+c(N+)=c(﹣),即c(﹣)>c(N+),故错误;
D、加入20L盐酸时,此时溶液恰好为氯钠与氯铵的混合溶液,此时溶液呈酸性,即存在c(H+)>c(OH﹣),那么c(NH4+)+c(N+)<c(﹣),故D错误,故选B.
点评:
本题主要考查酸碱混合的定性判断,题目难度中等,本题注意把握弱电解质的电离特点,易错点为,注意酸碱中和滴定的实验原.
水的电离;
弱电解质在水溶液中的电离平衡.
A、由图可知bc为等温线;
B、由b点计算此温度下水的离子积常为10×
10﹣14;
、b点到点,氢离子浓度变大,氢氧根离子浓度减小,据此解答即可;
D、稀释不会引起水的离子积的改变,据此解答即可.
A、由图可知bc三点对应的平衡常不变,故bc为等温线,故升高温度,不能由c到b,故A错误;
B、b点c(H+)=c(OH﹣)=10×
10﹣7,故W=10×
10﹣7×
10×
10﹣7=10×
10﹣14,故B错误;
、加入F3,氯铁为强酸弱碱盐,铁离子结合水电离出的氢氧根,促进水的电离平衡右移,即氢离子浓度增大,氢氧根离子浓度减小(由b到),符合图象变趋势,故正确;
D、由c点到d点,水的离子积常减小,温度不变,不变,故不能利用稀释使其形成此变,故D错误,
故选.
本题主要考查的是水的离子积常以及水电离的影响因素,掌握水的离子积为温度的函是解决本题的关键,难度不大.
pH的简单计算.
01下列气体分别与1L01•L﹣1的NOH溶液反应,二者的物质的量相同,
NO2与NOH等物质的量反应的方程式为:
2NO2+2NOH=NNO2+NNO3+H2O;
SO2与NOH等物质的量反应的方程式为NOH+SO2=NHSO3;
SO3与NOH等物质的量反应的方程式为NOH+SO3=NHSO4;
O2与NOH等物质的量反应的方程式为NOH+O2=NHO3,根据反应产物的酸碱性判断.
01下列气体分别与1L01•L﹣1的NOH溶液反应,二者的物质的量相同,
2NO2+2NOH=NNO2+NNO3+H2O,NNO2为强碱弱酸盐,溶液显碱性;
SO2与NOH等物质的量反应的方程式为NOH+SO2=NHSO3,NHSO3在溶液中即电离又水解,电离程度大于水解程度,溶液显弱酸性;
SO3与NOH等物质的量反应的方程式为NOH+SO3=NHSO4,NHSO4在溶液中完全电离出氢离子,溶液显强酸性;
O2与NOH等物质的量反应的方程式为NOH+O2=NHO3,NHO3在溶液中即电离又水解,水解程度大于电离程度,溶液显弱碱性;
综上可知,形成的溶液pH最小的是SO3;
故选:
.
本题考查了物质的性质,题目涉及元素合物的性质、盐的水解、弱电解质的电离,题目难度中等,注意根据物质之间反应判断产物以及溶液的酸碱性.
盐类水解的原.
专题:
盐类的水解专题.
A.根据=c(H+)×
c(OH﹣)=10×
10﹣14计算;
B.根据物料守恒即c(N)=c()分析;
.根据电荷守恒分析;
D.铵根离子部分水解,则c(﹣)>c(NH4+),HO3﹣的电离程度很小.
A.=c(H+)×
10﹣14,已知pH<7,即c(H+)>10×
10﹣7/L,则
10﹣7/L,故A正确;
B.溶液中存在物料守恒即c(N)=c(),所以c(N+)=c(HO3﹣)+c(O32﹣)+c(H2O3),故B正确;
.溶液中存在电荷守恒:
c(N+)+c(H+)+c(NH4+)=c(OH﹣)+c(HO3﹣)+2c(O32﹣)+c(﹣),由于析出部分NHO3晶体,则c(N+)<c(﹣),所以c(H+)+c(NH4+)>c(OH﹣)+c(HO3﹣)+2c(O32﹣),故错误;
D.铵根离子部分水解,则c(﹣)>c(NH4+),由于析出部分NHO3晶体,则HO3﹣浓度减小,HO3﹣的电离程度很小,所以c(O32﹣)最小,即c(﹣)>c(NH4+)>c(HO3﹣)>c(O32﹣),故D正确.
本题考查了混合溶液中离子浓度的计算、离子浓度大小比较、电荷守恒和物料守恒的应用,题目难度中等,注意把握电荷守恒和物料守恒的应用方法.
离子共存问题.
离子反应专题.
根据离子之间不能结合生成沉淀、气体、水等,不能相互促进水解等,则离子大量共存,以此解答.
A.B2+、O32﹣结合生成沉淀,不能大量共存,故A错误;
B.SO32﹣、H+结合生成水和气体,不能大量共存,故B错误;
.该组离子之间不反应,可大量共存,故正确;
D.H+、HO3﹣结合生成水和气体,不能大量共存,故D错误;
本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、水解反应的离子共存考查,题目难度不大.
离子共存问题;
离子方程式的书写.
A.该组离子之间不反应,与硫酸铜也不反应;
B.通入O2气体,与硫酸铜溶液不反应;
.H2S在离子反应中保留式;
D.与过量浓氨水反应,生成络离子.
A.该组离子之间不反应,与硫酸铜也不反应,则可大量共存,故A正确;
B.通入O2气体,与硫酸铜溶液不反应,不能生成蓝色沉淀,故B错误;
.H2S在离子反应中保留式,则与H2S反应的离子方程式为2++H2S=S↓+2H+,故错误;
D.与过量浓氨水反应,生成络离子,则离子反应为2++4NH3•H2O=[(NH3)4]2++4H2O,故D错误;
故选A.
本题考查离子共存及离子反应,为高频考点,为2015年高考真题,把握常见离子之间的反应为解答的关键,侧重复分解反应及络合反应的离子反应考查,题目难度不大.
溶液无色,则一定不存在有色的F3+;
在其中加入金属铝,发生反应并放出H2,溶液可能呈酸性,也可能呈碱性,若为酸性,则不存在OH﹣、NO3﹣、O32﹣,若呈碱性,则不存在A3+、H+、NH4+、F3+,以此解答该题.
无色溶液中一定不存在有色的F3+;
溶液中加入金属铝,发生反应并放出H2,溶液可能呈酸性,也可能呈碱性,
若溶液为酸性,则不存在:
OH﹣、NO3﹣、O32﹣,阴离子只能为﹣,阳离子可以为:
H+、NH4+、B2+、A3+,最多存在5种离子;
若呈碱性,则不存在A3+、H+、NH4+、F3+,阳离子只能为B2+,则一定不存在O32﹣,可存在的离子为:
B2+、﹣、OH﹣、NO3﹣,则最多只有4种,
根据分析可知,最多存5种离子,
本题考查离子共存问题,题目难度中等,涉及离子反应和种类的判断,综合侧重于生的分析能力的考查,注意把握题目无色以及与铝反应生成氢气的特点,特别注意硝酸不能生成氢气.
不同晶体的结构微粒及微粒间作用力的区别.
元素及其合物.
A.水能够部分电离出氢离子和氢氧根离子,存在电离平衡;
B.可燃冰为甲烷和水形成的一种合物;
.氢氧两种元素还可以组成双氧水;
D.液体水变成冰,体积变大,密度变小.
A.水为极弱的电解质,能够部分电离出氢离子和氢氧根离子,故A正确;
B.可燃冰为甲烷和水形成的一种特殊的合物,并不是可燃烧的水,故B错误;
.氢氧两种元素可以组成水、双氧水,故错误;
D.冰中存在氢键,具有方向性和饱和性,其体积变大,则相同质量时冰的密度比液态水的密度小,故D错误;
本题考查了水的电离、水的组成结构及性质,题目难度不大,注意掌握水的电离,明确可燃冰的组成及性质,试题培养了生灵活应用所知识的能力.
影响盐类水解程度的主要因素;
难溶电解质的溶解平衡及沉淀转的本质.
电离平衡与溶液的pH专题;
盐类的水解专题.
A、浓氨水和氯铁之间会发生复分解反应;
B、醋酸钠中加入盐酸会发生反应生成醋酸和氯钠;
、(HO3)2溶液与过量NOH溶液反应产物是碳酸钙和碳酸钠;
D、根据沉淀溶解平衡的影响因素回答判断.
A、浓氨水和氯铁之间会发生复分解反应生成氢氧铁沉淀和氯铵,不会获得胶体,故A错误;
B、醋酸钠中加入盐酸会发生反应生成醋酸和氯钠,所以醋酸根离子浓度会减小,故B错误;
、(HO3)2溶液与过量NOH溶液反应产物是碳酸钙和碳酸钠,并不会获得氢氧钙,故错误;
D、氢氧铜存在沉淀溶解平衡(OH)2⇌2++2OH﹣,(NO3)2溶液中铜离子会抑制沉淀溶解平衡的右移,所以(OH)2在水中的溶解度大于其在(NO3)2溶液中的溶解度,故D正确.
故选D.
本题考查生物质的性质以及沉淀溶解平衡的影响因素等方面的知识,注意知识的归纳和整是解题关键,难度中等.
难溶电解质的溶解平衡及沉淀转的本质.
物质的量浓度和溶解度专题.
加入2,与水发生2+2H2O=(OH)2+H≡H↑,反应消耗水,结合(OH)2()⇌2+(q)+2OH﹣(q)的影响因素解答.