影响ELISA试验效果常见问题原因分析及解决办法.docx
《影响ELISA试验效果常见问题原因分析及解决办法.docx》由会员分享,可在线阅读,更多相关《影响ELISA试验效果常见问题原因分析及解决办法.docx(40页珍藏版)》请在冰豆网上搜索。
影响ELISA试验效果常见问题原因分析及解决办法
影响ELISA试验效果常见问题原因分析及解决办法
影响ELISA试验效果常见问题原因分析及解决办法
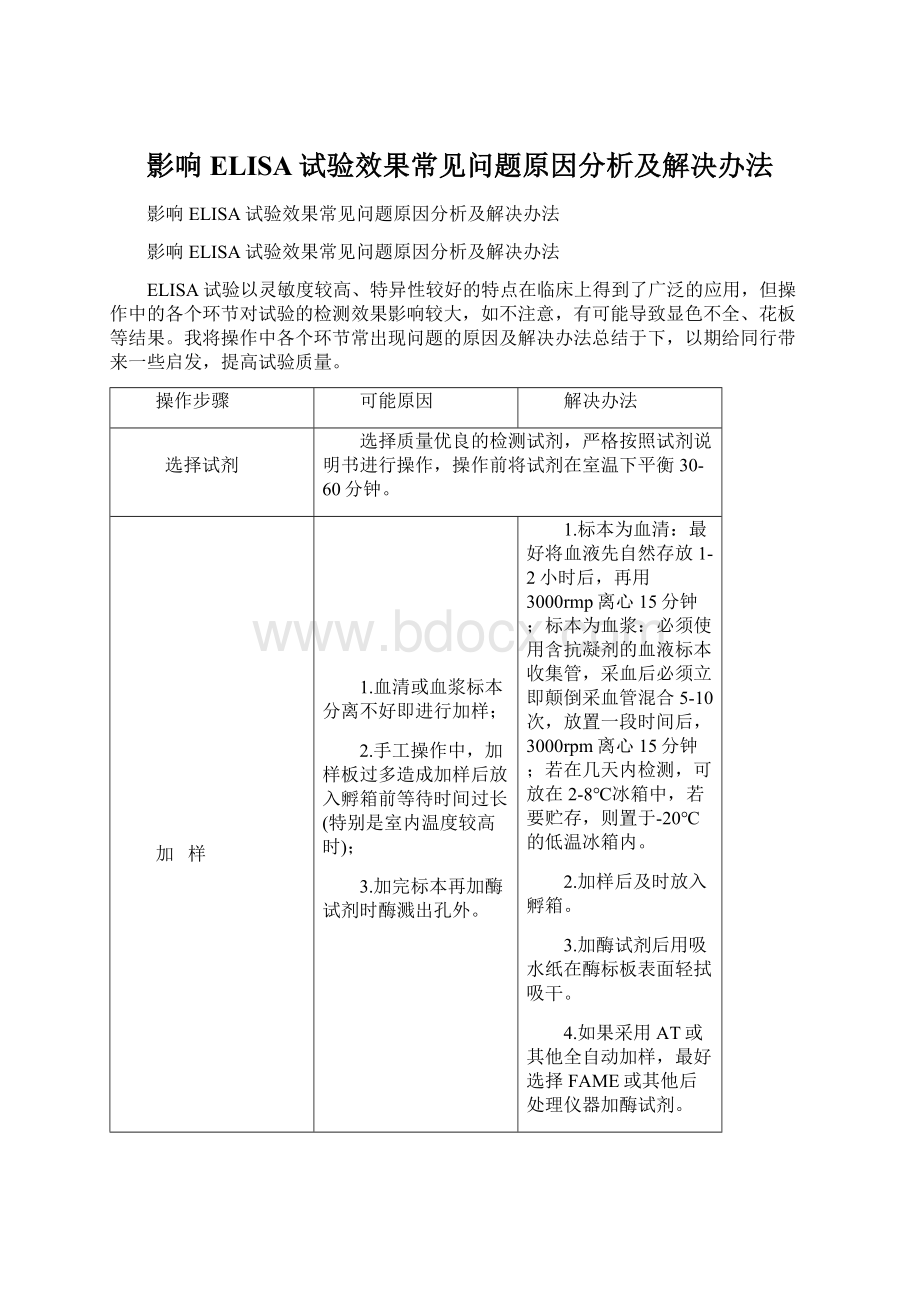
ELISA试验以灵敏度较高、特异性较好的特点在临床上得到了广泛的应用,但操作中的各个环节对试验的检测效果影响较大,如不注意,有可能导致显色不全、花板等结果。
我将操作中各个环节常出现问题的原因及解决办法总结于下,以期给同行带来一些启发,提高试验质量。
操作步骤
可能原因
解决办法
选择试剂
选择质量优良的检测试剂,严格按照试剂说明书进行操作,操作前将试剂在室温下平衡30-60分钟。
加 样
1.血清或血浆标本分离不好即进行加样;
2.手工操作中,加样板过多造成加样后放入孵箱前等待时间过长(特别是室内温度较高时);
3.加完标本再加酶试剂时酶溅出孔外。
1.标本为血清:
最好将血液先自然存放1-2小时后,再用3000rmp离心15分钟;标本为血浆:
必须使用含抗凝剂的血液标本收集管,采血后必须立即颠倒采血管混合5-10次,放置一段时间后,3000rpm离心15分钟;若在几天内检测,可放在2-8℃冰箱中,若要贮存,则置于-20℃的低温冰箱内。
2.加样后及时放入孵箱。
3.加酶试剂后用吸水纸在酶标板表面轻拭吸干。
4.如果采用AT或其他全自动加样,最好选择FAME或其他后处理仪器加酶试剂。
5.标本较多时,请分批操作。
孵 育
1.孵育时未贴封片或加盖,使标本或稀释液蒸发,吸附于孔壁,难于清洗彻底;
2.孵育时间人为延长,导致非特异性结合紧附于反应孔周围,难以清洗彻底。
1.贴封片或加盖;
2.按说明步骤严格控制操作时间。
洗 板
1.采用手工洗板,孔与孔之间液体交叉。
2.采用半自动洗板机洗板时,洗液量不足,导致洗板不彻底;洗板针堵塞,抽吸不完全;洗板不畅,导致洗板效果差。
3.反应板过多造成洗板等待时间长。
1.保证洗液注满各孔,洗板针畅通,洗完板后最好在吸水纸(选择干净、无或少尘的吸水材料)上轻轻拍干;
2.合理安排,或多用几台洗板机。
显 色
1.显色剂配制后放置时间过长或使用过期显色剂;
2.加显色剂时溅出孔外造成液体回流。
1.显色剂尽量在临用前配制,坚持不用过期显色剂,肉眼可见浅蓝色的TMB显色剂不用;
2.加样时保持显色剂不外流;
3.A、B液应避免接触金属器械。
终 止
加终止液时产生较多气泡,导致假阳性增加。
加终止液时应避免产生气泡。
读 板
读板时板底不清洁。
应保证酶标板清洁。
全过程
1.整个操作过程中保证酶标板不接触次氯酸;
2.实现ELISA检测标准自动化,有效提高检测质量。
在实际操作中,除了选择优良试剂外,必须严格按照操作步骤进行操作,同时作好室内质控、室间质评,以严谨的工作作风检测每一份标本,才能保证检测质量。
现在国内已有相当数量的单位拥有全自动酶标仪,这对于实现ELISA标准化检测、提高检测质量起到了重要作用。
ELISA技术讲座一-抗原与抗体的反应
1.2 抗体
1.2.1 抗体的结构
抗体是能与抗原特异性结合的免疫球蛋白(immunoglobulin,Ig)。
Ig分五类,即IgG、IgA、IgM、IgD和IgE。
与免疫测定有关的Ig主要为IgG和IgM。
Ig由两个轻链(L)和两个重链(H)的单体组成。
Ig的轻链是相同的,有κ(kappa)和λ(Lambda)两种型别。
五类Ig的重链结构不同,这决定了它们的抗原性也不同。
IgG和IgM的重链分别称为γ(gamma)链和μ(mu)链。
IgG的结构见图。
①木瓜酶裂解部位 ②胃蛋白酶裂解部位
重链和轻链的N端的氨基酸排列顺序因各种抗体而异,称为可变区,分别用VH和VL表示。
两者构成抗体的抗原结合部位,只与相应的抗原决定簇匹配,发生特异性结合(见图),是抗体专一性结合抗原的结构基础。
IgG可被木瓜蛋白酶分解为三个区段,其中两个相同的区段称抗原结合片段(Fab)。
每个Fab都保存结合抗原的能力,但只有一个抗原结合位点,是单价的,与抗原结合后不出现凝集或沉淀。
另一区段称Fc段,无抗体活性,但具有IgG特有的抗原性。
IgG可被胃蛋白酶分解为两个片段,一个Fab双体,称F(ab')2,能和两个相同的抗原结合;另一片段类似Fc,随后被分解成小分子多肽,无生物活性。
IgM是由五个单体组成的五聚体,含10个重链和10个轻链,具有10个抗原结合价,由于空间位置的影响,只表现为五个抗原结合价。
IgM分子量约为900000,IgG分子量约为150000。
机体被微生物感染后,先产生IgM抗体,然后产生IgG抗体。
经过一段时间,IgM抗体量逐渐减少而消失,而IgG抗体可长期存在,在疾病痊愈后可持续数年之久。
IgM抗体一般为保护性抗体具有免疫性。
因此IgM抗体的测定,对某些传染病如甲型肝炎有较高的临床诊断价值。
右图为为甲型肝炎病人血清中IgG抗体和IgM抗体出现的时间和水平。
1.3 抗原抗体反应
1.3.1 可逆性
抗原与抗体结合形成抗原抗体复合物的过程是一种动态平衡,其反应式为:
Ag+Ab→Ag·Ab
抗体的亲和力(affinity)是抗原抗体间的固有结合力,可以用平衡常数K表示:
K=[Ag·Ab]/[Ag][Ab]
Ag·Ab的解离程度与K值有关。
高亲和力抗体的抗原结合点与抗原的决定簇在空间构型上非常适合,两者结合牢固,不易解离。
解离后的抗原或抗体均能保持原有的结构和活性,因此可用亲和层析法来提纯抗原或抗体。
在抗血清中,特异性的IgG抗体仅占总IgG中的极小部分。
用亲和层析法提取的特异性抗体,称为亲和层析纯抗体,应用于免疫测定中可得到更好的效果。
1.3.2 最适比例
在恒定量的抗体中加入递增量的抗原形成抗体复合物(沉淀)的量见图1-4。
曲线的高峰部分是抗原抗体比例最合适的范围,称为等价带(zoneofequivalence)。
在等价带前后分别为抗体过剩带和抗原过剩带。
如果抗原或抗体极度过剩,则无沉淀物形成,在免疫测定中称为带现象(zonephenomenon)。
抗体过量称为前带(prezone),抗原地过量称为后带(postzone)。
在用免疫学方法测定抗原时,应使反应系统中有足够的抗体量,否则测得的量会小于实际含量,甚至出现假阴性。
1.3.3 特异性
抗原抗体的结合实质上只发生在抗原的抗原决定簇与抗体的抗原结合位点之间。
由于两者在化学结构和空间构型上呈互补关系,所以抗原抗体反应具有高度的特异性。
例如乙肝病毒中的表面抗原(HBsAg)、e抗原(HBeAg)和核心抗体(HBcAg),随来源于同一病毒,但仅与其相应的抗体结合,而不与另外两种抗体反应。
抗原抗体反应的这种特异性使免疫测定能在一非常复杂的蛋白质化合物(例如血清)中测定某一特定的物质,而不需先分离待检物。
但是这种特异性也不是绝对的。
假使两种化合物有着部分相同的结构,在抗原抗体反应中可出现交叉反应。
例如:
绒毛膜促性腺激素(hCG)和黄体生成激素(LH)均由α和β两个亚单位组成,其结构的不同处在β亚单位,而两者的α亚单位是同类的。
用hCG免疫动物所得的抗血清中含有抗α-hCG和抗β-hCG两种抗体,抗α-hCG抗体将与LH中的
α酶位发生交叉反应。
在临床检验中,如用抗hCG抗血清作为妊娠诊断试剂检定尿液中hCG,只能用于hCG浓度较高的试验,否则妇女生理性排泄入尿液中的微量LH将与之发生交叉反应。
因此在作为早孕诊断(敏感度应达到50mIu/mlhCG)的实际中必须应用只对hCG特异的抗β-hCG,以避免与其它激素的交叉反应的发生。
1.3.4 敏感性
在测定血清中某一物质的含量时,化学比色法的敏感度为mg/ml水平,酶反应测定法的敏感度约为5~10μg/ml,免疫测定中凝胶扩散法和浊度法的敏感度与酶反应法相仿。
标记的免疫测定的敏感度可提高数千倍,达ng/ml水平。
例如,用放射免疫测定法或酶免疫测定法测定HBsAg,其敏感度可达0.1ng/ml。
1.4 免疫测定在临床检验中的应用
由于各种抗原成份,包括小分子的半抗原,均可用以制备特异性的抗血清或单克隆抗体,利用此抗体作为试剂就可检测标本中相应的抗原,因此免疫测定的应用范围极广,在临床检验中可用于测定:
1)体液中的各种蛋白质,包括含量极少的蛋白质如甲胎蛋白等。
2)激素,包括小分子量的甾体激素等。
3)抗生素和药物。
4)病原体抗原,HBsAg、HBeAg等。
5)另外,也可利用纯化的抗原检测标本中的抗体,例如抗-HBs等。
5.标记的免疫测定
如上所述,免疫测定是一种很敏感的测定方法,抗原抗体反应后直接测定形成的沉淀或浊度,敏感度可达5~10μg/ml,但在临床检验中,某些待测物在标本中的含量远低于这一水平,因此要寻找增加敏感度的方法。
标记的免疫测定是将检测试剂中的抗原或抗体用可微量测定的物质加以标记,通过测定标记物来提高敏感度。
在放射免疫测定和酶免疫测定中,标记物分别为放射性核素和酶,最后用测定放射性和酶活力来计算待检物的量,敏感度可比直接测定沉淀物提高数百至数千倍。
在标记免疫测定中,一般加入过量的标记试剂以保证与待测物彻底反应。
以标记抗体(Ab※)检测抗原(Ag)为例,反应式如下:
Ag+Ab※→AgAb※+Ab※
在反应产物中有与Ag结合的Ab※和游离和Ab※,如不将两者分离而测定标记物,测得的结果将为两者之和。
因此,游离标记物与结合标记物的分离是标记免疫测定中的重要步骤。
可采用多种手段,固相载体是其中之一。
如将抗原或抗体包被在固相载体上,然后再与标记的抗原或抗体直接反应,结合的标记物被固定在载体上,而游离的标记物留于溶液中。
这样可以通过洗涤将游离的Ab※除去,结合标记物的测定可在固相上进行。
6.酶免疫测定
酶免疫测定(enzymeimmunoassay)可分为均相(homogenous)和非均相(heterogenous)两种类型。
在均相EIA中可不需进行游离的和结合的标记物的分离而直接测定标记物。
例如在某种条件下,抗原抗体反应后形成的酶标记抗原抗体复合物中的酶失去其对底物作用的活力,因而测出的酶活力直接反映游离的酶标记物。
均相EIA在临床检验中较少应用。
非均相EIA需先进行游离的和结合的标记物的分离。
如前所述,固相载体可用作一种分离手段。
这种固相酶免疫测定方法在1971年最初建立时称为酶联免疫吸附剂测定(enzymelinkedimmunosorbentassay),简称ELISA,在国内有译作酶联免疫吸附试验的,虽然含义不完全确切,但已习用。
ELISA技术讲座二-原理与分类
ELISA的原理和类型
1. ELISA的原理
ELISA的基础是抗原或抗体的固相化及抗原或抗体的酶标记。
结合在固相载体表面的抗原或抗体仍保持其免疫学活性,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。
在测定时,受检标本(测定其中的抗体或抗原)与固相载体表面的抗原或抗体起反应。
用洗涤的方法使固相载体上形成的抗原抗体复合物与液体中的其他物质分开。
再加入酶标记的抗原或抗体,也通过反应而结合在固相载体上。
此时固相上的酶量与标本中受检物质的量呈一定的比例。
加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,故可根据呈色的深浅进行定性或定量分析。
由于酶的催化效率很高,间接地放大了免疫反应的结果,使测定方法达到很高的敏感度。
2. ELISA的类型
ELISA可用于测定抗原,也可用于测定抗体。
在这种测定方法中有三个必要的试剂:
(1)固相的抗菌素原或抗体,即"免疫吸附剂"(immun