3碱Word文档下载推荐.docx
《3碱Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《3碱Word文档下载推荐.docx(16页珍藏版)》请在冰豆网上搜索。
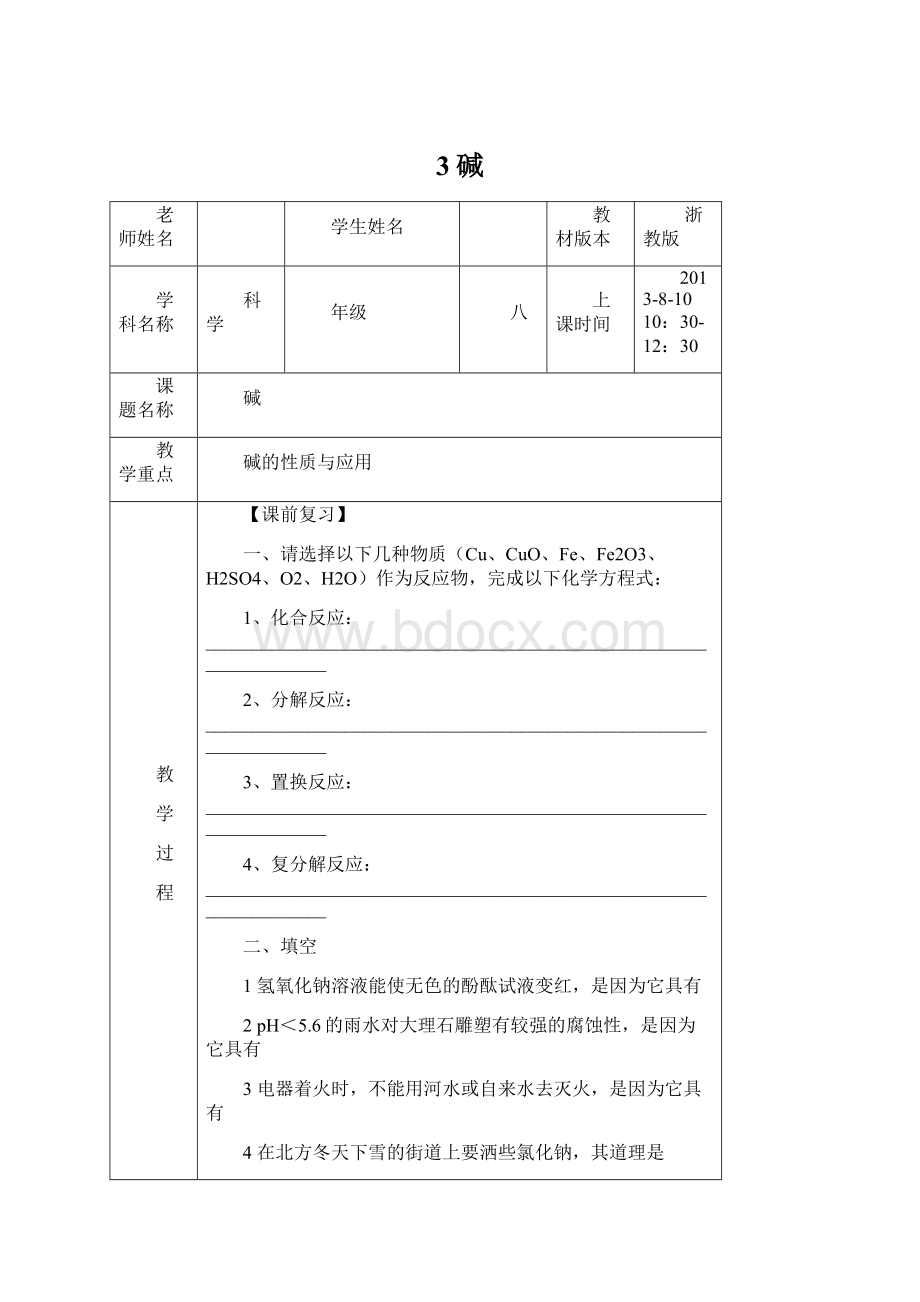
在稀释浓硫酸时,一定要把慢慢注入,且用玻璃棒不断搅拌。
⑦构建知识网络是一种重要的学习方法。
下图是关于盐酸化学性质的知识网络,“——”表示相连的两种物质能发生反应,“”表示一种物质转化成另一种物质,A、C属于不同类别的化合物。
请完善这个知识网络:
(1)写出A、B、C的化学式:
A;
B;
C。
(2)试写出HCl→B的复分解反应化学方程式:
。
【知识梳理】
碱的概念:
电离时生成的阴离子全部是氢氧根离子的化合物叫碱。
氢氧化钠(NaOH)
氢氧化钙(Ca(OH)2)
俗名
烧碱、火碱、苛性钠
熟石灰、消石灰
物
理
性
质
颜色、状态
白色固体
白色粉末状固体
溶解性
易溶于水、并放出大量的热
微溶于水、溶解度随温度的升高而减小
潮解
在空气中吸收水分(可作干燥剂)、潮解
能吸收少量水分
腐蚀性
强烈腐蚀性
用途
化工原料:
用于肥皂、石油、造纸、纺织、印染等工业
建筑业:
制三合土、抹墙;
农业上改良酸性土壤、配置波尔多液;
制取NaOH
制取
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
CaO+H2O=Ca(OH)2
2、中和反应
(1)中和反应:
酸与碱作用生成盐和水的反应
注意:
反应物只能是酸与碱
(2)酸与碱的反应碱+酸→盐+水中和反应
HCl+NaOHNaCl+H2O2HCl+Ca(OH)2CaCl2+2H2O
(3)实质:
OH-+H+==H2O
(4)盐:
能解离出金属离子(或NH4+)和酸根离子的化合物
(5)中和和反应的应用:
A:
改变土壤的酸碱性。
例如:
如果土壤显酸性,则加熟石灰中和;
如果土壤显碱性则加碳酸水中和
B:
处理工厂的废水。
例如用熟石灰中和硫酸厂的污水(含有硫酸等杂质)
C:
用于医药。
用胃舒平(含氢氧化铝)来医治胃酸(盐酸)过多;
当我们不小心被黄蜂刺了(呈碱性)可以用食醋涂在皮肤上;
被蚊虫叮咬(分泌出蚁酸)涂上些含有碱性物质(如氨水、肥皂)的药水。
3、碱的通性
碱电离出的阴离子全是
离子。
碱与酸碱指示剂反应。
碱溶液能使紫色石蕊变蓝,使无色酚酞变红。
碱与非金属氧化物反应。
碱+废金属氧化物
盐+水
(1)氢氧化钙与二氧化碳反应:
向一支盛有澄清石灰水的试管中通入
,可观察到澄清石灰水变浑浊,在化学上常利用这一现象来检验
气体的存在,反应的化学方程式为:
_________________________________________
(2)氢氧化钠与二氧化硫反应:
反应的化学方程式为:
________________________________,工业上常用碱液来吸收有毒的
气体。
碱与酸反应。
碱+酸
⑤碱与某些盐的反应。
可溶性的碱+盐
不可溶的碱+新盐。
只有可溶性或微溶性的碱溶液才能使指示剂变色,不溶于水的碱则不能使指示剂变色。
如:
、
。
常见的可溶性的碱有:
(微溶)、
碱与某些盐反应时,碱和盐都必须是可溶的。
【典型例题】
1、NaOH固体和Ca(OH)2粉末都是色物质,NaOH溶于水,Ca(OH)2溶于水;
NaOH固体必需密封保存的原因是:
不但吸收空气中的、还能吸收空气中的并与之反应。
【例】下列气体可用NaOH固体来干燥的气体有()
A、SO2B、O2C、HClD、NH3
2、NaOH的俗名有、、;
Ca(OH)2的俗名有、
;
Ca(OH)2溶液的俗名;
这两种溶液都具有腐蚀性。
碳酸钠的俗名是,其水溶液的pH7。
中和酸性土壤常用的碱是,中和过多胃酸常用的碱是。
中国著名的制碱专家创造出制造的“联合制碱法”。
3、NaOH溶液和Ca(OH)2溶液的化学性质:
(1)与指示剂的反应:
能使紫色的石蕊试液变,使无色的酚酞试液变;
(2)与非金属氧化物反应:
CO2与NaOH溶液的反应:
CO2与Ca(OH)2溶液的反应:
CO2与Ba(OH)2溶液的反应
思考:
①你认为以上溶液中哪些可用来吸收CO2?
哪些溶液的吸收效果会更好?
②你认为以上溶液中哪些可用来鉴定CO2?
③既鉴定CO2又对CO2有良好的吸收效果的是哪种溶液?
(3)与酸的反应
①中和反应是指。
②向NaOH溶液中滴加稀HCl:
随着稀盐酸的滴加量讨论以下问题
溶液pH的变化:
。
溶液颜色的变化:
溶液中溶质的种类:
溶液温度的变化:
(4)与某些盐溶液的反应
氢氧化钠溶液与硫酸铜溶液的反应:
石灰水与纯碱溶液的反应:
验证氢氧化钠溶液中含有少量的Na2CO3,可用的试剂有:
酸;
碱;
盐。
【例】用来鉴别石灰水和NaOH溶液的物质是()
A、二氧化碳B、稀盐酸C、碳酸钠溶液D、氯化钡溶液
【课堂巩固】
1、有甲、乙、丙三种溶液,甲溶液是氯化物,乙溶质是碱,并的溶质是钠盐。
观察三种溶液进行实验,其实验顺序,内容和现象如下表:
根据右表实验推断:
(1)甲的溶质是,乙的溶质是,丙的溶质是。
(2)写出实验中涉及的化学方程式。
实验顺序
实验内容
实验现象
1
甲+乙
生成蓝色沉淀
2
甲+丙
不发生反应
3
乙+丙
生成不溶于稀硝酸的白色沉淀
2.某同学发现金属眼镜架表面经常会有绿色物质产生,这是什么物质呢?
他和同学们收集积累了一定量的这种绿色物质,放在试管里隔绝空气加热。
观察到试管内壁有水珠,绿色物质变成黑色粉末,产生的气体能够使澄清石灰水变浑浊。
(1)实验表明:
镜架上的绿色物质中一定含有元素。
镜架上会产生绿色的锈,这绿色物质中是否含有铜呢?
同学们用上述试管中的黑色粉末分两组分别进行了实验:
(2)大部分同学认为第一组实验方法比较理想,试简要说明理由。
3.右图“五连环”中的每一环表示一种物质,在一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应。
请回答:
(1)A、B、C、D分别是铁、氧气、二氧化碳、氯化钡溶液、氢氧化钠溶液中的一种物质。
若A为氧气,则D的化学式为;
(2)“五连环”中物质A与物质C发生反应的化学反应方程式为。
4.某校科学兴趣小组为测定某样品中氯化铵的质量分数,将6g样品溶于18g水后,再加入7.6g氢氧化钠浓溶液共热,两者恰好完全反应(样品中的杂质不与氢氧化钠反应,也不溶于水,氯化铵与氢氧化钠的反应方程式为:
NH4Cl+NaOH△NaCl+H2O+NH3↑)。
把产生的所有NH3用足量的硫酸溶液完全吸收,同时测量120秒内硫酸溶液增加的质量,结果如下表所示。
时间/s
20
30
40
60
80
100
120
硫酸溶液增
加的质量/g
0.7
1.0
1.2
1.5
1.6
1.7
试回答下列问题:
(1)请在右图中画出产生气体的质量随反应时间变化关系曲线;
(2)样品中氯化铵的质量分数为;
(3)求反应后所得氯化钠溶液的溶质质量分数(不考虑反应过程中水分的损失)。
5、钛及钛合金具有密度小、强度高、耐腐蚀等优良性能,被广泛应用于航天、化工、医药等方面。
我国四川省有丰富的钛铁矿资源,从中可以提取金属钛。
(1)钛铁矿的主要成分是钛酸亚铁(FeTiO3),其中铁元素化合价为+2,氧元素化合价为-2,则钛酸亚铁中钛元素(Ti)的化合价为。
(2)钛铁矿中提取金属钛要经过较复杂的流程,其中得到金属钛的反应为:
2Mg+TiCl4高温2MgCl2+Ti。
根据此反应,比较金属镁(Mg)和钛(Ti)的活动性,较强的是。
6.环境问题是人类可持续发展必须解决的一个重要问题。
某校科学课外活动小组在一次“环保”主题实践活动中,对小河旁两座化工厂的废水排放问题进行调查发现:
①甲、乙两厂排出的废水均澄清透明;
②两厂废水中共含K+、H+、Ba2-、OH-、NO3-、CO32-六种离子,且每厂各含三种不同的离子,两厂废水单独排放都会造成严重的污染。
该活动小组的同学用所学的科学知识,对两厂的废水进行探究后发现.若将两厂的废水按一定比例混合,经充分反应及沉淀后,废水会变成只含一种溶质的无色澄清溶液,此溶质可做化肥。
(1)此可做化肥的溶质为(填写物质的化学式)。
(2)经检测甲厂废水明显呈碱性,则甲厂排放的废水中含有的三种离子是。
7、为研究绿色植物的呼吸作用,小欣同学在查阅资料获知NaOH溶液更易吸收二氧化碳气体后设计如下图所示装置。
试回答:
(1)A瓶内溶液的作用是;
(2)B瓶内溶液的作用是;
(3)D瓶内溶液的作用是;
【知识拓展】离子共存与应用
【例1】下列各组物质能在pH=1的溶液中大量共存,且得到无色透明溶液的是()
A、BaCl2NaNO3KOHMgCl2B、Cu(NO3)2NaClH2SO4KNO3
C、Na2CO3NaClKNO3NH4ClD、ZnSO4Mg(NO3)2NaNO3KCl
【例2】下列离子能在pH=13的水溶液中大量共存的是()
A.SO42-、Cl-、Na+、H+B.K+、SO42-、Cu2+、N03-
C.Cl-、K+、SO42-、Na+D.Ca2+、Cl-、CO32-、Na+
【例3】下列各组物质在水中大量共存的是:
[]
A.MgCl2、HCl、Na2SO4、AgNO3B.Ma2CO3、HCl、NaOH、CaCl2
C.NaCl、KNO3、NaOH、CaCl2D.Ba(OH)2、Ba(NO3)2、Na2SO4、CaCO3
【例4】分别将下列物质同时加到水中,得到无色透明溶液的是()
A、FeCl3、KOH、NaClB、K2SO4、BaCl2、HCl
C、CuSO4、HCl、KClD、Na2CO3、KCl、Na2SO4
【知识拓展】物质鉴别
【例1】下列物质间反应,既有白色沉淀,又有蓝色沉淀产生的是()
A.CuSO4溶液和Ba(OH)2溶液B.CuSO4溶液和BaCl2溶液
C.CuCl2溶液和AgNO3溶液D.CuCl2溶液和KOH溶液
【例2】只用一种试剂来鉴别氢氧化钠、氢氧化钙和稀盐酸三种溶液,这试剂是()
A、氯化钡溶液B、碳酸钠溶液C、酚酞试液D、硝酸银溶液
【例3】能把Na2CO3、Ba(OH)2、BaCO3、Mg(OH)2四种白色粉末一次区别开的试剂是
A.石灰水B.稀硝酸C.稀盐酸D.稀硫酸
【例4】欲使溶液中含有大量的Mg2+,K+,Cl-,NO3-,SO42-,(除去水电离出的微量H+和OH-外)不含其它离子,在蒸馏水中应加入[]
A.AgCl、K2CO3、MgSO4B.Na2SO4、Mg(OH)2、KCl
C.MgCl2、KNO3、K2SO4D.AgNO3、KCl、MgSO4
【例5】不用外加试剂鉴别下列各组物质,写出简要的操作、现象、结论。
A:
NaCl、CuSO4、MgCl2、NaOH
B:
Na2CO3、HCl、NaCl、AgNO3
【知识拓展】组成探究
例:
现有一白色固体混合物,可能由BaCl2、KOH、KNO3、MgCl2、CuSO4中的几种混合而成。
为证明其组成,做如下实验:
(1)取一定量该固体混合物加入足量的水,充分搅拌,过滤得到白色沉淀A和无色溶液①,则原混合物中一定有,一定不含有;
(2)向无色滤液①中加入KOH溶液,无任何现象,再加入过量的某可溶性碳酸盐溶液,充分反应后,过滤,得到白色沉淀B和无色滤液②,则原混合物中一定还含有;
(3)向无色滤液②中加入过量的盐酸,然后将所得的溶液蒸干,得固体C。
如果固体C中只有两种元素,则原混合物中一定还不含有,则加入的碳酸盐溶液是;
如果固体C中含有两种金属元素,则加入的碳酸盐溶液是。
【方法点拨】
【课堂训练】
1.有一包白色固体粉末,可能由硫酸钠、氯化钾、硝酸铵、碳酸钠、硫酸铜中的一种或几种组成,做实验得以下结果:
将此固体粉末加到水中,得到无色溶液;
在溶液中加入硝酸钡溶液后有白色沉淀生成,过滤;
得到沉淀和滤液。
在白色沉淀中加入足量的稀硝酸,白色沉淀部分溶解并有无色气体生成,该气体能使澄清的石灰水变浑浊。
在滤液里,加入适量的氢氧化钠溶液并加热,生成有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝色。
从实验可判断出,该粉末中一定含有_________________,一定不含有_________,可能含有_____________。
(5)请你设计一个实验,证明白色固体中可能含有的物质是否存在。
2.为确定某不纯的硝酸钠溶液中所含杂质的成分,一同学设计了如下实验:
(1)白色沉淀A的化学式为,Ⅰ、Ⅱ分别为操作。
(2)向无色溶液中加Na2CO3溶液,其反应的化学方程式为。
(3)经分析知,原溶液中的杂质由一种或几种物质组成,杂质的成分可能是
(有几种填几种):
①②
③④
3.某固体是Cu(NO3)2、CaCO3、Ba(NO3)2、Na2SO4、KOH、NaNO3中的一种或几种
①将固体加入足量水,搅拌,的白色沉淀和无色溶液;
②往白色沉淀里加浓盐酸,全部溶解,放出气体;
③把①中无色溶液分成两份,将②中气体通入第一份,无变化;
气体导出后再通入第二份,得白色沉淀。
a、原固体中一定含____________,
b、②中放出的气体有________和_______,③中通入第二份溶液的气体肯定有__________,c、③中所的白色沉淀是_____________。
4.白色固体样品可能由NaCl、CuSO4、Na2SO4、NaOH、NaNO3中的一种或几种组成,假设以下每步都反应完全,推测样品和所用液体X的成分。
⑴蓝色沉淀是___________,白色沉淀___________;
⑵若样品中只有一种溶质,则该物质一定是__________,此时无色透明的液体X中一定有水和___________;
⑶若样品是混合物,则无色透明的液体X不可能是__________。
A.水B.Na2SO4溶液C.CuSO4溶液D.NaNO3溶液E.NaOH溶液
F.Na2SO4和NaNO3的混合溶液
⑷样品和液体X中一定不含有__________物质(填化学式)
课后小结
上课情况:
课后需再巩固的内容:
教研组长签名
1、碱的共性
1碱溶液能使酸碱指示剂变色
2碱能与酸反应
氢氧化钠与盐酸反应____________________________________________________
氢氧化钡与硫酸反应________________________________________________________
3碱溶液能与非金属氧化物反应
用氢氧化钠吸收二氧化硫____________________________________________________
氢氧化钠在空气中变质_____________________________________________________
二氧化碳使澄清石灰水变浑浊__________________________________________________
4碱溶液能与某些可溶性盐反应
氯化铁溶液与氢氧化钠溶液反应_________________________________________________
氯化铜溶液与氢氧化钠溶液反应_________________________________________________
碳酸钠溶液与氢氧化钙溶液反应_________________________________________________
氯化铁溶液与氢氧化钙溶液反应_________________________________________________
1、碱的个性
NaOH①俗称:
_________、_________
②氢氧化钠固体在空气中容易,利用这个性质,氢氧化钠可以作氧气、氢气的。
③氢氧化钠易溶于水,溶解是热量
④腐蚀性
Ca(OH)2①俗称:
②水溶液称为石灰水
③腐蚀性
2、右图是常见酸、碱、盐之间的相互转化关系。
(1)写出图中相应物质的化学式:
酸、碱。
(2)写出图中反应②和④的化学方程式:
②
④
(3)总结化学反应的规律是我们学习化学的方法之一。
请根据上图总结出酸、碱、盐相互反应的规律(写2点)、。
3、现有H2SO4、BaCl2、NaOH、Na2CO3、Ca(OH)2五种溶液和CO2一种气体,有下列所示的相互转化关系。
图中每条连线表示两端的物质可以发生化学反应,试将它的化学式填入图中相应的六个方框中。
4、从Ba(OH)2、Na2SO4、稀HCl、BaCl2四种溶液中,选择适当的物质填入下图方框中。
5.某校研究性学习小组进行了一个有趣的实验探究:
【提出问题】实验室有一瓶久置的NaOH,变质程度怎样?
【设计方案】先称取21.2g的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入一定质量分数的稀硫酸直至过量,根据生成CO2的质量计算出Na2CO3的质量,从而进一步确定样品中NaOH的质量分数。
【进行实验】实验测得加入稀硫酸的质量与产生CO2
气体的质量关系如下图所示。
【数据处理】写出以下计算过程:
(1)该样品中Na2CO3的质量为多少?
(2)该样品中NaOH的质量分数为多少?
【反思与交流】①从图中0~A点说明:
在NaOH与Na2CO3的混合溶液中,加入强酸,首先反应的物质是;
②根据反应方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比,中和反应时消耗强酸的量。