电化学及应用文档格式.docx
《电化学及应用文档格式.docx》由会员分享,可在线阅读,更多相关《电化学及应用文档格式.docx(11页珍藏版)》请在冰豆网上搜索。
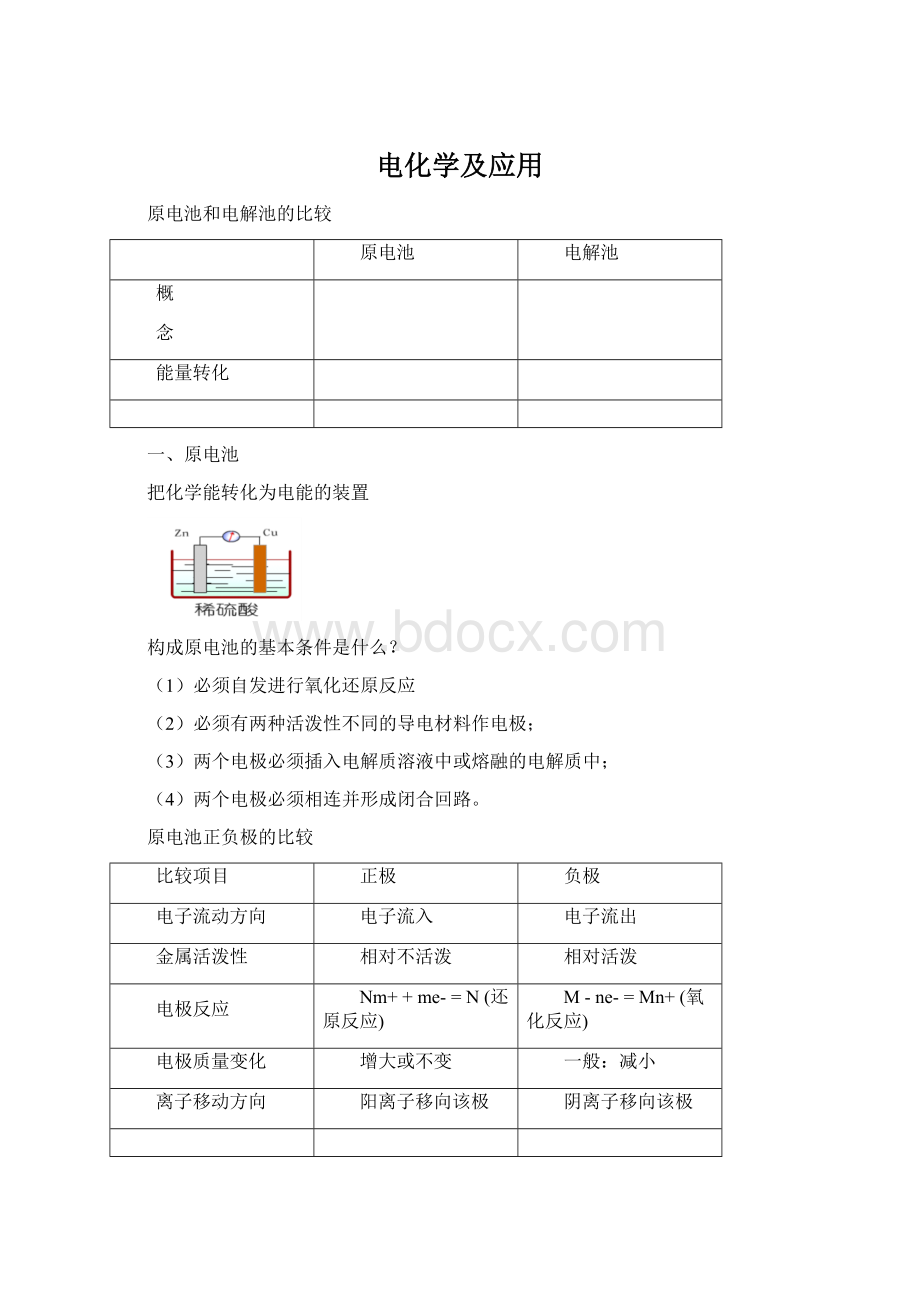
增大或不变
一般:
减小
离子移动方向
阳离子移向该极
阴离子移向该极
原电池的工作原理
1、负极失电子发生氧化反应;
溶液中氧化性较强的微粒在正极上得电子发生还原反应;
2、电子由负极流向正极,电流方向是由正极流到负极(外电路)。
用Al、Cu作电极,如何使Cu作负极,Al作正极
用Mg、Al作电极,如何使Al作负极,Mg作正极?
原电池原理的应用
(1)制做化学电源;
(2)比较金属的活泼性;
构建原电池,测出正负极,负极金属活泼性>
正极
(3)加快某些化学反应的反应速率;
(4)金属腐蚀的原理及金属腐蚀的防护。
金属的电化学腐蚀
(一)金属腐蚀
1.概念:
2.金属腐蚀的本质
3.金属腐蚀的分类:
化学腐蚀与电化学腐蚀的比较
化学腐蚀
电化学腐蚀
发生条件
共同点
是否构成原电池
有无电流
实 质
金属的防护
方法:
1.改变金属的内部组织结构(如制不锈钢)
2.在金属表面覆盖保护层:
(1)在表面刷一层油漆;
(2)在表面涂上机油;
(3)在表面镀一层其他耐腐蚀金属;
(4)在表面烧制搪瓷;
(5)使金属表面形成致密的氧化膜。
3.电化学保护法:
(1)牺牲阳极的阴极保护法
(2)外加电流的阴极保护法
判断金属腐蚀快慢的规律
不纯的金属或合金,在潮湿空气中形成微电池发生电化腐蚀,活泼金属因被腐蚀而损耗,金属腐蚀的快慢与下列二种因素有关:
1)与构成微电池的材料有关,两极材料的活动性差别越大,电动势越大,氧化还原反应的速度越快,活泼金属被腐蚀的速度就越快;
2)与金属所接触的电解质强弱有关,活泼金属在电解质溶液中的腐蚀快于在非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀快于在弱电解质溶液中的腐蚀。
一般说来可用下列原则判断:
(电解原理引起的腐蚀)>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀
二、常见的化学电池
干电池
电极:
Zn为负极,碳棒为正极
电解液:
NH4Cl、ZnCl2和淀粉糊
另有黑色的MnO2粉末,吸收正极产生的H2,防止产生极化现象。
电极方程式:
银锌电池
Zn为负极,Ag2O为正极电解液:
KOH溶液
电极反应式:
铅蓄电池:
电极:
Pb为负极,PbO2为正极.
电解液:
30%的H2SO4溶液
电极反应式:
放电时:
为原电池
充电时:
为电解池
铝——空气——海水电池
1991年,我国首创以铝-空气-海水为材料组成的新型电池,用作航海标志灯.以取之不尽的海水为电解质
燃料电池
(1)电极:
Pt制作的惰性电极
(2)电解质溶液:
KOH溶液
(3)反应原理:
以甲烷作燃料的燃料电池
电极为金属铂,电解质为KOH,在两极分别通入甲烷和氧气。
电极反应:
负极:
正极:
组成电解池的条件:
(1).外接直流电源
(2).电极(金属或惰性电极)
(3).电解质溶液或熔融的电解质
(4).形成闭合回路
电解池阴阳极的比较
阴极
阳极
与电源连接
接电源负极
接电源正极
Nm++me-=N
(还原反应)
Rn-–ne-=R
M–ne-=Mn+(氧化反应)
减小或不变
电解池的工作原理
在惰性电极上离子放电顺序:
阴极(与电极材料无关):
Ag+>
Hg+>
Fe3+>
Cu2+>
H+(酸)>
Pb2+>
Fe2+>
Zn2+>
H+(水)>
Al3+>
Mg2+>
Na+>
Ca2+>
K+
得到电子由易到难
阳极(与电极材料有关):
活性材料>
S2-﹥I-﹥Br-﹥Cl-﹥OH-﹥NO3-﹥SO42-﹥F-
失去电子由易到难
电解时电极产物的判断
用惰性电极电解电解质溶液的规律
(1)电解水型(NaOH、H2SO4、K2SO4等)的电解
(2)分解电解质型(HCl、CuCl2等)溶液的电解
(3)放氢生碱型(NaCl、MgBr2)溶液的电解
(4)放氧生酸型(CuSO4、AgNO3等)溶液的电解
电解原理的应用
铜的电解精炼
电镀铜
【例题】某学生试图用电解法根据电极上析出物质的质量来测定阿佛加德罗常数值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如右图:
②在电流强度为I安培,通电时间为t秒钟后,精确测得某电极上析出的铜的质量为m克。
试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示。
下同)
E接,C接,接F。
实验线路中的电流方向为
→→→C→→。
(2)写出B电极上发生反应的离子方程式 ;
G试管中淀粉KI溶液变化的现象为;
相应的离子方程式是。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是。
(选填下列操作步骤的编号)
①称量电解前电极质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×
10-19库仑。
试列出阿佛加德罗常数的计算表达式:
有关电解的计算
原则:
电化学的反应是氧化一还原反应,各电极上转移电子的物质的量相等,无论是单一电池还是串联电解池,均可抓住电子守恒计算.
关键:
①电极名称要区分清楚.
②电极产物要判断准确.
③各产物间量的关系遵循电子得失守恒.
例用下图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:
①工作一段时间后A槽pH值上升,B槽的pH下降.
②b、c两极上反应的离子的物质的量相等
(1)应选择的电解质是上述四组中的第____组
(2)该组电解过程中各电极上的电极反应为
a极_____b极__________c极__________d极___________
(3)当b极上析出7.1g电解产物时,a极上析出产物的质量为____g;
若B槽电解质溶液500mL,且忽略电解前后电解液的体积变化,则此时B槽中的[H+]比电解前增加了____mol/L.
例:
用两支惰性电极插入1000mLCuSO4溶液,通电电解,当电解液的PH由6.0变为3.0时,下列叙述正确的是
A、阴极上析出11.2mL氢气(标况)
B、阴极上析出32mg铜
C、阳极和阴极质量都没有变化
D、阳极上析出5.6mL氧气(标况)
按右图装置进行电解(均是惰性电极),已知A烧杯中装有500mL20%的NaOH溶液,B烧杯中装有500mLpH为6的CuSO4溶液。
通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)()
A.4B.3
C.2D.1
电解一段时间,如何恢原到电解前的溶液
既要考虑“质”又要考虑“量”.
例如:
电解CuSO4溶液:
抓住溶液的变化
若加入CuO、Cu(OH)2,均能与H2SO4反应生成CuSO4.①
CuO+H2SO4=CuSO4+H2O
②Cu(OH)2+H2SO4=CuSO4+2H2O
比较①、②消耗的H2SO4、生成的CuSO4、H2O即可知道:
加入1molCu(OH)2能与1molH2SO4反应能生成1molCuSO4和2molH2O.不符合电解时的相关物质的比例.若改加CuO,则很合适.
思考2:
如何确定所加物质的量?
(惰性电极)
分析:
由于两极上通过的电子数相等,故阴、阳两极产物的物质的量间一定满足确定的关系.因而加入物与其也有一定关系.
电解含0.4molCuSO4溶液一段时间后,阳极上生成2.24L气体(S.T.P),则应加入CuO多少克?
(用惰性电极)
例.用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的组是()
X
Y
Z
W
A
C
Fe
NaCl
H2O
B
Pt
Cu
CuSO4
CuSO4溶液
H2SO4
D
Ag
AgNO3
AgNO3晶体
练习、化学电池在通讯、交通及日常生活中有着广泛的应用。
1.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是()
①以上反应是可逆反应②以上反应不是可逆反应
③充电时化学能转变为电能④放电时化学能转变为电能
A①③B②④C①④D②③
练习、熔融盐燃料电池具有高的发电效率,因而受到重视。
可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池。
完成有关的电池反应式:
电池反应式:
阳极反应式:
阴极反应式:
,
总电池反应:
。
练习、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。
高铁电池的总反应为:
3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A.放电时负极反应为:
Zn-2e+2OH=Zn(OH)2
B充电时阳极反应为:
FeOH3-3e+5OH=+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
练习、一种新型燃料电池,一极通入空气,另一极通入丁烷气体;
电解质是掺杂氧化钇Y2O3的氧化锆ZrO2晶体,在熔融状态下能传导O2。
下列对该燃料电池说法正确的是()
A在熔融电解质中,O2由负极移向正极
B电池的总反应是:
2C4H10+13O28CO2+10H2O
C通入空气的一极是正极,电极反应为:
O2+4e=2O2
D通入丁烷的一极是正极,电极反应为:
2C4H10+
26e+13O2=4CO2+5H2O
将1L一定浓度的CuSO4溶液,用a、b两个石墨
电极电解,当a极上产生22.4L(标)气体时,b极上只有
固体析出。
然后将a、b两电板反接,继续通直流电,
b板上又产生22.4L(标)气体,溶液质量共减少227g。
(1)a极上产生22.4L(标)气体时,b极增加的质量;
(2)原溶液的物质的量浓度。
例5.工业上为了处理含有Cr2O72-酸性工业废水,采用下面的处理方法,往工业废水中加入适量的NaCl,以铁为电极进行电解,经过一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,
工业废水中铬的含量已低于排放标准,请回答下面问题:
1.两极发生的电极反应
2.写出Cr2O72-变为Cr3+的离子方程式:
3.工业废水由酸性变为碱性的原因:
4.能否改用石墨电极?
说明原因