生物化学常用试剂配制Word格式.docx
《生物化学常用试剂配制Word格式.docx》由会员分享,可在线阅读,更多相关《生物化学常用试剂配制Word格式.docx(10页珍藏版)》请在冰豆网上搜索。
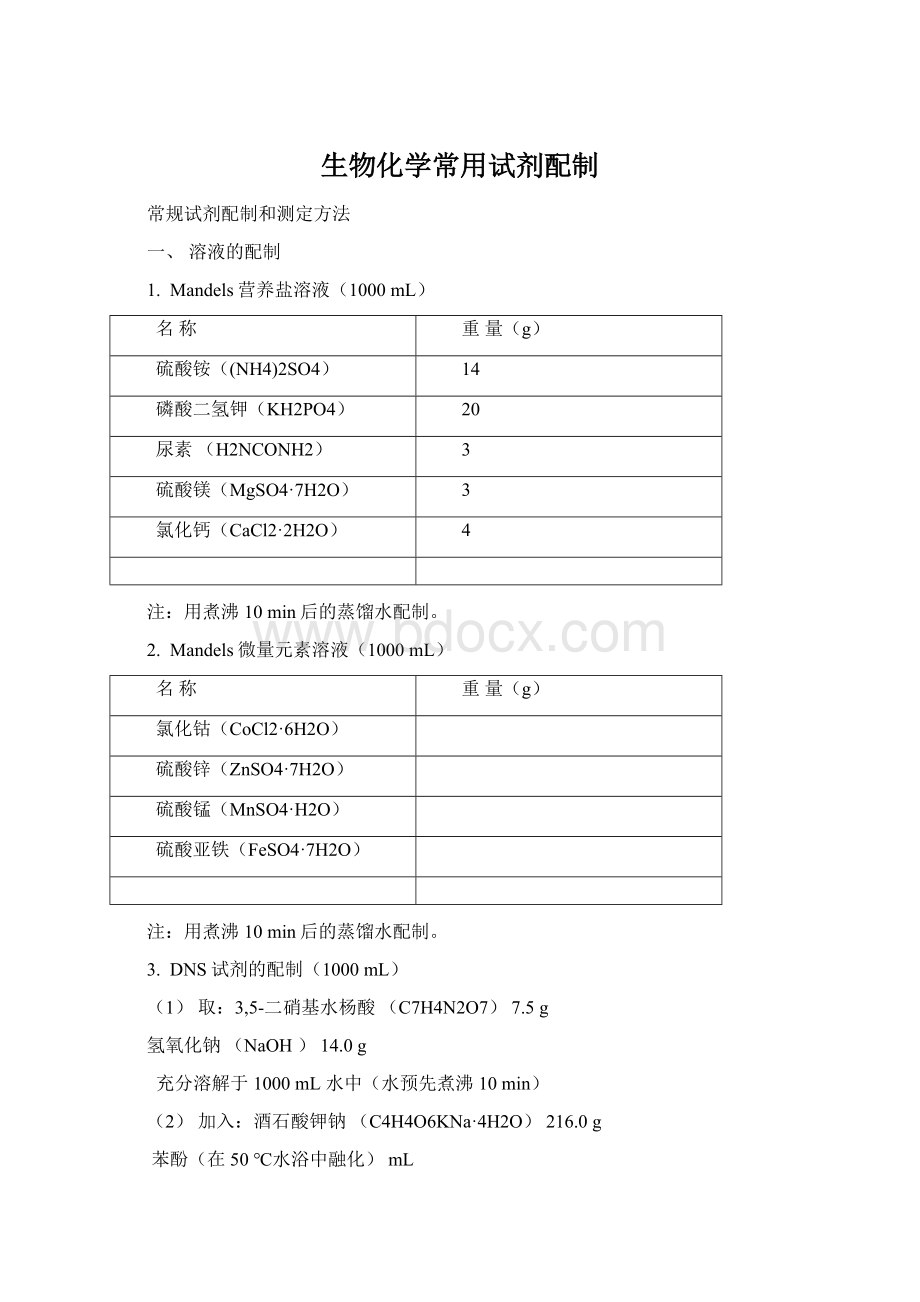
(1)取:
3,5-二硝基水杨酸(C7H4N2O7)7.5g
氢氧化钠(NaOH)14.0g
充分溶解于1000mL水中(水预先煮沸10min)
(2)加入:
酒石酸钾钠(C4H4O6KNa·
4H2O)216.0g
苯酚(在50℃水浴中融化)mL
偏重亚硫酸钠(Na2S2O5)6.0g
(3)充分溶解后盛于棕色瓶中,放置5天后便可使用,平时盛一小瓶(250mL)使用,要放在冰箱中冷藏。
此溶液每月配制一次。
注意:
倒入瓶中时要尽量装满!
!
4.考马斯亮蓝G-250的配制(1000mL)
称考马斯亮蓝G-250100mg即0.1g溶于50mL95%乙醇中,加入100mL85%磷酸,用蒸馏水稀释至1000mL,滤纸过滤。
最终试剂中含%(w/v)考马斯亮蓝G-250,%(w/v)乙醇,%(w/v)磷酸。
5.1.0M柠檬酸缓冲溶液的配制(1000mL)
分子量Mn
柠檬酸(C6H8O7·
210
NaOH
40
准确称取柠檬酸210g,溶于约750mL煮沸(10min)蒸馏水中,待柠檬酸充分溶解后加入氢氧化钠74.5g,完全溶解后将上述溶液转移到1000mL容量瓶中,冷却后将容量瓶定容到1000mL(原始)。
(检验方法:
取1.0M柠檬酸缓冲溶液稀释20倍,测定稀释液的pH值,pH值应为)
6.标准糖溶液的配制和标准方程的测定
(1)标准糖溶液的配制
准确称取2.000g葡萄糖/木糖(葡萄糖/木糖需105℃烘干3h),蒸馏水溶解,全部转移至1L容量瓶内,摇匀,配制成2g/L葡萄糖/木糖溶液。
取9个100mL容量瓶、1支20mL刻度吸管,分别吸取2g/L葡萄糖/木糖溶液10mL、20mL、30mL、40mL、50mL、60mL、70mL、80mL、90mL依次加入容量瓶,蒸馏水定容,摇匀。
即为0.2g/L、0.4g/L、0.6g/L、0.8g/L、1.0g/L、1.2g/L、1.4g/L、1.6g/L、1.8g/L、2.0g/L葡萄糖/木糖标准溶液。
取6个30mL容量瓶、1支20mL刻度吸管,分别吸取2g/L葡萄糖溶液10mL、12mL、14mL、16mL、18mL、20mL依次加入容量瓶,每瓶再加入mL柠檬酸缓冲液,蒸馏水定容,摇匀。
即为1.0g、1.2g、1.4g、1.6g、1.8g、2.0g酶解葡萄糖。
(2)标准方程的测定:
葡萄糖/木糖标准方程的测定
取10支25mL刻度管,10支1mL刻度吸管,分别加入0.2g/L、0.4g/L、0.6g/L、0.8g/L、1.0g/L、1.2g/L、1.4g/L、1.6g/L、1.8g/L、2.0g/L葡萄糖/木糖标准溶液1mL,DNS溶液3mL。
100℃煮沸5min,水浴冷却后定容至25mL,摇匀。
以蒸馏水作为空白对照,550nm测定吸光度A。
以A为纵坐标,C为横坐标,制定标准曲线。
(7230型分光光度计输出方程为:
A=MC+N,723型分光光度计输出方程为:
C=KA+B)
酶解木糖标准方程测定(测定木聚糖酶活力)
取6支25mL刻度管,6支2mL刻度吸管,分别加入1.0g、1.2g、1.4g、1.6g、1.8g、2.0g酶解木糖标准溶液mL,DNS溶液3mL,100℃煮沸5min,水浴冷却后定容至25mL,摇匀。
C=KA+B)
酶解葡萄糖标准方程测定(测定滤纸酶活力、CMC酶活力)
取6支小试管,6支2mL刻度吸管,分别加入1.0g、1.2g、1.4g、1.6g、1.8g、2.0g酶解葡萄糖标准溶液mL,DNS溶液3mL,100℃煮沸5min,水浴冷却后,量筒定容至50mL(定容至25mL,测定CMC酶活力),摇匀。
7.柠檬酸-磷酸氢二钠缓冲液的配制
pH
mol/L
柠檬酸/mL
磷酸氢二钠/mL
Na2HPO4,Mr=;
mol/L溶液为28.40g/L
Na2HPO4·
2H2O,Mr=;
mol/L溶液为35.61g/L
C6H8O7·
H2O,Mr=;
mol/L溶液为21.01g/L
二、酶活力的测定
1.滤纸酶活力的测定—纤维素酶的总体酶活力
采用国际理论和应用化学协会(IUPAC)推荐的标准方法测定[Ghose,.,etal,Pure&
.,1987,59,257-268],一个滤纸酶活力的国际单位(FPIU)等于在标准反应条件下每分钟生成1μmol葡萄糖量的酶量。
测定方法如下:
取7支试管在其中1#-5#支小试管中加入50mg卷成筒状的滤纸条(1×
6cm),适当稀释酶液,取7支试管按下表操作。
(5#有底物无酶,6#为有酶无底物空白对照)
项目
1#
2#
3#
4#
5#
6#
7#
稀释酶液(mL)
酶解葡萄糖
标样
0.05M柠檬酸缓冲液(mL)
1
将上述试管盖上塑料布,用橡皮筋扎紧后置于恒温水浴器中,保持在振幅80和温度50℃下保温60min后立即取出加入3mLDNS试剂,在沸水中反应5min,冷却后加水至50mL并充分摇匀,待滤纸完全沉淀后,取上层清液于550nm波长下测定吸光度A值。
反应生成的葡萄糖的量根据葡萄糖标准曲线求得。
以、、、酶量所生成葡萄糖的毫克数为横坐标,酶量的对数为纵坐标作图,从图中找出生成2mg葡萄糖的酶量,按下式计算样品的滤纸酶活力(FPA):
滤纸酶活力=2mg葡萄糖
60min×
(mg/μmol)×
生成2mg葡萄糖的酶量(mL)
一个滤纸酶活力单位定义为每分钟生成1μmol葡萄糖所需的酶量,单位:
IU/mL。
备注:
当加入mL酶液(指酶液没有被稀释的时候!
)仍无法生成2mg葡萄糖时,按下式计算:
滤纸酶活=×
(葡萄糖mg数)
2.β-葡萄糖苷酶活力的测定
方法一:
葡萄糖氧化酶测定法
按国际标准方法测定[Ghose,.,etal,Pure&
.,1987,59,257-268]。
一个β-葡萄糖苷酶活力国际单位(IU/mL)等于标准条件下每分钟转化1μmol底物即生成2μmol葡萄糖的酶量来表示。
预先用0.05M的柠檬酸缓冲液配制15mmol/L的纤维二糖溶液(0.513g纤维二糖/100mL0.05M的柠檬酸缓冲液,现配现用)
(1)每个样品应做三个不同酶量
估计β-葡萄糖苷酶活力(IU/mL)
<
取酶液量(mL)
(2)加料:
试管中加入酶液、缓冲液和纤维二糖溶液如下:
酶液量
(mL)
纤维二糖溶液
样品
适量
1-酶液
酶液空白
纤维二糖空白
每个试管共2mL,用塑料纸包扎好。
纤维二糖溶液必须用0.05M柠檬酸配制。
(3)酶解反应:
试管置于50℃水浴中,保温30分钟,取出,沸水中放置5分钟使酶失活,冷却至室温。
(4)加显色剂(葡萄糖氧化酶测定试剂):
取试管中冷却液30μL,加入显色剂mL,混匀;
同时做一个葡萄糖标样:
取1g/L葡萄糖标样30μL,加显色剂mL,混匀;
置于37℃水浴中,保温15分钟,取出。
(5)测吸光度:
505nm,用蒸馏水调零,测各试管溶液吸光度A值。
1g/L葡萄糖标样的吸光度为左右。
(6)计算产生的葡萄糖mg数:
样品吸光度
测得酶空白所含葡萄糖=2×
(mg)
纤维二糖空白1g/L葡萄糖标样吸光度
样品实际产生的葡萄糖=[测得葡萄糖mg]-[纤维二糖空白葡萄糖mg]
-[酶空白葡萄糖mg]×
[酶液量mL](mg)
纤维二糖空白所产生的响应值,当纤维二糖溶液为新鲜配制时,一般很低。
(7)作图:
以log(酶液量mL)为纵坐标,实际产生的葡萄糖mg为横坐标作图,求出生成1mg葡萄糖时对应的酶液量mL。
(8)计算β-葡萄糖苷酶活力:
β-葡萄糖苷酶活力=(IU/mL)
生成1mg葡萄糖对应的酶液量(mL)
当加入1mL酶液仍不能生成1mg葡萄糖时,
β-葡萄糖苷酶活力=×
☆补充:
葡萄糖含量测定
采用葡萄糖氧化酶-过氧化物酶终点比色法测定。
葡萄糖测定试剂盒由上海荣盛生物技术有限公司生产,内含R1(缓冲液)和R2(酶试剂),使用时将R1和R2等量混合。
葡萄糖经葡萄糖氧化酶氧化成葡萄糖酸和过氧化氢,后者在过氧化物酶的作用下,将4-氨基安替比林与苯酚偶联缩合成可被分光光度计测定的醌类化合物。
测定该有机化合物的吸光度便能计算出葡萄糖的含量。
在测定管中加入30μL待测试样的稀释液(空白管、标准管分别以蒸馏水及1g/L的葡萄糖标准溶液代替),每一试管中加入由R1和R2等量混合的酶酚混合液,将各试管分别摇匀,置于37℃水浴中保温15min,冷却至室温后,在7230分光光度计上于505nm下测定吸光度A值,用空白管校正吸光度到零点,葡萄糖含量按下式计算:
葡萄糖含量(g/L)=×
稀释倍数
方法二:
采用pNPG(对硝基苯酚-β-D-葡萄糖苷)试剂测定
(1)试剂的配制
50mmol/L,pH柠檬酸-磷酸氢二钠缓冲液的配制(200mL)
方法:
mol/L柠檬酸mL+mol/L磷酸氢二钠mL
1mol/LNa2CO3溶液(250mL)
称取:
26.5gNa2CO3溶解后定容至250mL
5mmol/LpNPG(分子量:
)溶液的配制(100mL)
称取0.1506gpNPG,用50mmol/L,柠檬酸-磷酸氢二钠缓冲液溶解后定容至100mL。
(2)对硝基苯酚标准方程的测定
对硝基苯酚标准溶液的配制
准确称取0.0209g对硝基苯酚(分子量:
),蒸馏水溶解,全部转移至100mL容量瓶内,摇匀,配制成mmol/L对硝基苯酚溶液。
取6个30mL容量瓶,分别吸取mmol/L对硝基苯酚溶液1mL、2mL、4mL、6mL、8mL、10mL依次加入容量瓶,蒸馏水定容,摇匀。
即为mmol/L、mmol/L、mmol/L、mmol/L、mmol/L、mmol/L。
对硝基苯酚标准方程的测定
取6支15mL刻度管、6支1mL刻度吸管,分别加入mmol/L、mmol/L、mmol/L、mmol/L、mmol/L、mmol/L对硝基苯酚溶液,再加入mL1mol/L的Na2CO3溶液和10mL的蒸馏水,室温放置5min后,摇匀。
以蒸馏水作为空白对照,在400nm下测定吸光度A。
(3)测定方法
游离酶酶活力的测定:
mL适当稀释的酶液与mL5mmol/LpNPG溶液(分别预热5分钟)混合后,于50℃下保温10min。
10min后立即加入2mL1mol/LNa2CO3溶液终止反应后,再加入10mL的蒸馏水,摇匀。
在400nm下测定吸光度。
以mL蒸馏水代替酶液作空白对照。
(要做2~3个平行样,取平均值)
固定化酶酶活力的测定:
将游离酶酶活的测定方法中适当稀释的酶液用蒸馏水和一定质量的固定化酶来代替,其余步骤相同。
(4)酶活力的计算
一个β-葡萄糖苷酶酶活力单位定义为:
每分钟水解生成1μmol对硝基苯酚所需要的酶量。
计算公式如下:
游离酶酶活力的计算:
生成对硝基苯酚的量(μmol)
β-葡萄糖苷酶酶活=(IU/mL)
10min×
mL
固定化酶活力的计算:
β-葡萄糖苷酶酶活=(IU/g)
10min×
称取固定化酶的质量(g)
3.羧甲基纤维素(CMC)—内切葡聚糖酶活力
(1)在25mL刻度试管中加入mL适当稀释的酶液和mL用mol/L柠檬酸缓冲液配制的1%(w/v)羧甲基纤维素悬浮液。
(2)盖上塑料布,用橡皮筋扎紧后置于恒温水浴器中,保持在振幅80和温度50℃下保温30min后立即取出加入3mLDNS试剂,在100℃沸水中煮沸5min,冷却到室温后,加水定容至25mL,充分摇匀后于550nm波长下测定吸光度A值。
(3)反应生成的葡萄糖的量根据葡萄糖标准曲线求得。
按下式计算CMC酶活力:
CMC酶活力=生成的葡萄糖的量(mg)
30min×
一个CMC酶活力单位定义为每分钟生成1μmol葡萄糖所需的酶量,单位:
4.木聚糖酶活力的测定
用mol/L柠檬酸缓冲液配制的1%(w/v)桦木木聚糖(Sigma公司制造)溶液。
适当稀释酶液,取7支25mL刻度试管按下表操作(5#有底物无酶、6#为有酶无底物空白对照)。
酶解木糖标样
0.05M柠檬酸缓冲液(mL)
1%桦木木聚糖(mL)
将上述试管盖上塑料布,用橡皮筋扎紧后置于恒温水浴器中,保持在振幅80和温度50℃下保温30min后立即取出加入3mLDNS试剂,在沸水中反应5min,冷却到室温后,加水到25mL,充分摇匀后于550nm波长下测定吸光度A值。
根据木糖标准曲线(用木糖的绝对量对吸光度A值作图),找出反应所产生的木糖量(扣除空白值)。
以、、、mL酶量所生成木糖的毫克数为横坐标,酶量的对数为纵坐标作图,从图中找出生成2mg木糖的酶量,按下式计算木聚糖酶活力:
木聚糖酶活力=2mg木糖
30min×
生成2mg木糖的酶量
一个木聚糖酶活力单位定义为每分钟生成1μmol木糖所需的酶量,单位:
三、木聚糖的测定方法
1、准确吸取5mL搅拌均匀的木聚糖溶液于250mL三角瓶中,加入5mL8%的硫酸,摇匀后用牛皮纸和橡皮筋将三角瓶的瓶口扎住。
2、将三角瓶置于灭菌锅中于121℃条件下保温60min,冷却后取出。
3、将三角瓶中的水解液倒入200mL烧杯中,加入100mL左右的水(注意少量多次洗涤三角瓶),用15%的NaOH溶液中和至pH值为~。
4、将中和液定容到200mL(量筒)。
5、用DNS法测得中和液的还原糖浓度c,则被测样品的木聚糖浓度C为:
C=c×
40×
式中:
C—木聚糖浓度,g/L
c—水解液中木糖浓度
—木聚糖和木糖的转化系数
6、每个样品做2个平行样。
木聚糖的聚合度是用c×
40除以木聚糖不水解直接测糖的还原物浓度。
四、可溶性蛋白质的测定
采用Bradford测定方法。
测定试剂采用Bradford试剂(Sigma公司)。
常量分析法。
取5个蛋白质标准样品(分别含牛血清蛋白、、、和mg/mL),1个空白对照(蒸馏水)和所有待测试样各mL于10mL具塞试管中,顺试管壁分别加入mLBradford试剂,将试管小心上下翻转几次使液体混合均匀(注意尽量不产生泡沫),在加入染色剂后的5-60min内,于595nm波长下测定各样品的吸光度A值。
以同样处理的空白作为对照。
当蛋白质浓度在mg/mL范围内时,吸光度A值与蛋白质浓度之间呈线性关系。
作出蛋白质浓度标准曲线后,由待测试样的A值可求得蛋白质的浓度。
微量分析法。
当蛋白质浓度较低时,可采用微量分析法来测定蛋白质浓度。
取5个蛋白质标准样品(分别含牛血清蛋白2、4、6、8和10μg/mL)和待测试样各mL于10mL具塞试管中,顺试管壁分别加入mLBradford试剂,其余步骤与常量分析方法相同。