人教版高中化学 必修一 学案 42元素周期律Word文档下载推荐.docx
《人教版高中化学 必修一 学案 42元素周期律Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《人教版高中化学 必修一 学案 42元素周期律Word文档下载推荐.docx(13页珍藏版)》请在冰豆网上搜索。
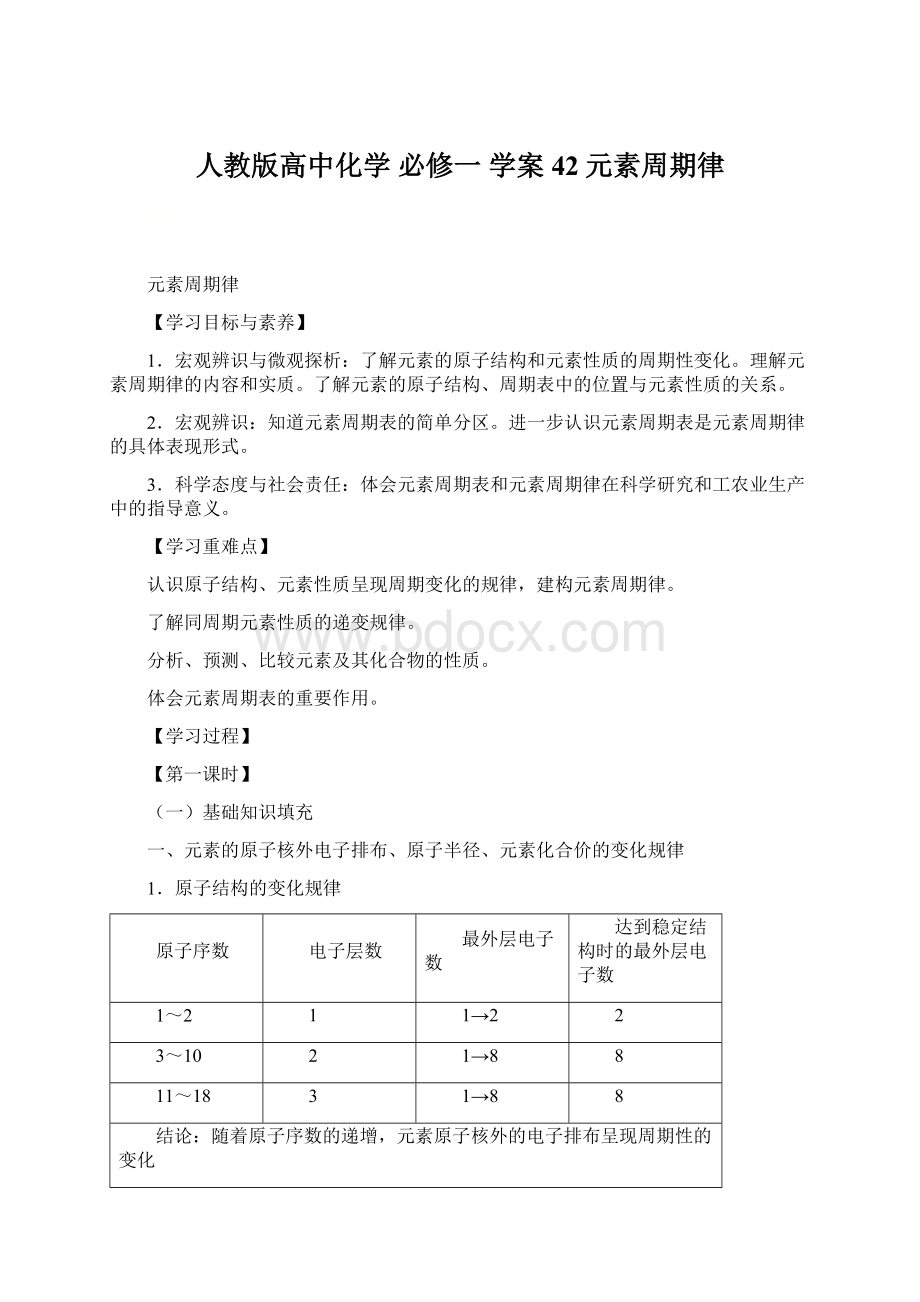
O
F
Ne
原子半径/pm
152
89
82
77
75
74
71
-
逐渐减小
11~18号元素
Na
Mg
Al
Si
P
S
Cl
Ar
186
160
143
117
110
102
99
变化趋势
随着原子序数的递增,元素原子的半径呈现周期性变化
3.元素主要化合价的变化规律
主要化合价的变化
+1―→0
+1―→+5-4―→-1―→0
+1―→+7-4―→-1―→0
随着原子序数的递增,元素的主要化合价呈周期性变化
二、探究第三周期元素性质的递变规律
1.钠、镁、铝的性质比较
单质
单质与水(或酸)的反应现象
化学方程式
最高价氧化物对应水化物的碱性强弱
与冷水剧烈反应,放出氢气
2Na+2H2O===2NaOH+H2↑
NaOH强碱
与冷水反应缓慢,与沸水迅速反应,放出氢气;
与酸剧烈反应,放出氢气
Mg+2H2O
Mg(OH)2+H2↑;
Mg+2HCl===MgCl2+H2↑
Mg(OH)2中强碱
与酸迅速反应,放出氢气
2Al+6HCl===2AlCl3+3H2↑
Al(OH)3两性氢氧化物
(1)金属性强弱顺序为Na>Mg>Al;
(2)随着核电荷数减小,与水(酸)反应越来越容易,氢氧化物的碱性越来越强
2.硅、磷、硫、氯的非金属性的递变规律
最高正价
+4
+5
+6
+7
最低负价
-4
-3
-2
-1
最高价氧化物对应的水化物
H2SiO3
弱酸
H3PO4
中强酸
H2SO4
强酸
HClO4强酸(酸性比硫酸强)
酸性强弱
3.结论
综上所述,我们可以从11~18号元素性质的变化中得出如下结论:
从左往右金属性逐渐减弱,非金属性逐渐增强。
三、元素周期律
1.内容:
元素的性质随着原子序数的递增而呈周期性变化的规律。
2.实质:
元素性质的周期性变化是元素原子核外电子排布呈现周期性的变化的必然结果。
(二)自学检测
1.判断正误(正确的打“√”,错误的打“×
”)
(1)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小()
(2)第二周期元素从左到右,最高正价从+1递增到+7()
(3)元素的原子得电子越多,非金属性越强;
失电子越多,金属性越强()
(4)元素的氧化物对应的水化物酸性越强,非金属性越强;
碱性越强,金属性越强()
答案:
(1)×
(2)×
(3)×
(4)×
2.元素性质呈周期性变化的决定因素是()
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
解析:
元素性质呈周期性变化的决定因素是元素原子核外电子排布呈周期性变化。
3.原子序数为11~17号的元素,随核电荷数的递增,以下各项内容的变化是[填“增大(强)”“减小(弱)”或“相同(不变)”]
(1)各元素的原子半径依次________,其原因是_______________________________。
(2)各元素原子的电子层数________,最外层电子数依次________。
(3)元素的金属性逐渐________,而非金属性逐渐_________,元素失电子能力逐渐________,得电子能力逐渐________。
(1)减小;
电子层数相同时,随核电荷数增大,原子核对最外层电子的引力增大,因此原子半径减小
(2)相同;
增大
(3)减弱;
增强;
减弱;
增强
(三)重难点突破
重难点1:
元素的金属性、非金属性强弱判断规律
1.金属性强弱的判断依据
(1)元素的单质与水或酸置换出氢气的反应越容易进行,则其金属性越强。
(2)元素的最高价氧化物的水化物的碱性越强,则其金属性越强。
(3)金属元素的单质与盐在水溶液中进行置换反应,若A置换出B,则A的金属性强于B。
(4)在金属活动性顺序表中,前面的金属性强于后面的。
(5)金属阳离子的氧化性越强,则其单质的还原性越弱,元素的金属性越弱(注:
Fe的阳离子仅指Fe2+)。
2.非金属性强弱的判断依据
(1)非金属元素的单质与氢气化合生成气态氢化物的反应越容易进行,则其非金属性越强。
(2)非金属元素气态氢化物的稳定性越强,则元素的非金属性越强。
(3)元素的最高价氧化物的水化物的酸性越强,则其非金属性越强。
(4)非金属元素的单质与盐在水溶液中进行置换反应,若A置换出B,并且A体现出氧化性,则A的非金属性强于B。
(5)非金属阴离子的还原性越强,则其单质的氧化性越弱,元素的非金属性越弱。
:
重难点2:
粒子半径大小的比较——“四同”规律
1.同周期——“序大径小”
(1)规律:
同周期,从左往右,原子半径逐渐减小。
(2)举例:
第三周期中:
r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。
2.同主族——“序大径大”
同主族,从上到下,原子(或离子)半径逐渐增大。
碱金属:
r(Li)<r(Na)<r(K)<r(Rb)<r(Cs),r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)。
3.同元素
(1)同种元素的原子和离子半径比较——“阴大阳小”。
某原子与其离子半径比较,其阴离子半径大于该原子半径,阳离子半径小于该原子半径。
如:
r(Na+)<r(Na);
r(Cl-)>r(Cl)。
(2)同种元素不同价态的阳离子半径比较规律——“数大径小”。
带电荷数越多,粒子半径越小。
r(Fe3+)<r(Fe2+)<r(Fe)。
4.同结构——“序大径小”
电子层结构相同的离子,核电荷数越大,离子半径越小。
r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
特别提醒:
所带电荷、电子层均不同的离子可选一种离子参照比较。
例:
比较r(Mg2+)与r(K+)可选r(Na+)为参照,可知r(K+)>r(Na+)>r(Mg2+)。
【第二课时】
一、元素周期表的分区及元素化合价规律
请填写出图中序号所表示内容。
①增强;
②减弱;
③增强;
④增强;
⑤Al;
⑥Si;
⑦金属;
⑧非金属。
微点拨:
①周期表的左下方是金属性最强的元素(钫),右上方是非金属性最强的元素(氟)。
碱性最强的是FrOH,酸性最强的含氧酸是HClO4。
②由于元素的金属性和非金属性之间没有严格的界线,因此,位于分界线附近的元素既能表现出一定的金属性,又能表现出一定的非金属性。
③元素的化合价与元素在周期表中的位置之间关系
主族元素的最高正化合价,等于原子所能失去或偏移的最外层电子数;
而非金属的负化合价则等于使原子达到8电子稳定结构所需得到的电子数。
所以,非金属元素的最高正化合价和它的负化合价的绝对值之和等于8。
即:
a.最高正化合价=族序数=原子最外层电子数(O、F除外);
b.最高正化合价+最低负化合价绝对值=8。
二、元素周期表和元素周期律的应用
1.根据同周期、同主族元素性质的递变规律判断元素性质的强弱(或大小)。
2.应用于元素“位置—结构—性质”的相互推断。
3.预测新元素
为新元素的发现,以及预测它们的原子结构和性质提供线索。
4.寻找新物质
(1)在金属与非金属分界处可以寻找半导体材料。
(2)研究氟、氯、硫、磷、砷附近元素,制造新农药。
(3)在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料。
思考:
(1)从第ⅢA族的硼到第ⅦA族的砹连成一条斜线,即为金属元素和非金属元素的分界线,分界线附近元素的性质有何特点?
这些元素可制取什么材料?
提示:
分界线附近的元素既有一定的金属性,又有一定的非金属性。
这些元素可以制取半导体材料。
(2)短周期元素R的氢化物的化学式为H2R,则该元素最高价氧化物对应水化物的化学式是什么?
该元素最高价氧化物对应水化物的化学式为H2RO4。
(1)根据元素周期律可知金属性最强的是钫,非金属性最强的是氦()
(2)金属不可能具有非金属性,非金属不可能具有金属性()
(3)锗元素属于金属元素,但也具有一定的非金属性()
(4)在金属与非金属分界线附近寻找催化剂材料()
(3)√(4)×
2.根据元素所在元素周期表的位置,判断下列元素都能作为半导体材料的是()
A.Si、K
B.C、Si
C.Si、Ge
D.As、Se
在元素周期表中,在金属与非金属的分界处可以找到半导体材料,如Si、Ge可用作半导体材料。
3.主族元素锗的最高化合价为+4价,且锗位于硅的下一周期,写出“锗”在周期表中的位置________。
根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是________。
硅和锗单质分别与H2反应时,反应较难进行的是________(填“硅”或“锗”)。
第四周期ⅣA族;
半导体材料;
锗
同一元素的“位、构、性”关系
元素的原子结构决定了元素在周期表中的位置和元素的主要性质,元素在周期表中的位置反映了元素的原子结构和元素的主要性质,故三者之间可相互推断。
1.结构与位置互推是解题的基础
(1)掌握四个关系式
①电子层数=周期数。
②质子数=原子序数。
③主族元素原子最外层电子数=主族序数。
④主族元素的最高正价=族序数,最低负价=主族序数-8。
(2)熟练掌握周期表中的一些特殊规律
①各周期元素种类数(分别为2、8、8、18、18、32、32)。
②稀有气体元素原子序数(分别为2、10、18、36、54、86、118)和所在周期(分别在一到七周期)。
③同族上下相邻元素原子序数的关系(相差2、8、18、32、32)。
④同周期ⅡA族与ⅢA族元素原子序数差值(有1、11、25等情况)。
2.性质与位置互推是解题的关键
熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:
(1)原子半径。
(2)元素的主要化合价。
(3)元素的金属性、非金属性。
(4)单质的氧化性、还原性。
(5)气态氢化物的稳定性。
(6)最高价氧化物对应水化物的酸碱性。
(7)金属从H2O或酸中置换H2的难易程度。
3.结构和性质的互推是解题的要素
(1)电子层数和最外层电子数决定元素原子的金属性和非金属性强弱。
(2)同主族元素最外层电子数相同,化学性质相似。
(3)正确推断原子半径和离子半径的大小及结构特点。
(4)判断元素金属性和非金属性强弱。
典例:
下图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是()
a
b
c
d
e
A.元素b位于ⅥA族,有+6、-2两种常见化合价
B.五种元素中,元素e的性质最稳定
C.原子半径有d>
c>
D.元素e参与形成的化合物可以作为一种半导体材料
D
根据各元素在周期表中的物质可知,a、b、c、d、e分别是He、O、P、Cl、As。
元素b是O元素,位于ⅥA族,只有-2、-1两种常见化合价,没有+6价,A错误;
五种元素中,元素a的原子具有最外层2个电子的稳定结构,所以它的性质最稳定,B错误;
同一周期的元素,原子序数越小,原子半径越大,不同周期的元素,原子核外电子层数越多,原子半径就越大,所以原子半径有c>
d>
b,C错误;
元素e处于金属与非金属交界处,所以该元素参与形成的化合物可以作为一种半导体材料,D正确。
【反馈检测】
第一课时
1.元素的以下性质,随着原子序数递增不呈现周期性变化的是()
A.化合价
B.原子半径
C.元素的金属性和非金属性
D.相对原子质量
由元素周期律的内容知,元素的化合价、原子半径及金属性和非金属性都随着原子序数的递增呈周期性变化,而相对原子质量随原子序数的递增呈现增大的变化趋势,绝不会出现周期性的变化。
2.下列排列顺序不正确的是()
A.原子半径:
钠>
硫>
氯
B.最高价氧化物对应的水化物的酸性:
HClO4>
H2SO4>
C.最高正化合价:
氯>
磷
D.热稳定性:
碘化氢>
溴化氢>
氯化氢
钠、硫、氯是具有相同电子层数的元素,随着原子序数的递增,原子半径逐渐减小,最外层电子数逐渐增多,最高正化合价逐渐增大,最高价氧化物对应的水化物的酸性逐渐增强,碱性逐渐减弱。
因为非金属性Cl>
Br>
I,所以气态氢化物的热稳定性HCl>
HBr>
HI,D项错误。
3.X、Y两是同周期的非金属主族元素,如果X原子半径比Y的大,下面说元素法正确的是()
A.最高价氧化物对应水化物的酸性,X的比Y的强
B.X的非金属性比Y的强
C.X的阴离子比Y的阴离子还原性强
D.X的气态氢化物比Y的稳定
X原子半径比Y的大,说明X在Y的左边,原子序数X比Y的小,X的非金属性比Y的弱,因此最高价氧化物对应水化物的酸性X比Y的弱,X的阴离子比Y的阴离子还原性强,X的气态氢化物不如Y的稳定。
4.已知下列原子的半径:
原子
半径r/10-10m
0.75
1.02
0.74
1.17
根据以上数据,磷原子的半径可能是()
A.1.10×
10-10m
B.0.80×
C.1.20×
D.0.70×
A
根据元素周期律可知,磷原子的半径应在Si和S之间。
5.结合元素周期律和元素周期表的有关知识,用化学用语回答下列问题:
(1)在第三周期元素及其单质和化合物中,原子半径最小的元素是________;
氧化性最强的单质是________,还原性最强的单质是________;
最高价氧化物对应水化物中,最强的碱是________;
形成的两性化合物________、________。
(2)卤族元素氢化物中最稳定的是________,还原性最强的是________,请总结同周期、同主族元素性质递变规律是________________________________________________。
(1)同一周期,核电荷数越大,原子半径越小(稀有气体除外),第三周期Cl元素核电荷数最大,故其原子半径最小;
同一周期,从左到右元素非金属性逐渐增强(稀有气体除外),Cl元素非金属性最强,故单质中Cl2氧化性最强;
同一周期,从左到右元素金属性逐渐减弱(稀有气体除外),第三周期金属性最强的为Na;
铝元素形成的两性化合物有Al2O3、Al(OH)3。
(2)卤族元素,从上到下,原子半径依次增大,原子核对最外层的电子的吸引能力逐渐减弱,在其形成的气态氢化物中,卤族元素的原子对氢原子的吸引能力依次减小,所以卤族元素形成的氢化物的热稳定性依次减弱,所以热稳定性:
HF>
HCl>
HI;
同一周期,从左到右,元素的金属性逐渐减弱,非金属性逐渐增强;
同一主族,从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。
(1)Cl;
Cl2;
Na;
NaOH;
Al(OH)3;
Al2O3
(2)HF;
同一主族,从上到下,元素的金属性逐渐增强,非金属性逐渐减弱
第二课时
1.元素在周期表中的位置,反映了元素的原子结构和元素的性质。
下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子、最外层电子数相同,化学性质完全相同
位于周期表中金属与非金属分界线上的元素(如Al)既能表现金属性,又能表现非金属性,A错;
H+最外层无电子,H-、Li+最外层只有两个电子,C错;
同主族元素的原子,化学性质有相似性,但并不完全相同,D错;
第三周期元素的最高正化合价由ⅠA~ⅦA族分别为+1、+2、+3、+4、+5、+6、+7价等于它所处的主族序数,B正确。
2.科学家已正式将原子序数为114的元素命名为钅夫,下面关于它的原子结构和性质预测不正确的是()
A.该元素原子的最外层电子数为4
B.其常见价态为+2、+4
C.它的金属性比铅强
D.它的原子半径比第115号元素的原子半径小
根据114号元素的原子序数,可推知该元素在周期表中位于第七周期,第ⅣA族,其与碳是同一主族元素,该元素最外层电子数为4,其有+2价、+4价,A、B项正确;
114号元素与铅为同一主族元素,根据同主族元素从上到下金属性逐渐增强,可知该元素的金属性比铅强,C项正确;
114号元素与115号元素位于同一周期,根据同周期元素原子半径逐渐减小可知,114号原子半径大于115号原子半径,D项不正确。
3.第ⅡA族元素从第二周期到第六周期的元素分别是Be(铍)、Mg(镁)、Ca(钙)、Sr(锶)、Ba(钡)。
下列关于ⅡA族元素预言可能正确的是()
①常温下,单质铍能与水剧烈反应放出H2
②常温下,单质钡能与水剧烈反应放出H2
③Be(OH)2易溶于水
④Ba(OH)2易溶于水
⑤SrCO3易溶于水
A.①②③
B.③⑤
C.②④
D.①②③④⑤
同主族从上到下,金属性逐渐增强,与水反应越来越剧烈,即常温下,单质钡能与水剧烈反应放出H2,①错误,②正确;
Mg(OH)2难溶于水,Ca(OH)2微溶于水,推出Be(OH)2难溶于水,③错误;
Ba(OH)2是易溶于水的强碱,④正确;
根据MgCO3、CaCO3、BaCO3难溶于水,因此SrCO3难溶于水,⑤错误。
4.如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示。
下列说法正确的是()
A.虚线左下方的元素均为非金属元素
B.紧靠虚线两侧的元素都是具有金属性和非金属性的金属元素
C.可在虚线附近寻找半导体材料(如Ge、Si等)
D.可在虚线的右上方,寻找耐高温材料
A项,虚线左下方的元素均为金属元素,错误;
B项,紧靠虚线两侧的元素不一定都是金属元素,如硅是非金属元素,错误;
C项,元素周期表中的金属元素和非金属元素分界线附近的元素往往都既具有金属性,也具有非金属性,可在虚线附近寻找半导体材料(如Ge、Si等),正确;
D项,在过渡元素中可寻找耐高温材料,在非金属元素中寻找制农药的元素,错误。
5.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。
A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。
请回答下列问题:
(1)C在元素周期表中的位置为________,G的原子结构示意图是________。
(2)D与E按原子个数比1∶1形成化合物甲,其化学式为_____,向甲中滴加足量水时发生反应的化学方程式是________________。
(3)E、F、G形成的简单离子,半径由大到小顺序是______________________。
(用离子符号表示)
(1)由题给信息知A为H,B为C,D为O,E为Na,F为S,G为Cl,由B、D可知C为N。
(2)Na与O可形成Na2O、Na2O2,Na2O2与H2O反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑。
(3)Na+核外电子排布示意图为
,Cl-、S2-核外电子排布示意图为
,故离子半径:
S2->
Cl->
Na+。
(1)第二周期ⅤA族;
(2)Na2O2;
2Na2O2+2H2O===4NaOH+O2↑
(3)S2->
Na+