高考化学真题选择题Word文件下载.docx
《高考化学真题选择题Word文件下载.docx》由会员分享,可在线阅读,更多相关《高考化学真题选择题Word文件下载.docx(17页珍藏版)》请在冰豆网上搜索。
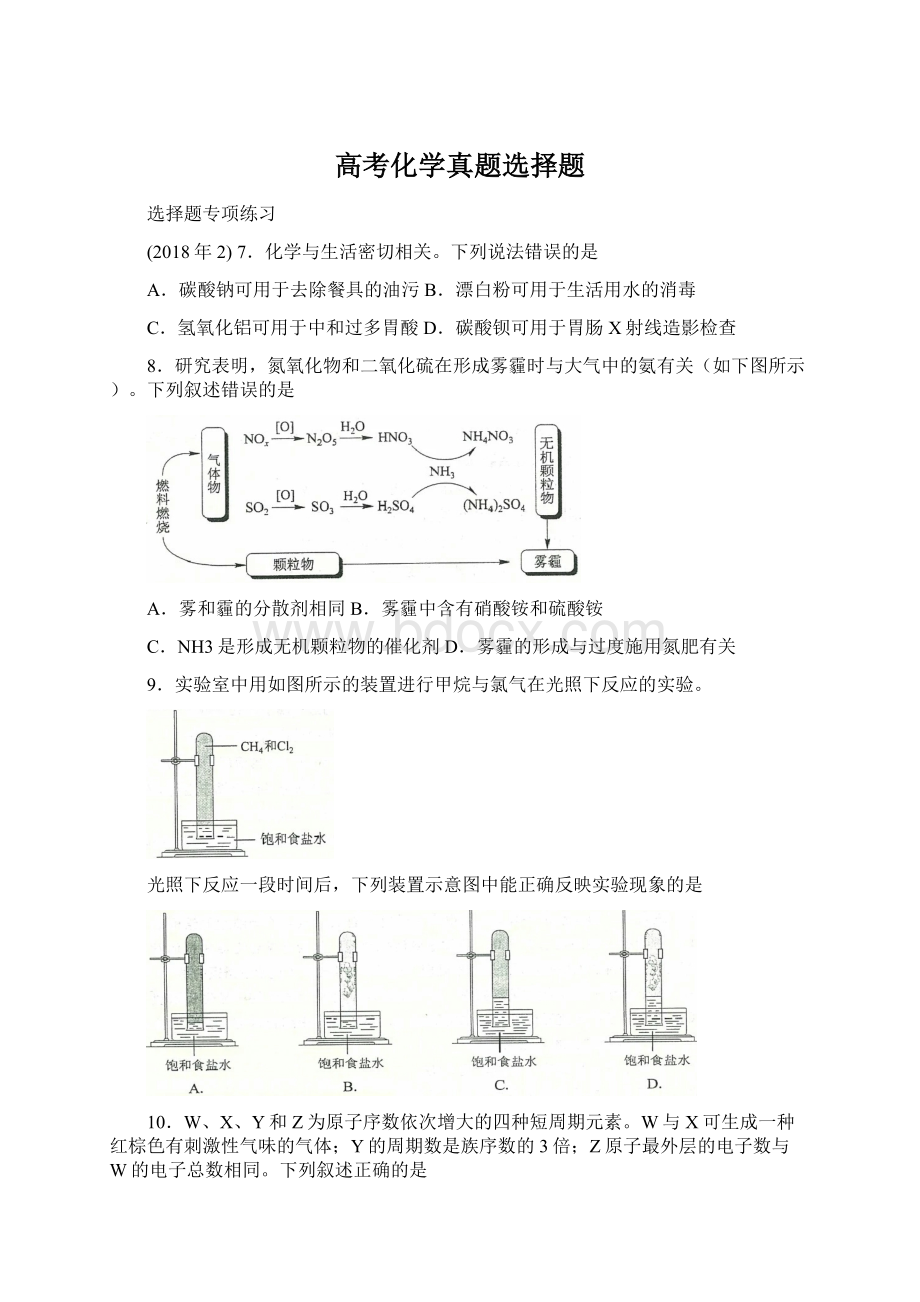
Na++e−
Na
13.下列实验过程可以达到实验目的的是
编号
实验目的
实验过程
A
配制0.4000mol·
L−1的NaOH溶液
城区4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容
B
探究维生素C的还原性
向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C
制取并纯化氢气
向稀盐酸中加入锌粒,将生产的气体依次通过NaOH溶液、浓盐酸和KMnO4溶液
D
探究浓度对反应速率的影响
向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象
(2018年1)7.硫酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
A.合理处理废旧电池有利于保护环境和资源再利用
B.从“正极片”中可回收的金属元素有Al、Fe、Li
C.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠
8.下列说法错误的是
A.蔗糖、果糖和麦芽糖均为双糖B.酶是一类具有高选择催化性能的蛋白质
C.植物油含不饱和脂肪酸酯,能使Br₂/CCl4褪色
D.淀粉和纤维素水解的最终产物均为葡萄糖
9.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是
10.NA是阿伏加德罗常数的值,下列说法正确的是
A.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
B.22.4L(标准状况)氨气含有的质子数为18NA
C.92.0g甘油(丙三醇)中含有羟基数为1.0NA
D.1.0molCH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
11.环之间共用一个碳原子的化合物称为螺环化合物,螺2,2]戊烷(
)是最简单的一种。
下列关于该化合物的说法错误的是
A.与环戊烯互为同分异构体B.二氯代物超过两种
C.所有碳原子均处同一平面D生成1molC5H12至少需要2molH2
12.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W、X、Z最外层电子数之和为10;
W与Y同族;
W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。
A.常温常压下X的单质为气态B.Z的氢化物为离子化合物
C.Y和Z形成的化合物的水溶液呈碱性D.W与Y具有相同的最高化合价
13.最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。
示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
1EDTA-Fe2+-e-=EDTA-Fe3+②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A.阴极的电极反应:
CO2+2H++2e-=CO+H2OB.协同转化总反应:
CO2+H2S=CO+H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
(2018北京)6.下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
A.甲醇低温所制氢气用于新能源汽车
B.氘、氚用作“人造太阳”核聚变燃料
C.偏二甲肼用作发射“天宫二号”的火箭燃料
D.开采可燃冰,将其作为能源使用
7.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。
该历程示意图如下。
下列说法不正确的是
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C―H键发生断裂
C.①→②放出能量并形成了C―C键
D.该催化剂可有效提高反应物的平衡转化率
8.下列化学用语对事实的表述不正确的是
A.硬脂酸与乙醇的酯化反应:
C17H35COOH+C2H518OH
C17H35COOC2H5+H218O
B.常温时,0.1mol·
L-1氨水的pH=11.1:
NH3·
H2O
+OH−
C.由Na和C1形成离子键的过程:
D.电解精炼铜的阴极反应:
Cu2++2e−
Cu
9.下列实验中的颜色变化,与氧化还原反应无关的是
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
Na2S溶液滴入AgCl浊液中
热铜丝插入稀硝酸中
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
沉淀由白色逐渐变为黑色
产生无色气体,随后变为红棕色
10.一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。
其结构片段如下图
下列关于该高分子的说法正确的是
A.完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B.完全水解产物的单个分子中,含有官能团―COOH或―NH2
C.氢键对该高分子的性能没有影响
D.结构简式为:
11.测定0.1mol·
L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻
①
②
③
④
温度/℃
25
30
40
pH
9.66
9.52
9.37
9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
A.Na2SO3溶液中存在水解平衡:
+H2O
B.④的pH与①不同,是由于
浓度减小造成的
C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致D.①与④的Kw值相等
12.验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
A.对比②③,可以判定Zn保护了FeB.对比①②,K3[Fe(CN)6]可能将Fe氧化
C.验证Zn保护Fe时不能用①的方法D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
(2017年2)7.下列说法错误的是
A.糖类化合物也可称为碳水化合物B.维生素D可促进人体对钙的吸收
C.蛋白质是仅由碳、氢、氧元素组成的物质D.硒是人体必需的微量元素,但不宜摄入过多
8.阿伏加德罗常数的值为NA。
A.1L0.1mol·
L-1NH4Cl溶液中,NH4+的数量为0.1NA
B.2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D.0.1molH2和0.1molI2于密闭容器中充分反应后,其分子总数为0.2NA
9.a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;
c所在周期数与族数相同;
d与a同族。
A.原子半径:
d>
c>
b>
aB.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱D.d单质的氧化性比a单质的氧化性强
10.下列由实验得出的结论正确的是
结论
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2-二溴乙烷无色、可溶于四氯化碳
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的氯甲烷具有酸性
11.用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4—H2C2O4混合溶液。
A.待加工铝质工件为阳极B.可选用不锈钢网作为阴极
C.阴极的电极反应式为:
Al3++3e-====AlD.硫酸根离子在电解过程中向阳极移动
12.改变0.1mol•L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知
]。
A.pH=1.2时,c(H2A)=c(HA-)B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>
c(H2A)=(A2-)D.pH=4.2时,c(HA-)=c(A2-)=(H+)
13.由下列实验及现象不能推出相应结论的是
实验
现象
结论
向2mL0.1mol•L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:
Fe>
Fe2+
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)<
Ksp(AgCl)
(2017北京)6.古丝绸之路贸易中的下列商品,主要成分属于无机物的是
A.瓷器
B.丝绸
C.茶叶
D.中草药
7.2016年IUPAC命名117号元素为Ts(中文名“
”,tiá
n),Ts的原子核外最外层电子数是7。
A.Ts是第七周期第ⅦA族元素B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱D.中子数为176的Ts核素符号是
8.下列变化中,气体被还原的是
A.二氧化碳使Na2O2固体变白B.氯气使KBr溶液变黄
C.乙烯使Br2的四氯化碳溶液褪色D.氨气使AlCl3溶液产生白色沉淀
9.我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:
A.反应①的产物中含有水B.反应②中只有碳碳键形成
C.汽油主要是C5~C11的烃类混合物D.图中a的名称是2-甲基丁烷
10.根据SO2通入不同溶液中实验现象,所得结论不正确的是
溶液
含HCl、BaCl2的
产生白色沉淀
SO2有还原性
H2S溶液
产生黄色沉淀
SO2有氧化性
酸性KMnO4溶液
紫色溶液褪色
SO2有漂白性
Na2SiO3溶液
产生胶状沉淀
酸性:
H2SO3>
H2SiO3
11.聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如下:
(图中虚线表示氢键)
A.聚维酮的单体是
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质
D.聚维酮在一定条件下能发生水解反应
12.下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
(2016年2)7.下列关于燃料的说法错误的是
A.燃料燃烧产物CO2是温室气体之一B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染D.燃料不完全燃烧排放的CO是大气污染物之一
8.下列各组中的物质均能发生就加成反应的是
A.乙烯和乙醇B.苯和氯乙烯C.乙酸和溴乙烷D.丙烯和丙烷
9.a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+的电子层结构相同,d与b同族。
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d与a形成的化合物的溶液呈弱酸性
10.分子式为C4H8Cl2的有机物共有(不含立体异构)
A.7种B.8种C.9种D.10种
11.Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。
A.负极反应式为Mg–2e–=Mg2+B.正极反应式为Ag++e–=Ag
C.电池放电时Cl–由正极向负极迁移D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
12.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解:
再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀盐酸有气泡产生,震荡后仍有固体存在。
该白色粉末可能为
A.NaHCO3、Al(OH)3B.AgCl、NaHCO3C.Na2SO3、BaCO3D.Na2CO3、CuSO4
13.下列实验操作能达到实验目的的是
实验操作
A.
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和FeCl3溶液中
B.
由MgCl2溶液制备无水MgCl2
将MgCl2溶液加热蒸干
C.
除去Cu粉中混有的CuO
加入稀硝酸溶液,过滤、洗涤、干燥
D.
比较水与乙醇中氢的活泼性
分别将少量钠投入到盛有水和乙醇的烧杯中
(2016年1)7.化学与生活密切相关,下列有关说法错误的是学科&
网
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热会产生稠环芳香烃等有害物质
C.加热能杀死流感病毒是因为蛋白质受热变性
D.医用消毒酒精中乙醇的浓度为95%
8.设NA为阿伏加德罗常数值。
下列有关叙述正确的是
A.14g乙烯和丙烯混合气体中的氢原子数为2NAB.1molN2与4molH2反应生成的NH3分子数为2NA
C.1molFe溶于过量硝酸,电子转移数为2NAD.标准状况下,2.24LCCl4含有的共价键数为0.4NA
9.下列关于有机化合物的说法正确的是
A.2-甲基丁烷也称异丁烷B.由乙烯生成乙醇属于加成反应
C.C4H9Cl有3中同分异构体D.油脂和蛋白质都属于高分子化合物
10.下列实验操作能达到实验目的的是
A.用长颈漏斗分离出乙酸与乙醇反应的产物
B.用向上排空气法收集铜粉与稀硝酸反应产生的NO
C.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D.将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
11.三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和
可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
A.通电后中间隔室的
离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
12.298K时,在20.0mL0.10mol
氨水中滴入0.10mol
的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
已知0.10mol
氨水的电离度为1.32%,下列有关叙述正确的是
A.该滴定过程应该选择酚酞作为指示剂B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中
D.N点处的溶液中pH<
12
13.短周期元素W、X、Y、Z的原子序数依次增加。
m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol·
L–1r溶液的pH为2,s通常是难溶于水的混合物。
上述物质的转化关系如图所示。
A.原子半径的大小W<
X<
YB.元素的非金属性Z>
X>
Y
C.Y的氧化物常温常压下为液态D.X的最高价氧化物的水化物为强酸
(2015年2)7.食品干燥剂应无毒、无味、无腐蚀性及环境友好。
A.硅胶可用作食品干操剂B.P2O5不可用作食品干操剂
C.六水氯化钙可用作食品干燥剂D.加工后具有吸水性的植物纤维可用作食品干燥剂
8.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A.C14H18O5B.C14H16O4C.C16H22O5D.C16H20O5
9.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。
a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。
A.元素的非金属性次序为c>
aB.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
10.NA代表阿伏加德罗常数的值。
A.60g丙醇中存在的共价键总数为10NA
B.1L0.1mol·
L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C.钠在空气中燃烧可生成多种氧化物。
23g钠充分燃烧时转移电子数为1NA
D.235g核互
U发生裂变反应:
U+
n
Sr+
U+10
n,净产生的中子(
n)数为10NA
11.分子式为
并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体结构)
A.3种B.4种C.5种D.6种
12.海水开发利用的部分过程如图所示。
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
13.用右图所示装置进行下列实验:
将①中溶液滴入②中,预测的现象与实际相符的是
答案:
(2018年2)7.D8.C9.D10.A11.C12.D13.B
(2018年1)7.D8.A9.D10.B11.C12.B13.C
(2018北京)6.B7.D8.A9.C10.B11.C12.D13.A
(2017年2)7C8D9B10A11C12D13C
(2017北京)6.A7.D8.B9.B10.C11.B12.D
(2016年2)7~13BBACBDB
(2016年1)7.D8A9.B10.C11.D12.B13.C
(2015年2)7.C8.A9.B10.C11.B12.C13.D