化学必修一知识网络图.doc
《化学必修一知识网络图.doc》由会员分享,可在线阅读,更多相关《化学必修一知识网络图.doc(8页珍藏版)》请在冰豆网上搜索。
必修一
第一章《从实验学化学》知识网络归纳
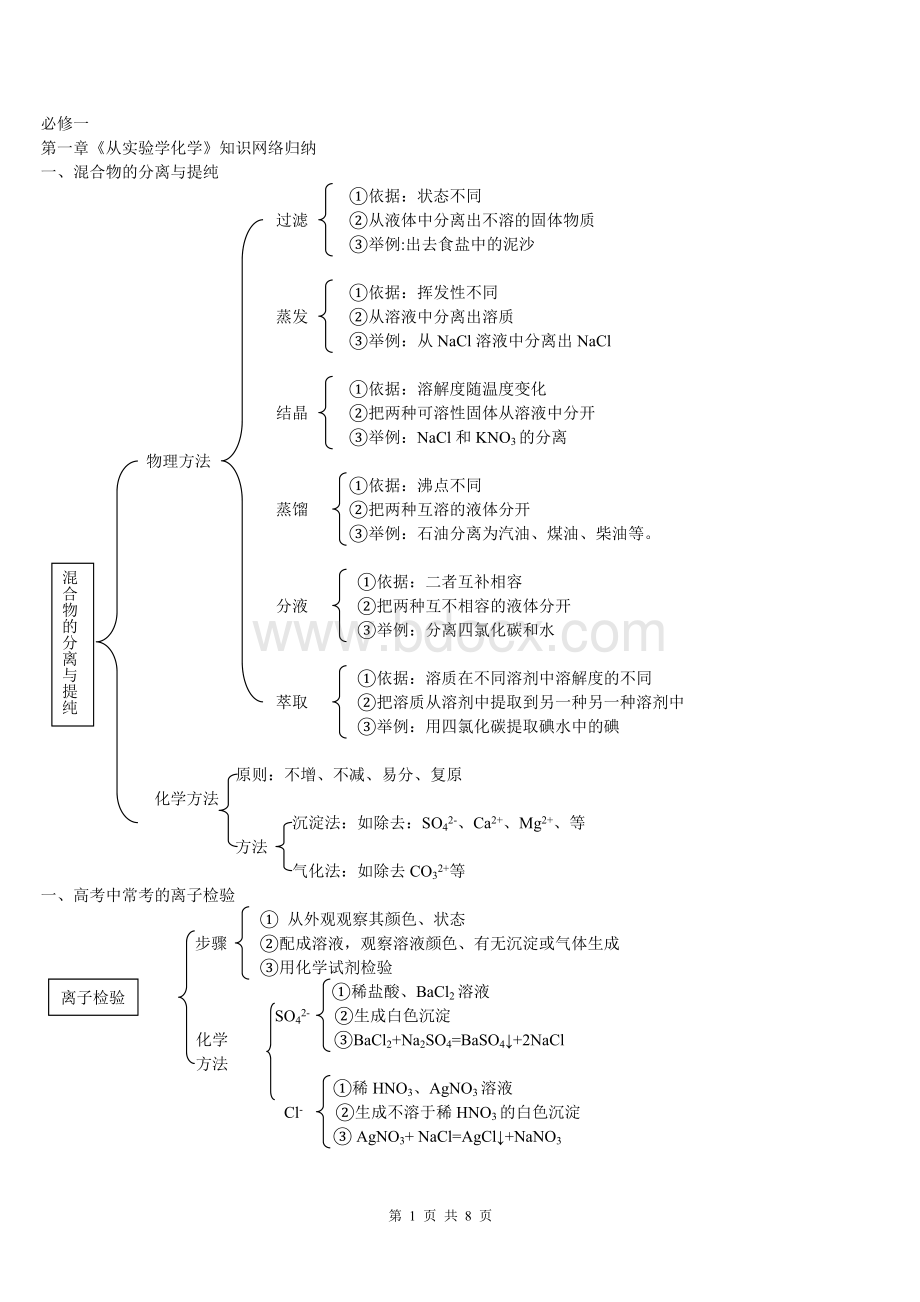
一、混合物的分离与提纯
①依据:
状态不同
过滤②从液体中分离出不溶的固体物质
③举例:
出去食盐中的泥沙
①依据:
挥发性不同
蒸发②从溶液中分离出溶质
③举例:
从NaCl溶液中分离出NaCl
①依据:
溶解度随温度变化
结晶②把两种可溶性固体从溶液中分开
③举例:
NaCl和KNO3的分离
物理方法
①依据:
沸点不同
蒸馏②把两种互溶的液体分开
③举例:
石油分离为汽油、煤油、柴油等。
混合物的分离与提纯
①依据:
二者互补相容
分液②把两种互不相容的液体分开
③举例:
分离四氯化碳和水
①依据:
溶质在不同溶剂中溶解度的不同
萃取②把溶质从溶剂中提取到另一种另一种溶剂中
③举例:
用四氯化碳提取碘水中的碘
原则:
不增、不减、易分、复原
化学方法
沉淀法:
如除去:
SO42-、Ca2+、Mg2+、等
方法
气化法:
如除去CO32+��等
一、高考中常考的离子检验
①从外观观察其颜色、状态
步骤②配成溶液,观察溶液颜色、有无沉淀或气体生成
离子检验
③用化学试剂检验
①稀盐酸、BaCl2溶液
SO42-②生成白色沉淀
化学③BaCl2+Na2SO4=BaSO4↓+2NaCl
方法
①稀HNO3、AgNO3溶液
Cl-②生成不溶于稀HNO3的白色沉淀
③AgNO3+NaCl=AgCl↓+NaNO3
二、物质的量及物质的量浓度物质的微粒(分子、原子、离子、电子等)数N
物质的质量
m(g)
×NA×M
物质的量
÷×NAn(mol)÷M
溶质的微粒(分子、离子等)数N
物质的质量
(g)
×溶质的摩尔质量 ×NA
m溶质的物质的量
÷溶质的摩尔质量÷NA
、、
÷×
溶质的体积(L)
溶质的体积(L)
物质的量浓度
CB(mol/L)
×溶质摩尔质量1000ρ
1000ρ×溶质摩尔质量
溶质质量分数
第二章《化学物质及其分类》知识网络归纳
一、物质的分类。
金属:
Na、Mg、Al
单质
非金属:
S、O、N
酸性氧化物:
SO3、SO2、P2O5等
氧化物碱性氧化物:
Na2O、CaO、Fe2O3
氧化物:
Al2O3等
纯盐氧化物:
CO、NO等
净含氧酸:
HNO3、H2SO4等
物按酸根分
无氧酸:
HCl
强酸:
HNO3、H2SO4、HCl
酸按强弱分
弱酸:
H2CO3、HClO、CH3COOH
化一元酸:
HCl、HNO3
合按电离出的H+数分二元酸:
H2SO4、H2SO3
物多元酸:
H3PO4
强碱:
NaOH、Ba(OH)2
物按强弱分
质弱碱:
NH3·H2O、Fe(OH)3
碱
一元碱:
NaOH、
按电离出的HO-数分二元碱:
Ba(OH)2
多元碱:
Fe(OH)3
正盐:
Na2CO3
盐酸式盐:
NaHCO3
碱式盐:
Cu2(OH)2CO3
溶液:
NaCl溶液、稀H2SO4等
混悬浊液:
泥水混合物等
合乳浊液:
油水混合物
物胶体:
Fe(OH)3胶体、淀粉溶液、烟、雾、有色玻璃等
化合反应:
A+BAB
聚反应物和生成物类别分解反应:
ABA+B
以及
反应前后物质种类的多少置换反应:
A+BCB+AC
复分解反应:
AB+CDAD+CB
实质:
有电子转移(得失或偏移)
氧化特征:
反应前后元素的化合价有变化
还原
根据反应概念氧化剂→有氧化性→得电子→化合价降低→发生还原反应→还原产物
反应及其反↓↓↓↓↓↓
中是相互应同时存在同时体现总数相等总数相等同时发生同时产生
化否有关系物↓↓↓↓↓↓
学电子还原剂→有还原性→失电子→化合价升高→发生氧化反应→氧化产物
反转移
应
非氧化还原反应
定义:
有离子参加的一类反应反
发生条件(复分解类型):
生成难容物质、难电离物质、挥发性物质
写:
写出反应的化学方程式
离子反应拆:
把易溶于水、易电离的物质拆成离子形式
书写
方法删:
将不参加反应的离子从方程式两端删去
离子方程式查:
查方程式两端原子个数和电荷数是否相等
根据反应中是
否有离子参加表示一类化学反应
特点
揭示了化学反应的实质
分子反应
三、三类分散系的比较
第三章《金属及其化合物》知识网络归纳
一、部分金属与其重要化合物之间的转化关系。
1、钠及其重要化合物之间的转化关系
Na2O2CO2
O2
点
燃
S
CO2、H2O
Ca(OH)2
O
Ca(OH)2
Na2SNaH2ONaOHC2NaCO3NaHCO3
HCl
NaCl
熔融电解
2、铝及其化合物之间的转化关系
NaOHAl①HCl②Cl③加热
电解①O2点燃
②Fe2O3高温
Al2O3
△
HCl
NH3·H2O
NaAlO3NaOHAl(OH)3AlCl3
H2O
KAl(SO4)2
3、铁及其重要化合物之间的转化关系
Fe2O3FeFeCl2Fe(OH)2Fe(OH)3FeCl3Fe(SCN)3