精选贵州省学年高三下学期普通高等学校招生适应性考试理综化学试题word版附参考答案Word下载.docx
《精选贵州省学年高三下学期普通高等学校招生适应性考试理综化学试题word版附参考答案Word下载.docx》由会员分享,可在线阅读,更多相关《精选贵州省学年高三下学期普通高等学校招生适应性考试理综化学试题word版附参考答案Word下载.docx(9页珍藏版)》请在冰豆网上搜索。
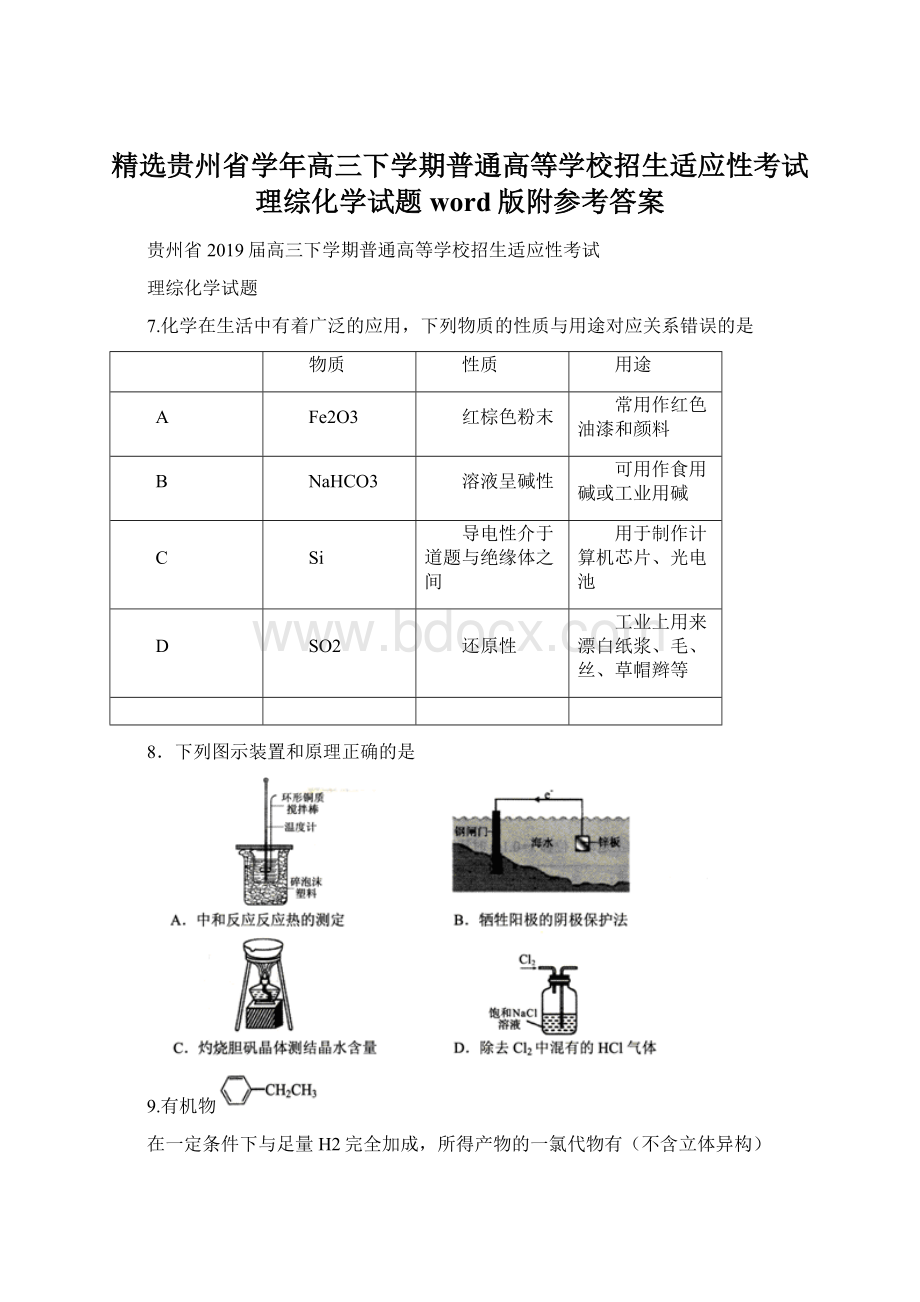
9.有机物
在一定条件下与足量H2完全加成,所得产物的一氯代物有(不含立体异构)
A.4种B.5种C.6种D.7种
10.下列说法正确的是
A.乙烯和乙醇均能被酸性高锰酸钾溶液氧化
B.甲烷和苯均可在光照的条件下与氯气发生取代反应
C.分子式为C2H6O的有机物均可在一定条件下与乙酸发生酯化反应
D.蛋白质、油脂、葡萄糖均可在一定条件下发生水解反应
11.某同学设计如下图所示装置,用电解法把Na2CrO4溶液转变为Na2Cr2O7溶液(2CrO42-+2H+=Cr2O72-+H2O)。
下列说法正确的是
A.A为正极,B为负极
B.电解过程中,电解槽左侧溶液pH增大
C.电解过程中,Na+在电解槽中自左向右迁移
D.当电路中通过lmol电子时,阴极生成0.5molNa2Cr2O7
12.四种短周期元素在周期表中的相对位置如下表所示。
X元素最常见伙态氮化物与其最高价氧化物对应的水化物反应可以生成一种离子化合物.下列说法正确的是
X
Y
Z
W
A.简单离子半径:
W>
Z>
Y
B.气态氢化物的稳定性:
Y>
W
C.最常见气态氢化物的沸点:
X>
Z
D.最高价氧化物对应的水化物酸性:
Z>
13.25℃时,下列关系式正确的是
A.pH=2的CH3COOH溶液与pH=12的Na0H溶液等体积混合:
c(Na+)=c(CH3COO-)>
c(CH3COOH)
B.盐酸与FeCl3的混合溶液pH=2,稀释10倍后:
pH<
3
C.pH相同的①NH4HSO4、②NH4Cl、③(NH4)2SO4三种溶液的c(NH4+):
③>①>②
D.pH=3的H2C2O4溶液:
c(H+)=c(HC2O4-)+c(OH-)=1×
10-3mol/L
26.(15分)
辉铜矿是铜矿的主要品种之一传统的火法冶炼在资源的综合利用、环境保护等方面会遇到困难。
辉铜矿的湿法冶炼目前国内外都处于探索阶段。
自氧化还氨氮分离法是一种较为理想的湿法冶炼方法,工艺流程如下图所示:
已知:
①辉铜矿的主要成分是Cu2S,含有较多的Fe2O3、SiO2等。
②软锰矿的主要成分是MnO2,含有较多的SiO2等。
③浸出时,生成一种非金属单质。
④室温下,Kap[Fe(OH)3]=4.0×
10-8mol/L,Kap[Fe(OH)2]=8.0×
10-16mol/L
完成下列填空:
(l)浸出前需要先将矿石粉碎,其目的是。
(2)写山浸出时主要反应的离子方程式。
(3)浸渣A的主要成分为;
调溶液pH3.0-3.5的目的是除去离子;
室温下,若该离子的浓度为4.0×
10-8mol/L,则溶液的pH=。
(4)工业上可将MnCO3、在300℃左右氧化来制取具有较好催化性能的MnO2,则MnCO3在空气中受热制取MnO2的化学方程式为。
(5)从滤液C中提取硫酸氨晶体的步骤为、、过滤、洗涤、干操。
(6)与火法冶炼辉铜矿相比,用图中方法冶炼辉铜矿的优点有、。
(列举其中2条)
27.(13分)
工业上可用甲烷和氧气按9:
1的体积比混合,在200℃和10MPa的条件下,通过铜制管道反应制得甲醇:
2CH4+O2=2CH3COH。
(1)已知一定条件下,CH4和CH3COH燃烧的热化学方程式分别为:
CH4(g)+SO2(g)=CO2(g)+2H2(g)△H=-802KJ/lmol
CH3COH(g)+l.5O2(g)=CO2(g)+2H2O(g)△H=-677kJ/mol
则2CH4(g)+O2(g)=2CH3OH(g)△H=
(2)甲烷固体氧化物燃料电池属于第三代燃料电池,是一种在中高温下直接将储存在燃料和氧化剂中的化学能高效、环境友好地转化成电能的全固态化学发电装置。
其工作原理如下图所示。
a是电池的极(填“正”或“负”),b极的电极反应式为。
(3)工业上合成甲醇的另一种方法为:
CO(g)+2H2(g)
CH3OH(g)△H=-90KJ/mol
T℃时,将2molCO和4molH2充入1L的密闭容器中,测得H2的物质的量随时间变化如下图实线所示。
①能用于判断反应已达化学平衡状态的是。
A.气体的总压强不再改变
B.H2与CH3OH的体积比不再改变
C.气体的密度不再改变
D.单位时间内消耗lmolCO,同时生成lmolCH3OH
②请计算出T℃时反应的平衡常数K=。
③仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。
曲线Ⅰ对应的实验条件改变是:
;
曲线Ⅱ对应的实验条件改变是0。
④a、b、c三点逆反应速率由大到小排列的顺序是。
28.(15分)
三草酸合铁(Ⅲ)酸钾是制备负载活性催化剂的主要原料。
加热至110℃时失去结晶水,230℃时分解。
极易感光,室温下光照变为黄色:
2K3[Fe(C2O4)3]·
3H2O
2FeC2O4·
2H2O+3K2C2O4+2CO2↑+2H2O
物质名称
化学式
相对分子质量
颜色
溶解性
三草酸合铁(Ⅲ)酸钾
K3[Fe(C2O4)3]·
491
翠绿色
可溶于水,难溶于乙醇
草酸亚铁
FeC2O4·
2H2O
180
黄色
难溶于水,可溶于酸
某同学对三草酸合铁(Ⅲ)酸钾的制备及组成进行了实验探究。
回答下列问题:
(一)三草酸合铁(Ⅲ)酸钾的制备
(ⅰ)称取4.50gFeC2O4·
2H2O固体,加入饱和K2C2O4溶液中,用滴管慢慢加入3%H2O2溶液,不断搅拌,并保持温度在40℃左右。
充分反应后,沉淀转化为氧氧化铁。
(ⅱ)加热至沸腾,滴加1mol的草酸溶液至沉淀溶解。
用草酸或草酸钾调节溶液pH=4-5
(ⅲ)小火加热浓缩,冷却结晶,过滤,先用少量冰水洗涤,再用无水乙醇洗涤,低温干燥后称量,得到9.80g翠绿色晶体。
(1)完成步骤(i)发生反应的离子方程式:
FeC2O4·
2H2O+C2O42-+H2O2=Fe(OH)3+4[Fe(C2O4)3]3-+H2O
(2)步骤(ⅲ)中,用无水乙醇洗涤晶体的目的是。
(3)列式计算本实验中三草酸合铁(Ⅲ)酸钾的产率。
(二)草酸根含量侧定
准确称取4.80g三草酸合铁(Ⅲ)酸钾样品,配制成250mL溶液。
量取25.00mL溶液置于锥形瓶中,加入5.0mL1mol/LH2SO4,用0.06mol/L的KMnO4溶液滴定。
滴定终点时消耗KMnO4溶液20.00mL。
(4)滴定过程中,盛放高锰酸钾溶液的仪器名称是,滴定时发生反应的离子方程式为。
(5)样品中草酸根的物质的量为;
若该数值大于4.80g二草酸合铁(Ⅲ)酸钾纯品中草酸根的物质的量,其原因可能是(填字母)。
a.制取过程中草酸或草酸钾用量过多
b.样品未完全干燥
c.滴定时盛放KMnO4溶液的仪器未用标准液润洗
d.锥形瓶洗净后未烘干
(三)某同学制得的三草酸合铁(Ⅲ)酸钾,晶体表面发黄,推测可能有部分晶体发生了分解。
(6)为了验证此推测是否正确,可选用的试剂是。
35.[化学―选修3:
物质结构与性质](15分)
周期表前四周期元素R、X、Y、Z原子序效依次增大,RO2是红棕色气体:
X位于元素周期表ⅣB族:
同周期元素的基态原子中,Y的未成对电子最多;
基态Z+最外层有18个电子。
请回答下列问题:
(l)基态Y原子的价层电子轨道示意图为。
(2)RO3-的立体构型是,写出两个与RO3-其有相同空间构型和键合形式的分子或离子。
(3)R及与R相邻的同周期元素中,第一电离能最大的是(填元素符号),原因是。
(4)若过渡金属离子具有未成对d电子,容易吸收可见光而发生d-d跃迁,因而它们的水合离子常常具有颜色;
若过渡金属离子无未成对d电子,则其水合离子是无色的。
下列水合离子为无色的是
A.X2+B.X4+C.Y3+D.Z2+
(5)右图是Z与金的一种合金晶体的立方晶胞:
①该晶体中,Z与Au的原子个数比为;
②原子坐标参数可表示晶胞内各原子的相对位置。
图示晶胞中,原子坐标参数A为(0,0,0);
B为(0,1/2,1/2)则C原子(底心)的坐标参数为。
③已知该立方晶胞的密度为dg/cm3,NA为阿伏伽德罗常数的值,则晶胞参数(描述晶胞的大小和形状)a=nm。
(列出表达式即可)
36.[化学―选修5:
有机化学基础](15分)
某塑化剂DEHP的结构简式如右图所示,其合成路线如下:
①A的核磁共振氢谱有三组峰。
②
(1)A的结构简式为,B的结构简式为。
(2)C的化学方名称为,反应分两步进行,其反应类型分别为、。
(3)DEHP在稀硫酸催化下水解的化学方程式为。
(4)写出DEHP酸性水解产物中满足下列条件的所有同分异构体的结构简式(不考虑立体异构)。
a.属于芳香族化合物b.核磁共振敏潜有两组峰
(5)写出以D和乙烯为原料(其他无机试剂任选)制备聚邻笨二甲酸乙二醇酯的合成路线。
参考答案
7-13DBCABCB
26.(15分)
(1)增大与酸的接触面积,加快反应速率(或提高浸出效率)(合理即可)(2分)
(2)Cu2S+2MnO2+8H+=Cu2++S+2Mn2++4H2O(2分)
(3)SiO2、S(2分)Fe3+(1分)4(2分)
(4)2MnCO3+O2
2MnO2+2CO2(2分)
(5)蒸发浓缩冷却结晶(各1分)
(6)实现资源的综合利用、不产生污染环境的气体、能耗低等(合理即可)(2分)
27.(13分)
(1)-250KJ/mol(2分)
(2)正(1分)CH4+4O2-8e-=CO2+2H2O(2分)
(3)①AB(2分)②3(mol/L)2(2分,单位不写扣分)③升高温度(1分)增大压强(或增大CO的浓度)(1分)④b>
c>
a(2分)
28.(15分)
(1)663212(2分,错一个口1分,扣完为止)
(2)除去晶体表面的水分(2分)
(3)
(列式正确即可得3分)
(4)酸式滴定管(1分)
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O或
5[Fe(C2O4)3]3-+6MnO4-+48H+=30CO2↑+6Mn2++24H2O+5Fe3+(2分)
(5)0.03mol(2分)ac(2分)
(6)酸化的K3[Fe(CN)6](铁氰化钾)溶液(1分,只答铁氰化钾也得分)(铁氰化钾也可写成铁(Ⅲ)氰化钾)
35.(15分)
(1)
(2分)
(2)平面三角形(1分)CO32-SO3(或SeO3)(2分)
(3)N(1分)N原子3p轨道为半充满状态,相对稳定(2分)
(4)B(1分)
(5)①3:
1(1分)②(1/2,1/2,0)(2分)③
(3分)
36.(15分)
(1)CH2=CHCH3(1分)
(2)2-乙基-1-己醇加成反应消去反应(各1分)
(4)
(各1分)
(5)
(4分,前两步各1分,最后一步2分,加热符号不写不扣分)