碱金属Word文件下载.docx
《碱金属Word文件下载.docx》由会员分享,可在线阅读,更多相关《碱金属Word文件下载.docx(16页珍藏版)》请在冰豆网上搜索。
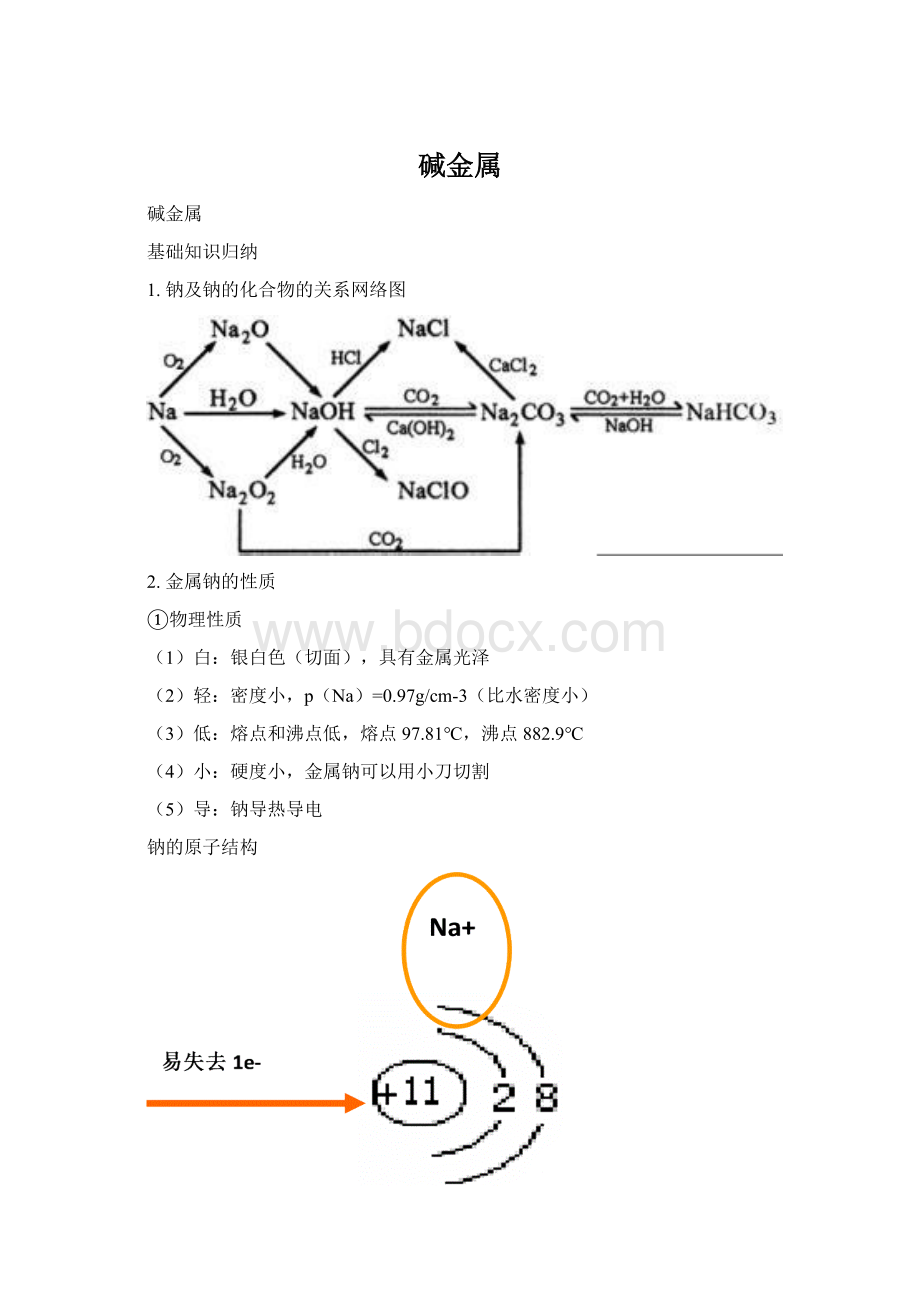
失去2×
e-
Na与水反应
得到2×
2Na+2H2O====2NaOH+H2↑
氧化剂:
H2O还原产物:
H2
还原剂:
Na氧化产物:
NaOH
实验现象:
①浮:
钠浮在水面(钠的密度比水小);
②熔:
熔成一个闪亮的小球(说明反应放热,钠的熔点低);
③游:
小球四处“游动”(反应有气体产生);
④响:
发出“嘶嘶”的响声(反应产生的气体与空气摩擦所致);
⑤消:
小球逐渐消失(与水反应剧烈,速率很快
);
⑥红:
溶液由无色变成红色。
(生成氢氧化钠,呈碱性)
3.钠与酸反应
在酸溶液中有大量的H+钠首先与酸反应,如2Na+2HCL===2NaCl+H2↑
2Na+2H+===2Na++H2↑
钠与酸反应更激烈,极易爆炸,要特别小心。
在酸溶液与钠反应的时候,如果酸是过量的,只考虑钠与酸的反应,如果酸是少量的,既要考虑钠与酸的反应,还要考虑钠与水的反应
4.钠与盐溶液反应
钠活泼性太强,钠与盐溶液(FeCl3、AlCl3、NH4Cl)的反应,先考虑钠与水声称NaOH和H2,然后NaOH再与盐发生复分解反应
2Na+H2O===2NaOH+H2↑2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
2Na+CuSO4+2H2O===Cu(OH)2↓+Na2SO4+H2↑
生成气体和蓝色沉淀
5.钠与熔融的盐的反应
钠与熔融的盐的反应为置换反应:
4Na+TiCl4===Ti+4NaCl
钠做强还原剂,在工业上,可制备稀有金属“钛、钽、铌、镐”
③钠的存在和保存
(1)存在:
钠元素在自然界中分布很广,在海水中储量极为丰富,都是以化合态(化合物形态)存在,即不存在游离态(单质形态)。
(2)保存:
由于钠很容易与空气中的氧气、水反应,所以需要隔绝空气保存。
在实验室中,少量的钠荣昌保存在煤油中(钠沉在煤油下面,与空气隔绝),大块的钠可以用石蜡密封,防止与空气、水接触而反应
④钠的制备
——主要采用电解熔融NaCl的方法。
电解
化学方程式:
通电
2NaCl===2Na+Cl2↑
2NaCl+2H2O===2NaOH+H2↑+Cl2↑
⑤钠的用途
3.钠的氧化物(氧化钠与过氧化钠)的性质
生成条件常温加热
电子式Na+[:
o:
]2-Na+
4.碳酸钠及碳酸氢钠的性质
名称
碳酸钠(Na2CO3)
碳酸氢钠(NaHCO3)
俗名
纯碱或苏打
苏打
物理性质
色态
白色晶体
细小白色晶体
水溶性
易溶于水,溶
液呈碱性
易溶于水(但比Na2CO3溶解度小),溶液呈碱性
稳定性
稳定,但结
晶碳酸钠
(Na2CO3·
10H2O)易风化
不稳定,受热易分解,方程式:
2NaHCO3===NaCO3+CO2↑
+H2O
化
学
性
质
与H+反应
与碱反应[Ca(OH)2]
与OH-不反应,但Ca2++CO
===CaCO3↓
(碱过量)
(碱不足)
与
盐
反
应
CaCl2
不反应
硫酸铝
3HCO
+Al3+===Al(OH)3↓+3CO2↑
主要用途
玻璃、造纸、制皂、
洗涤
发酵、医药、灭火器
相互转化
碳酸钠与碳酸氢钠的鉴别与除杂
鉴别:
分别取样,滴加足量的CaCl2溶液或BaCl2溶液,若有沉淀生成,则是碳酸钠溶液,若无沉淀生成则是碳酸氢钠溶液。
除杂:
Na2CO3固体粉末中混有少量NaHCO3;
加热法
Na2CO3溶液中混有少量NaHCO3;
滴入适量的NaOH
NaHCO3溶液中混有少量Na2CO3。
通入过量的CO2
5.碱金属的递变规律
1.碱金属的一般性与特殊性
(1)一般性
相似性
递变性(由Li→Cs)
原子结构
最外层均为1个电子
电子层数逐渐增多
核电荷数逐渐增大
原子半径逐渐增大
元素性质
都具有较强的金属性,最高正价均为+1价
金属性逐渐增强
单质性质
(除Cs外)都呈银白色,
密度较小,熔点较低
密度逐渐增大(钾反
常),熔点逐渐降低
化学
性质
都具有较强的还原性
还原性逐渐增强;
与O2反应越来越剧烈,产物越来越复杂
(2)特殊性
①碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠的小。
②碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。
③碱金属跟氢气反应生成的碱金属氢化物都是离子化合物,其中氢以H-形式存在,显-1价,碱金属氢化物是强还原剂。
④碱金属所形成的盐均溶于水,并且酸式盐比正盐的溶解度大(但NaHCO3的溶解度比Na2CO3的小)。
6.焰色反应
(1)焰色反应的概念
某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,其属于物理变化,属于元素的性质。
(2)焰色反应的操作
铂丝
无色
待测物
观察火焰颜色
(3)常见元素的焰色
钠元素黄色;
钾元素紫色(透过蓝色钴玻璃观察);
铜元素
黄绿色。
特别提醒
(1)焰色反应为物理变化。
(2)用焰色反应检验钾元素时,需透过蓝色钴玻璃观察。
原因:
含有钾元素的物质常混有钠元素,故用焰色反应检验钾元素时,一定要透过蓝色钴玻璃观察焰色。
否则,钠元素的黄色焰色会干扰钾元素紫色焰色的观察。
小专题归纳
1.金属冶炼的一般方法
K,Ca,Na,Mg,Al,|Zn,Fe,Sn.Pb.(H),Cu,|Hg,Ag,Pt,Au
可以大致分成三段
1、Al之前的金属很活泼,用电解盐或氧化物的方法冶炼
如,Na是电解熔融NaCl
Mg是电解熔融MgCl2
Al是电解熔融Al2O3
2、中间一段一般是热还原法,加热时,用合适的还原剂,如,H2、C、CO、或者较活泼的金属Al(铝热反应)进行冶炼
如,H2、C、CO加热还原CuO得到Cu,还原Fe2O3得到Fe等
Al高温铝热反应冶炼Fe、Cr、Mn等金属
3、后面的不活泼金属可以通过直接加热氧化物分解的方法得到金属单质
如,HgO加热分解成Hg和O2,就是拉瓦锡发现空气中存在O2的经典实验
一、电解法
金属活动顺序表中金属的冶炼如:
2Al2O3=冰晶石,电解=4Al+3O2↑
〔生成的O2与阳极炭棒反应生成CO、CO2,所以应不断补充阳极炭棒,冰晶石(Na3AlF6)为助熔剂。
〕
二、热还原法
(1)用C(焦炭、木炭)、CO作还原剂。
如:
3CO+Fe2O3=高温=2Fe+3CO2
(我国是世界上冶炼锌最早的国家,明朝宋应星在《天工开物》一书中有记载)
(2)铝热剂冶炼难熔的金属
2Al+Fe2O3==Al2O3+2Fe
三、加热法
不活泼金属的冶炼,可用加热其氧化物或锻烧其硫化物的方法。
2HgO=加热=2Hg+O2↑
唐代李白的秋浦歌:
炉火照天地,红星乱紫烟。
郝郎明月夜,歌曲动川寒。
秋浦:
在今安徽省池洲市西,当时产银、铜。
郝郎指冶炼工人。
四、物理提取
在自然界中存在,其密度很大,用多次淘洗法去掉矿粒、泥沙等杂质,便可得。
刘禹锡的浪淘沙:
日照澄洲江雾开,淘金女伴满江隈。
美人首饰侯王印,尽是沙中浪底来。
(隈:
水转弯的地方)
五、湿法冶金
即利用溶液中发生的化学反应(如置换、氧化还原、中和、水解等),对原料中的金属进行提取和分离的冶金过程。
如铜的冶炼:
Fe+CuSO4==FeSO4+Cu
2.过氧化钠强氧化性的应用
Na2O2的强氧化性
⑴Na2O2投入到FeCl2水溶液中
Fe2+被氧化成Fe3+,同时产生红褐色的Fe(OH)3沉淀
⑵Na2O2投入到含S2—的溶液中
S2—被氧化成S单质,溶液变浑浊
⑶Na2O2投入到含SO32—的溶液中
SO32—被氧化成SO42—
⑷Na2O2投入到品红溶液中,可使品红溶液褪色,
Na2O2投入到酚酞溶液中,溶液先变红而后褪色。
⑸Na2O2与SO2反应生成Na2SO4
3.有关碳酸钠与碳酸氢钠与酸反应的计算(数形结合的思想)
1.盐酸逐滴加入Na2CO3溶液
(1)现象:
开始无明显现象,后有无色气体放出。
(2)反应:
无明显现象时反应的离子方程式:
CO
+H+===HCO
,无色气体放出时反应的离子方程式:
HCO
+H+===CO2↑+H2O。
2.Na2CO3溶液逐滴加入稀盐酸中
有无色气体放出。
(2)反应的离子方程式:
+2H+===CO2↑+H2O。
典型例题
1)碳酸钠和碳酸氢钠的混合物14.8克,投入盐酸中完全反应,刚好消耗50克31.5%的盐酸溶液。
①写出反应的化学方程式
②计算混合物中碳酸钠的质量分数
③若将该混合物投入烧碱溶液中,消耗10%的烧碱溶液的质量为多少?
【答案】
1、
NaHCO3+HCl=NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
2、
设Na2CO3和NaHCO3的物质的量为x,y则有:
2x+y=0.315*50/36.5
106x+84y=14.8
然后解出结果
3、混合物中只有NaHCO3会与NaOH反应
再算出第二问的基础上,算出NaHCO3的物质的量y
2)等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应完全时,消耗的盐酸比为?
NA2CO3+2HCL=2NACL+H2O+CO2
10673
NAHCO3+HCL=NACL+H2O+CO2
8436.5
106X=36.5*106/84=56.06
质量相同的盐酸钠和碳酸氢钠消耗盐酸的质量比是73:
56.06
配套练习及答案
1某溶液中含有HCO3—、CO32—、SO32—、Na+、NO3—五种离子。
若向其中加入Na2O2,则充分反应后溶液中离子浓度保持不变的是(溶液体积变化忽略不计)(D)
A.CO32—、NO3—、Na+B.CO32—、NO3—
C.SO32—、NO3—D.NO3—
2.200℃时11.6gCO2和水蒸气的混合气体与足量Na2O2充分反应后,固体的质量增大了3.6g,则原混合气体的平均相对分子质量为23.2
3.物质的量相同的N2、O2、CO2混合后,通过Na2O2颗粒一段时间,测得体积变为原混合气体体积的8/9(同温同压下),此时N2、O2、CO2的物质的量之比为(C)
A.1︰1︰0B.6︰9︰0
C.3︰4︰1D.3︰3︰2
4.往甲、乙、丙、丁四个烧杯内分别放入0.1mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁溶液中溶质的质量分数大小顺序是( B )
A.甲<乙<丙<丁B.丁<甲<乙=丙
C.甲=丁<乙=丙D.丁<甲<乙<丙
5.将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式_____OH-+H+==H2O,H++CO32-==HCO3-_____
(2)当加入35mL盐酸时,产生CO2的体积为___224mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
42.4%
答案:
D23.2CBOH-+H+==H2O,H++CO32-==HCO3-22442.4%