舞阳一高高三化学难溶电解质的溶解平衡选择题一冯国宏Word文件下载.docx
《舞阳一高高三化学难溶电解质的溶解平衡选择题一冯国宏Word文件下载.docx》由会员分享,可在线阅读,更多相关《舞阳一高高三化学难溶电解质的溶解平衡选择题一冯国宏Word文件下载.docx(10页珍藏版)》请在冰豆网上搜索。
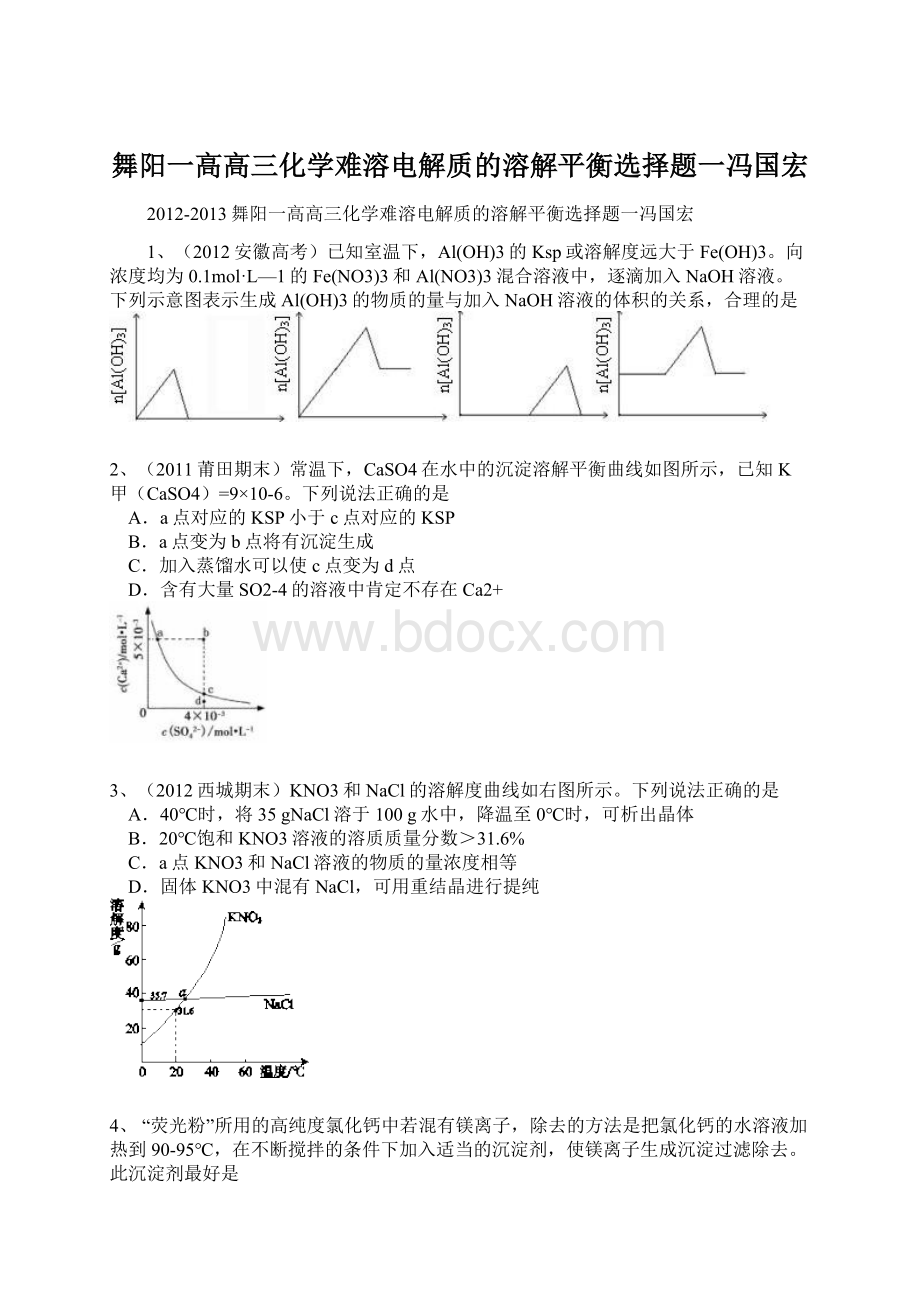
C.Cu(OH)2在c点比在d点代表的溶液中溶解程度小
D.该温度下,氢氧化铁的Ksp[Fe(OH)3]大于氢氧化铜Ksp
7、(2011青岛一模)已知25℃时,电离常数Ka(HF)=3.6×
10-4,溶度积常数Ksp(CaF2)=1.46×
10-10。
现向1L0.2mol·
L-1HF溶液中加入1L0.2mol·
L-1CaCl2溶液,则下列说法中,正确的是
A.25℃时,0.1mol·
L-1HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.加入CaCl2溶液后体系中的c(H+)浓度不变
D.该体系中有CaF2沉淀产生
8、(2011延庆)根据以下叙述制备氯化铜:
先将浓盐酸用蒸气加热至80℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解。
已知:
FeS不溶于水,但溶于酸;
溶液中被沉淀离子
Fe3+
Fe2+
Cu2+
完全生成氢氧化物沉淀时,溶液的pH
≥3.7
≥9.6
≥6.4
在除去溶液中的Fe2+时,可采用的方法是
A.可直接加碱,调整溶液的pH≥9.6
B.加入纯铜粉,将Fe2+还原为Fe
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3~4
D.通入H2S使Fe2+直接沉淀
9、(2011龙岩质检)某溶液中同时存在Mg2+、Fe2+、Mn2+和Al3+四种金属离子(浓度均为0.1mol/L)。
现用碱调节溶液pH,根据右表可知,下列说法错误的是
A.Al3+最先转化为Al(OH)3沉淀
B.加碱过程中,Fe2+、Mn2+几乎同时转化为沉淀
C.要使Mg2+转化为沉淀,溶液pH应大于9
D.pH=14时,四种金属离子全部以沉淀形式存在
10、(2011郑州三模)某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如右图所示,下列说法中不正确的是
A.b点对应的Kap等于c点对应的Kap
B.采取蒸发溶剂的方法可以使溶液从a点变到b点
C.该温度下,Ag2SO4的溶度积常数(Kap)为1.6×
10-5(mol·
L-1)2
D.0.02mol·
L-1的AgNO3溶液与的0.2mol·
L-1的Na2SO4溶液等体积混合不会生成沉淀
11、(2011浙江样卷)某同学为试验CuS在不同酸中的溶解性,取4份黑色CuS粉末试样置于试管中,分别加入醋酸、浓盐酸、浓硫酸、浓硝酸溶液。
观察到如下现象:
①CuS不溶于醋酸溶液;
②CuS不溶于浓盐酸;
③CuS不溶于浓硫酸;
④CuS在浓硝酸中溶解,溶液变蓝,并有红棕色刺激性气体产生。
根据上述现象,该同学得出了以下结论,其中正确的是
A.CuS不溶于弱酸,能溶于强酸
B.CuS不溶于非氧化性酸,能溶于氧化性酸
C.CuS溶于硝酸,是因为硝酸氧化性强于硫酸,S2-被氧化,使溶解沉淀平衡往溶解方向移动
D.CuS溶于硝酸,是因为硝酸的酸性大于硫酸和盐酸的酸性,S2-结合H+,放出H2S气体,使溶解沉淀平衡往溶解方向移动
12、(2011浙江样卷)某溶液中含有K+、Mg2+、Al3+、Cu2+等离子,为了将它们一一分离(不要求各离子恢复到原来的形态),某同学设计了如下四个实验方案,其中不正确的是[已知:
Mg2+、Al3+溶液中通入H2S不产生沉淀;
Ksp(CuS)=1.3×
10-36。
]
13、(2011济南调研)已知,常温下,KSP(AgCl)=1.8×
10-10mol2·
L-2,KSP(AgI)=8.3×
10-17mol2·
L-2,下列叙述中,正确的是
A.常温下,AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小
B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色
C.将0.001mol·
L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-)
14、(2011福州一检)实验室常用硫酸铜溶液吸收气体中的硫化氢:
CuSO4+H2S=CuS↓+H2SO4,该反应可以推测
A.CuS易水解
B.CuS可溶于盐酸
C.相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大
D.强酸可以制取弱酸
15、(2009泉州水平测试)在AgCl沉淀中加过量KI溶液,白色沉淀转化为黄色沉淀,有关结论不正确的是
A.加过量KI溶液充分反应后,Ksp(AgCl)减小
B.加过量KI溶液充分反应后,溶液中Ag+和I-的浓度之积等于Ksp(AgI)
C.加过量KI溶液充分反应后,溶液中Ag+和Cl-的浓度之积小于Ksp(AgCl)
D.Ksp(AgI)<Ksp(AgCl)
16、(2011海淀期中)100℃时,KCl溶液中溶质的质量分数为ω1。
降至室温后析出mgKCl晶体(晶体中不含结晶水),所得溶液中溶质的质量分数为ω2,则下列说法不正确的是
A.KCl的溶解度随温度的升高而升高
B.溶液中KCl的质量分数ω1一定大于ω2
C.降温前后,溶液中KCl的物质的量未发生改变
D.100℃的原溶液中,结晶和溶解的速率可能相等
17、(2010山东高考)某温度下,Fe(OH)3(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。
据图分析,下列判断错误的是
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
18、(2010海南高考)已知:
Ksp(AgCl)=1.8×
10—10,Ksp(AgI)=1.5×
10—16,Ksp(Ag2CrO4)=2.0×
10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A、AgCl>
AgI>
Ag2CrO4 B、AgCl>
Ag2CrO4>
AgI
C、Ag2CrO4>
AgCl>
AgI D、Ag2CrO4>
AgCl
19、(2010北京高考)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。
下列分析正确的是
A.CuS的溶解度大于PbS的溶解度
B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2-====CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
20、(2010山东实验中学)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如右下图,下列说法正确的是
A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最小
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
21、(2010杭州一测)将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅黄色沉淀。
对上述过程,下列理解或解释中正确的是
A.Ksp(AgCl)<Ksp(AgBr)
B.若在AgCl浊液中直接加入NaBr溶液,也会产生浅黄色沉淀
C.上述实验说明AgCl没有NaBr稳定
D.因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解
22、(2010福州质检)已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×
10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
A.所得溶液中的c(H+)=1.0×
10-13mol·
L-1
B.所得溶液中由水电离产生的c(OH-)=1.0×
10-13mol·
C.所加的烧碱溶液pH=13.0
D.所得溶液中的c(Mg2+)=5.6×
10-10mol·
23、(2010济南检测)下列说法正确的是
A.难溶电解质作比较时,Ksp小的,溶解度一定小
B.Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀平衡会发生移动
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去
D.温度一定,当溶液中Ag+和Cl—浓度的乘积等于Ksp时,溶液为AgCl的饱和溶液
24、(2010东城检测)已知Ca(OH)2的溶解度随温度升高而降低。
将40℃的饱和澄清石灰水冷却至l0℃,或保持40℃向其中加入少量CaO,两种情况下均保持不变的是
A.溶液中Ca2+的数目 B.溶剂的质量
C.溶液中溶质的物质的量浓度 D.溶质的质量
25、(2010广州调研)某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。
该温度下,下列说法正确的是
A.含有大量SO42-的溶液中肯定不存在Ag+
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀
C.Ag2SO4的溶度积常数(Ksp)为1×
10-3
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
26、(2009浙江高考)已知:
25℃时,K[Mg(OH)2]=5.61×
10-12,K[MgF2]=7.43×
10-11。
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20mL0.01mol·
L-1氨水中的K比在20mL0.01mol·
L-1NH4Cl溶液中的K小
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
27、(2009山东诊断)某温度时Ag2SO4在水中的沉淀溶解平衡曲线如下图所示。
该温度下,下列说法正确的是)
A.随着溶液中Ag+浓度的增大,Ag2SO4的溶度积常数(Ksp)保持不变,为2×
10一5mol3·
L—3
B.1mL1mol·
L—1的AgNO3溶液与1mLlmol·
L—1的Na2SO4溶液混合生成0.0005molAg2SO4沉淀
C.若Ksp(AgI)<
Ksp(Ag2SO4),则反应2KI+Ag2SO4=2AgI+K2SO4不能发生
28、(2009山东聊城一模)已知如下物质的溶度积常数:
FeS:
Ksp=6.3×
10-18mol2·
L-2;
CuS:
Ksp=1.3×
10-36mol2·
L-2。
A.同温度下,CuS的溶解度大于FeS的溶解度
B.同温度下,向饱和FeS溶液中呈入少量Na2S固体后,Ksp(FeS)变小
C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS
D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂
29、(2009宁波期末)强电解质Ag2CrO4(M=331.8g·
mol-1)的溶解度是0.0216g·
L-1,则其浓度积Ksp为
A.0.0216 B.
C.0.02162×
0.0216 D.
30、(2009青岛质检)下表是五种银盐的溶度积常数(25℃)
化学式
Ag2SO4
Ag2S
AgBr
AgI
溶度积
1.8×
10—10
1.4×
10—5
6.3×
10—50
7.7×
10—13
8.51×
10—16
下列说法错误的是
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度按氯、溴、碘的顺序减小
D.向100mL0.1mol·
L—1的Na2SO4溶液中加入1mL0.1mol·
L—1的AgNO3溶液,有白色沉淀生成
31、(2008青岛质检)已知25℃时,Agl饱和溶液中c(Ag+)为1.22×
10-8mol·
L-1,AgCl的饱和溶液中c(Ag+)为1.30×
10-5mol·
L-1。
若在5mL含有KCl和KI浓度均为0.01mol·
L-1的混合溶液中,滴加8mL0.01mol·
L-1的AgNO3溶液,则下列叙述中不正确的是
A.溶液中所含溶质的离子浓度大小关系为:
c(K+)>
c(NO—3)>
c(Ag+)>
c(Cl-)>
c(I-)
B.溶液中先产生的是AgI沉淀
C.AgCl的KSP的数值为1.69×
10-10
D.若在AgI县浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀
32、(2008烟台诊断)已知:
为使Fe3+、Fe2+、Zn2+较完全的形成氢氧化物沉淀,溶液的pH应分别为3.7、9.6、4.4左右。
某硫酸锌酸性溶液中含有少量Fe3+、Fe2+,为除去这些离子制得纯净的硫酸锌,应加入的试剂是
A.NaOH溶液 B.氨水 C.KMnO4、ZnCO3 D.H2O2、ZnO
33、(2008潍坊质检)已知锌及其化合物的性质与铝及其化合物相似。
如图,横坐标为溶液的pH,纵坐标为Zn2+离子或[Zn(OH)4]2-离子的物质的量浓度
(假设Zn2+离子浓度为10-5mol·
L—1时,Zn2+离子已沉淀完全)。
下列说法不正确的是
A.往ZnC12溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:
Zn2++4OH-=[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17mol3·
L-3
C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8—12
D.向1L1mol·
L—1ZnC12溶液中加入NaOH固体至pH=7,需NaOH2mol
34、(2008广东高考)
已知Ag2SO4的KW为2.0×
10-3,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该过程中Ag+和SO32-,浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·
L-1)。
若t1时刻在上述体系中加入100 mL. 0.020 mol·
L-1Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO32-浓度随时间变化关系的是
35、(2007海淀二考)甲、乙两物挝的溶解度曲线如图所示。
下列叙述中,正确的是
A.t1℃时,在100g水中放入60g甲,其溶质的质量分数为37.5%
B.t1℃时,甲和乙的饱和溶液的物质的量浓度一定相等
C.t2℃时,甲和乙的饱和溶液中溶质的质量数一定相等
D.t2℃时,分别在100g水中各溶解20g甲、乙,同时降低温度,甲先达到饱和
36、(2007全国一联)已知t℃时,盐M(不含结晶水,摩尔质量为126g·
mol-1)的溶解度为Sg。
在一定量的M的水溶液中加入agM后,恰好为t℃时的饱和溶液,饱和溶液的密度是ρg·
ML-1,物质的量浓度是cmol·
L-1,质量分数为ω。
若用M·
7H2O代替M,欲使原溶液在t℃时恰好饱和,则需加入bgM·
7H2O,下列等式不正确的是
A.
B.
C.
D.b=2a
37、(2006南京质检)在一定温度下,向15g蒸馏水中加入一包无水硫酸铜粉末,充分搅拌后过滤,得到一定质量的蓝色晶体和8.4g滤液。
若此温度下无水硫酸铜的溶解度为40g,则此包无水硫酸铜的质量是
A.6.6g B.9g C.18.4g D.16g
38、t℃时,甲、乙两个烧杯中各盛有100g(密度为1.10g·
cm-3)相同浓度的KCl溶液。
现将甲烧杯中的溶液蒸发掉35.0gH2O,恢复到t℃时,析出KCl固体5.0g;
乙烧杯中的溶液蒸发掉45.0gH2O,恢复到t℃时,析出KCl固体10.0g。
A.原溶液的质量分数为20%
B.t℃时,KCl的溶液度为50.0g
C.原溶液的物质的量浓度为3.0mol·
L-1
D.乙烧杯中剩余KCl溶液的质量分数大于甲烧杯中剩余KCl溶液的质量分数
39、(2006全国联考四)已知在一绝热容器中,饱和石灰水中存在溶解平衡:
Ca(OH)2(s)
Ca2++20H-,现向其中加入少量生石灰,则下列说法中不正确的是
A.溶液中固体的质量增加 B.溶液中Ca2+的浓度减小
C.溶液中OH-的数目减少 D.溶液的pH不变
40、在50g含有1.70g硝酸银和1.85g硝酸钯[Pd(NO3)2]的溶液中加入足量的NaI溶液,充分反应后,静置、过滤、洗涤、干燥,称量得到5.245g固体,由此得出的正确结论是
A.银离子只有一部分参加反应 B.钯离子(Pd2+)只有一部分沉淀
C.碘化钯(PdI2)难溶于水 D.碘化钠和硝酸钯在溶液中无沉淀生成
答案:
1、B2、B3、D4、D5、D6、A7、D8、C9、D10、B11、C12、B
13、B14、C15、A16、C17、B18、C19、D20、C21、B22、C23、D
24、C25、B26、B27、A28、D29、D30、D31、A32、D33、D
34、B解释:
Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.034mol/L,所以c(SO42-)=0.017mol/L;
当加入100ml0.020mol/LNa2SO4溶液后,c(SO42-)=0.0185mol/L,c(Ag+)=0.017mol/L(此时Q<
KSP)。
由计算可知选B。
35、D36、D37、C38、B39、D40、C