高考化学化学能与电能大题培优 易错 难题及详细答案Word格式文档下载.docx
《高考化学化学能与电能大题培优 易错 难题及详细答案Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《高考化学化学能与电能大题培优 易错 难题及详细答案Word格式文档下载.docx(14页珍藏版)》请在冰豆网上搜索。
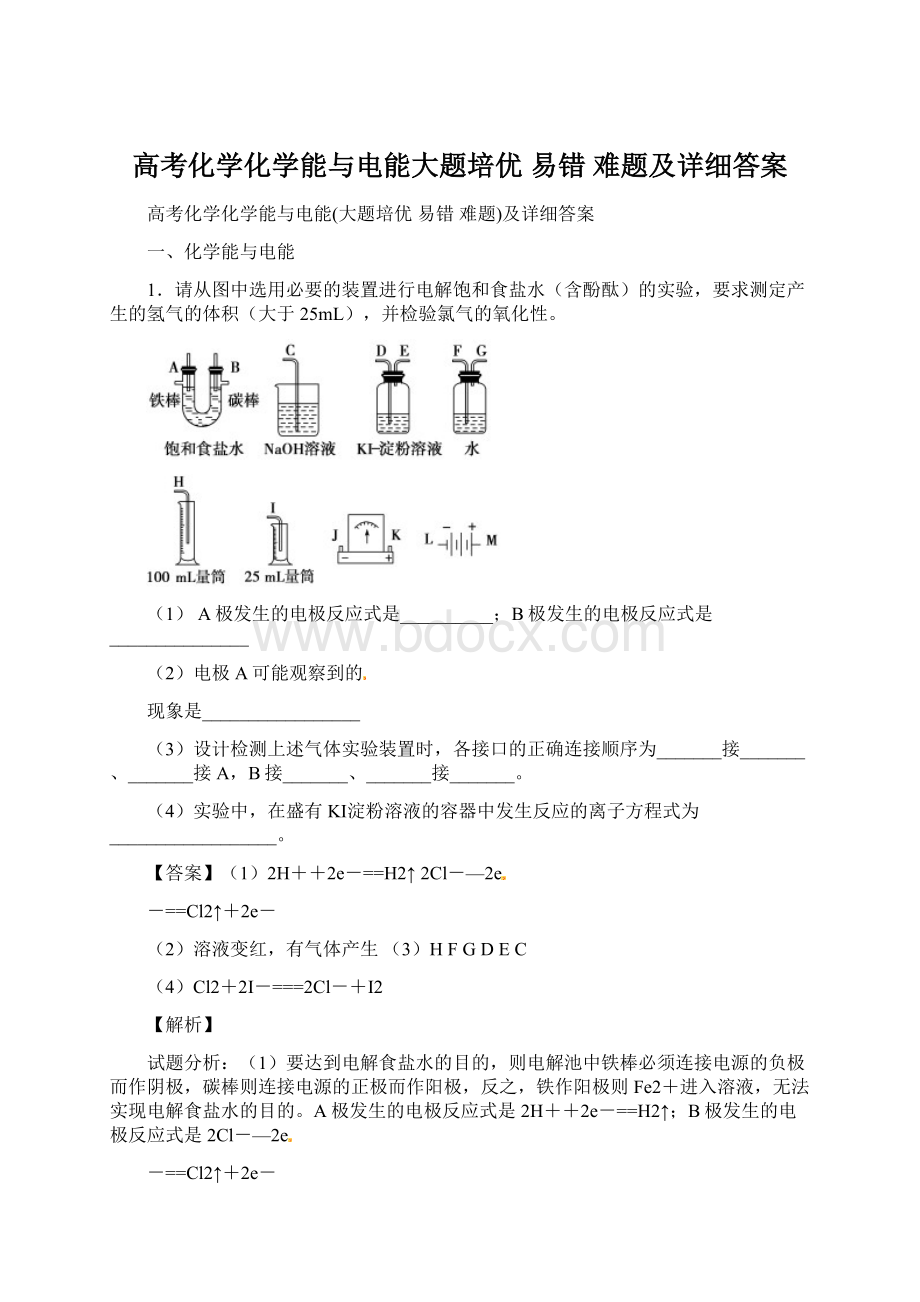
稀盐酸
偏向Al
2
AlCu
偏向Cu
3
Al石墨
偏向石墨
4
NaOH溶液
偏向Mg
5
AlZn
浓硝酸
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极是否相同?
.
(2)实验1、4中Al所作的电极是否相同?
(3)写出实验3中的电极反应式.正极:
;
(4)用电子式表示氯化镁的形成过程:
(1)不同;
(2)不同;
(3)2H++2e-=H2↑;
(4)
。
(1)实验1:
Mg比Al活泼,两者都和盐酸反应,因此Mg作负极,Al作正极,实验2:
Al比Cu活泼,Al作负极,Cu作正极,故Al所作的两极不相同;
(2)实验4中,虽然Mg比Al活泼,但Mg不与氢氧化钠反应,而Al可以,因此Al作负极,Mg作正极,因此Al所作的两极不相同;
(3)实验3中,正极反应式为2H++2e-=H2↑;
(4)MgCl2是离子化合物,用电子式表示氯化镁形成过程:
。
考查原电池中正负极的判断、电子式表示化合物形成过程等知识。
3.1、右图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。
请回答下列问题:
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的电极反应式为:
(2)当电极a为Fe、电极b为Cu、电解质溶液为浓硝酸时,该装置(填“能”或“不能”)形成原电池,若不能,请说明理由,_________;
若能,请指出负极是该电极反应式是_________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。
现设计一燃料电池,以电极a为正极,电极b为负极,CH4为燃料,采用酸性溶液为电解液;
则CH4应通入极(填a或b,下同),电子从极流出。
电池的负极反应方程式为:
_________________________
2、已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
(反应速率最小的时间段(即0~1、l~2、2~3、3~4、4~5min)为原因是。
另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水B.CuCl2溶液C.NaCl溶液
你认为他上述做法中可行的是(填相应字母);
做法中不可行的是____________,理由是:
_______________________________________________________。
4.某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下。
电流表指针偏转方向
Al、Mg
Al、Cu
Al、C(石墨)
氢氧化钠溶液
Al、Zn
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“是”或“否”)?
____________。
(2)对实验3完成下列填空:
①铝为________极,电极反应式:
__________________________________________;
②石墨为________极,电极反应式:
_________________________________________;
③电池总反应式:
______________________________________________________。
(3)实验4中铝作负极还是正极________,理由是_________________________________。
(4)解释实验5中电流表指针偏向铝的原因:
____________________________________。
写出铝电极的电极反应式:
_________________________________________________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:
__________________。
(1)否;
(2)①负,2Al-6e-=2Al3+;
②正,6H++6e-=3H2↑;
③2Al+6HCl=2AlCl3+3H2↑;
(3)负极,在NaOH溶液中,活动性Al>Mg;
(4)Al在浓硝酸中发生钝化,Zn在浓硝酸中发生反应,被氧化,即在浓硝酸中活动性Zn>Al,Al是原电池的正极.,NO3-+e-+2H+=NO2↑+H2O;
(5)①另一个电极材料的活动性;
②电解质溶液。
(1)原电池中一般活泼金属作负极,能和电解质溶液反应,电流表指针指向正极,实验1,电流表指针偏向Al,说明Mg作负极,铝作正极,实验2,Al比铜活泼,且铜不与稀盐酸反应,则Al作负极,故填写“否”;
(2)实验3,电流表指针偏向石墨,说明铝作负极,石墨作正极,铝和盐酸的反应:
2Al+6H+=2Al3++3H2↑,负极上的反应式为:
2Al-6e-=2Al3+,正极反应式为:
6H++6e-=3H2↑;
(3)虽然Mg比铝活泼,但Mg不与NaOH反应,但铝和氢氧化钠溶液反应,因此铝作负极,其反应离子方程式为:
2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)虽然铝比锌活泼,但铝和浓硫酸、浓硝酸发生钝化反应,产生一层致密氧化薄膜阻碍反应的进行,锌和硝酸反应的离子方程式为:
Zn+4H++2NO3-=Zn2++2NO2↑+2H2O,负极反应式为Zn-2e-=Zn2+,正极反应式为:
NO3-+2H++e-=NO2↑+H2O;
(5)根据以上分析,影响因素是:
①另一个电极材料的活动性;
考查原电池正负极的判断、电极反应式的书写等知识。
5.
(一)下图是实验室用氢气还原氧化铜实验的简易装置。
其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中。
(1)铜质燃烧匙的作用有,。
(2)实验过程中,在试管M中可观察到的现象是,。
(二)原电池与电解池在化学工业中有广泛应用。
如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题:
(1)若断开k1,闭合k2,则装置为_____;
X电极上的电极反应式为_____________;
电解质溶液中的阳离子向______极移动(填X或Y);
(2)若线路中通过3.01×
1022的电子,则Y极上析出物质的质量为。
(一)
(1)控制反应的发生和停止与锌构成原电池加快反应速率
(2)铜匙和锌粒表面都有气泡产生锌粒逐渐变小或消失
(二)
(1)原电池Fe-2e-=Fe2+Y
(2)1.6g
(一)
(1)铜质燃烧匙可以上下移动,因此作用之一是的作用有控制反应的发生和停止;
其次铜与锌构成原电池加快反应速率。
(2)锌能与盐酸反应生成氢气,其次铜锌构成原电池,铜是正极,其在表明氢离子放电,所以实验过程中,在试管M中可观察到的现象是铜匙和锌粒表面都有气泡产生、锌粒逐渐变小或消失。
(二)
(1)若断开k1,闭合k2,则装置为原电池,铁是活泼的金属,铁是负极,则X电极上的电极反应式为Fe-2e-=Fe2+;
电解质溶液中的阳离子向正极移动,即向Y极移动;
1022的电子,即0.05mol电子,Y极是铜离子得到电子,电极反应式为Cu2++2e—=Cu,所以Y极上析出物质的质量为
【考点定位】本题主要是考查原电池原理的应用
【名师点晴】掌握原电池的工作原理是解答的关键,原电池是把化学能转化为电能的装置,原电池中较活泼的金属是负极,失去电子,发生氧化反应。
电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,解答时注意灵活应用。
6.
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的(填试剂化学式),过滤后即可得到。
(2)实验室制取氯酸钠可通过如下反应:
3C12+6NaOH
5NaC1+NaC1O3+3H2O先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图表1所示,图中C表示的离子是。
(填离子符号)
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。
则阳极反应式为:
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:
准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:
从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL1.000mol/L(NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:
再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/LK2Cr2O7标准溶液滴定至终点,记录消耗消耗K2Cr2O7标准溶液的体积。
步骤4:
为精确测定样品中C1O3-的质量分数,重复上述步骤2、3操作2-3次。
步骤5:
数据处理与计算。
①步骤2中反应的离子方程式为;
静置10min的目的是。
②步骤3中K2Cr2O7标准溶液应盛放在(填仪器名称)中。
③用0.0200mol/LK2Cr2O7标准溶液滴定的目的是。
在上述操作无误的情况下,所测定的结果偏高,其可能的原因是。
(1)Na2CO3
(2)ClO-(3)Cl--6e-+6OH-=C1O3-+3H2O(4)①ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
使溶液中C1O3-与Fe2+反应充分完全②酸式滴定管③计算步骤
消耗的(NH4)2Fe(SO4)2的量(其他合理答案也给分)
溶液中的Fe2+被空气中的氧气氧化
(1)石灰乳与氯气反应生成氯化钙和氯酸钙,除去氯化钙后,可加入碳酸钠溶液,以生成碳酸钙沉淀,以此得到氯化钠;
(2)氯气与氢氧化钠反应低温时生成NaClO,温度高时生成NaClO3,-5℃时生成ClO-;
(3)采用无隔膜电解饱和食盐水法生产氯酸钠,同时生成H2,其反应的方程式为:
NaCl+3H2O
NaClO3+3H2↑,阳极发生氧化反应,反应式为Cl--6e-+6OH-=C1O3-+3H2O;
(4)①酸性条件下亚铁离子被ClO3-氧化未铁离子,自身被还原为氯离子,其反应的离子方程式为:
ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
静止10min可以使亚铁离子和次氯酸根离子充分反应;
②K2Cr2O7溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管,所以改用酸式滴定管盛放;
③步骤2中的(NH4)2Fe(SO4)2没有反应完,用K2Cr2O7溶液滴定步骤2的溶液是为了测得未反应完全的亚铁离子,所以是为了测为反应完全的硫酸亚铁铵的量;
亚铁离子容易被空气中的氧气氧化,测得结果偏高的原因为溶液中的Fe2+被空气中的氧气氧化。
探究物质的组成及测定物质的含量
7.氰化钠(NaCN)是一种重要化工原料,用于化学合成、电镀、冶金等方面。
NaCN有剧毒,含氰废水需经无害化处理才能排放,某电镀厂含氰废水的一种工业处理流程如下:
已知:
HCNO的结构式是:
H-O-C≡N
HCN的Ka=6.02×
10-10
[Ag(CN)2]-(aq)
Ag+(aq)+2CN-(aq)K=1.3×
10-21
回答下列问题:
(1)CN-中两原子均为8电子稳定结构,请写出CN-的电子式_______________。
(2)氰化钠遇水会产生剧毒氢氰酸,请写出相应的离子方程式_______________。
(3)向发生塔中通水蒸汽的目的是____________。
(4)氧化池中氰化物的降解分两步进行
CN-被氯气氧化成低毒的CNO-,写出相应的离子方程式____________________,
CNO-被氯气氧化成无毒的两种气体,写出相应的离子方程式________________。
(5)贮水池中废水须先经碱化后再进行氧化的原因_______________________。
(6)电镀厂电镀银时需要降低镀层金属的沉积速度,使镀层更加致密。
电解液使用Na[Ag(CN)2],请写出阴极反应式,解释工业电镀中使用氰离子(CN-)的原因。
(每空2分,共16分)
(1)
(2)CN-+H2O
HCN+OH-
(3)促使HCN挥发进入吸收塔
(4)CN-+Cl2+2OH-=CNO-+2Cl-+H2O
2CNO-+3Cl2+4OH-=N2↑+CO2↑+6Cl-+2H2O
(5)防止生成HCN其他合理答案均得分
(6)[Ag(CN)2]-+e-="
Ag"
+2CN-;
Ag+和CN-可以结合成稳定的络合物,可以控制银离子浓度,使镀层致密。
(1)CN-中各原子均满足8电子稳定结构,存在C≡N键,电子式为
,故答案为
;
(2)氰化钠易发生水解产生氰化氢,方程式为CN-+H2O⇌HCN+OH-,故答案为CN-+H2O⇌HCN+OH-;
(3)向发生塔中通水蒸汽的目的是促使HCN挥发进入吸收塔,故答案为促使HCN挥发进入吸收塔;
(4)CN-被氯气氧化成低毒的CNO-,同时得到还原产物氯离子,即CN-+Cl2+2OH-=CNO-+2Cl-+H2O;
CNO-被氯气氧化成无毒的两种气体是氮气和二氧化碳,即2CNO-+3Cl2+4OH-=N2↑+CO2↑+6Cl-+2H2O;
(5)贮水池中废水须先经碱化后再进行氧化,这样可以防止生成HCN,故答案为防止生成HCN;
(6)电解池中,电解液使用Na[Ag(CN)2],在阴极上发生得电子的还原反应,即:
[Ag(CN)2]-+e-=Ag+2CN-,工业电镀中使用氰离子,这样Ag+和CN-可以结合成稳定的络合物,可以控制银离子浓度,使镀层致密,故答案为[Ag(CN)2]-+e-=Ag+2CN-;
【考点定位】考查电解原理;
离子方程式的书写;
氧化还原反应
【名师点晴】本题是一道注重了化学与实际生产的联系的综合知识题,考查利用氧化还原反应来实现废水的转化,涉及氧化还原反应等,明确该反应中的生成物是解本题关键,还可以结合原子守恒、转移电子守恒来分析解答。
本题中(4)CN-被氯气氧化成低毒的CNO-,同时得到还原产物氯离子;
CNO-被氯气氧化成无毒的两种气体是氮气和二氧化碳,据此书写方程式;
(6)电解池的阴极上发生得电子的还原反应;
根据Ag+和CN-可以结合成稳定的络合物。
8.(11分)某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量。
(1)若实验中测定在标准状况下放出的氧气的体积VL,B连接直流电源的_________(填“正极”或“负极”);
(2)电解开始一段时间后,在U形管中可观察到的现象有__________________,电解的离子方程式为___________________________________。
(3)实验中还需测定的数据是_______________(填写序号)
①B极的质量增重mg
②A极的质量增重mg
(4)下列实验操作中必要的是________(填字母)
A.称量电解前电极的质量
B.电解后,取出电极直接烘干称重
C.刮下电解过程中电极上析出的铜,并清洗、称重
D.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为:
___________(用含有m、V的计算式表示)
(6)如果用碱性(KOH为电解质)甲醇燃料电池作为电源进行实验,放电时负极电极反应式为___________。
(11分,除标注外每空2分)
(1)正极;
(2)铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅;
2Cu2++2H2O
2Cu+O2↑+4H+;
(3)②;
(4)AD;
(5)
(6)CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O
(1)铜作电极是活性电极,在溶液中OH-放电生成氧气,说明铜作阴极,与电源的负极相连,所以B连接直流电源的正极。
(2)惰性电极电解硫酸铜溶液,阴极:
2Cu2++4e-=2Cu,阳极:
4OH--4e-=2H2O+O2↑,所以电解开始一段时间后,在U形管中可观察到的现象有铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅;
阴极阳极电极反应相加即得电解的总反应,电解的离子方程式为2Cu2++2H2O
(3)该实验测定铜的相对原子质量,需要知道铜的质量,铜在A极析出,所以选②
(4)该实验需测定析出铜的质量,阴极析出铜,而阴极用铜作电极,只需要测定反应前后阴极的质量差,在有空气存在的条件下,2Cu+O2
2CuO,所以在有空气存在的情况下,烘干电极必须采用低温烘干的方法,选AD。
(5)根据2Cu2++2H2O
2Cu+O2↑+4H+
2M22.4
mV列方程解得M=
(6)用KOH溶液作电解液的甲醇燃料电池,甲醇在负极是电子生成CO2,CO2与KOH溶液反应生成碳酸钾,所以负极电极反应为CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O。
考查电解的工作原理。
9.(15分)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。
某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,研究废液再生机理。
记录如下(a、b、c代表电压值:
)
序号
电压/V
阳极现象
检验阳极产物
I
x≥a
电极附近出现黄色,有气泡产生
有Fe3+、有Cl2
II
a>x≥b
电极附近出现黄色,无气泡产生
有Fe3+、无Cl2
III
b>x>0
无明显变化
无Fe3+、无Cl2
(1)用KSCN溶液检验出Fe3+的现象是_______。
(2)I中,Fe2+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。
写出有关反应的方程式_____。
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_____性。
(4)II中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证。
电解pH=1的NaCl溶液做对照实验,记录如下:
IV
a>x≥c
有Cl2
V
c>x≥b
无Cl2
①NaCl溶液的浓度是________mol/L。
②IV中检测Cl2的实验方法:
____________________。
③与II对比,得出的结论(写出两点):
___________________。
(1)溶液变为血红色
(2)2Cl--2e-=Cl2↑;
2Fe2++Cl2=2Fe3++2Cl-;
(3)还原
(4)①0.2②取少量阳极附近的溶液,滴在淀粉KI试纸上,试纸变蓝
③通过控制电压,证实了产生Fe3+的两种原因都成立;
通过控制电压,验证了Fe2+先于Cl-放电
(1)铁离子与KSCN反应生成血红色络合物,故现象为溶液变为血红色;
(2)Cl-在阳极放电,电解反应式为2Cl--2e-=Cl2↑,生成的氯气氧化Fe2+为Fe3+,方程式为:
(3)因为阳极产物无Cl2,又Fe2+具有还原性,故也可能是Fe2+在阳极放电,被氧化为Fe3+;
(4)①因为为对比实验,故Cl-浓度应与电解FeCl2的相同,即为0.1mol/L×
2=0.2mol/L;
②检测氯气可以用淀粉碘化钾试纸,可取少量阳极附近的溶液,滴在淀粉KI试纸上,若试纸变蓝色,则说明有氯气存在;
③与II对比可知,IV中电解氯化亚铁时,电压较大a>x≥c时,氯离子放电产生氯气,即说明Fe3+可能是由氯气氧化亚铁离子得到;
电压较小c>x≥b时,氯离子不放电,即还原性Fe2+>Cl-,同时也说明了铁离子也可能是由亚铁离子直接放电得到的。
故结论为:
①通过控制电压,证实了产生Fe3+的两种原因都成立;
②通过控制电压,验证了Fe2+先于Cl-放电。
本题考查铁离子的检验、电解原理、氯气的检验等知识。
10.Cu(NO3)2是重要的化工原料。
回答下列工业生产和化学实验中的几个问题。
实验室欲制备0.3molCu(NO3)2晶体,甲、乙两同学分别设计实验方案如下:
①绿色化学的角度分析,_________同学的方案更合理,此同学可节约2mol/L的稀硝酸_________mL;
②甲方案的离子方程式为___________;
③乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择__________方案(填字母序号)。
④B装置如何检查气密性:
_________________。
(2)某校化学兴趣小组的同学对硝酸铜的受热分解进行探究。
他们设计了如下左图装置加热Cu(NO3)2固体(加热及夹持装置未画出)。
加热过程发现