(2017)新浙教版九年级上册科学第一章《物质及其变化》知识点归纳.docx
《(2017)新浙教版九年级上册科学第一章《物质及其变化》知识点归纳.docx》由会员分享,可在线阅读,更多相关《(2017)新浙教版九年级上册科学第一章《物质及其变化》知识点归纳.docx(8页珍藏版)》请在冰豆网上搜索。
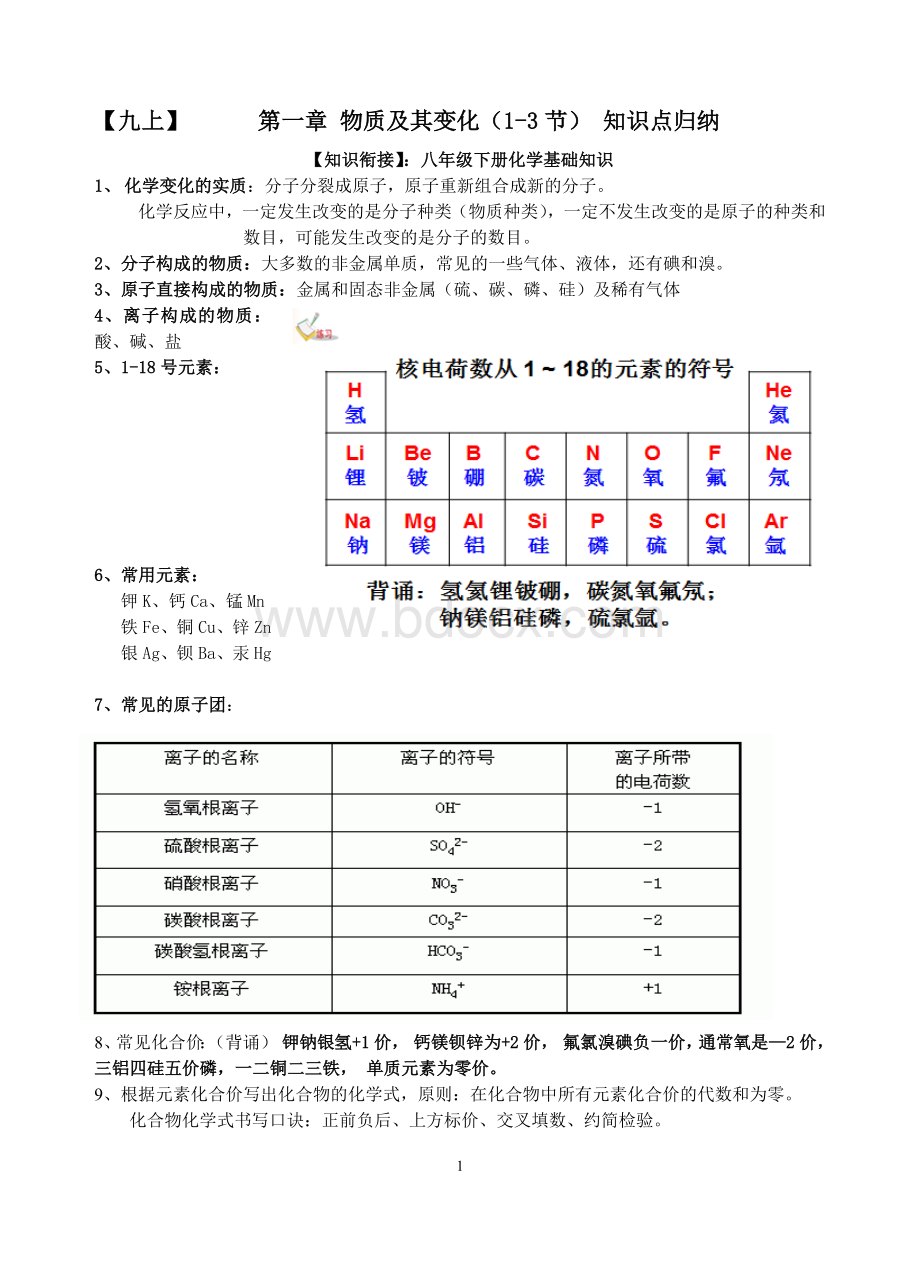
【九上】第一章物质及其变化(1-3节)知识点归纳
【知识衔接】:
八年级下册化学基础知识
1、化学变化的实质:
分子分裂成原子,原子重新组合成新的分子。
化学反应中,一定发生改变的是分子种类(物质种类),一定不发生改变的是原子的种类和数目,可能发生改变的是分子的数目。
2、分子构成的物质:
大多数的非金属单质,常见的一些气体、液体,还有碘和溴。
3、原子直接构成的物质:
金属和固态非金属(硫、碳、磷、硅)及稀有气体
4、离子构成的物质:
酸、碱、盐
5、1-18号元素:
6、常用元素:
钾K、钙Ca、锰Mn
铁Fe、铜Cu、锌Zn
银Ag、钡Ba、汞Hg
7、常见的原子团:
8、常见化合价:
(背诵) 钾钠银氢+1价, 钙镁钡锌为+2价, 氟氯溴碘负一价,通常氧是—2价,三铝四硅五价磷,一二铜二三铁,单质元素为零价。
9、根据元素化合价写出化合物的化学式,原则:
在化合物中所有元素化合价的代数和为零。
化合物化学式书写口诀:
正前负后、上方标价、交叉填数、约简检验。
10.化学方程式的书写方法:
书写化学方程式可以归结为五步:
①写:
反应物的化学式写在“=”的左边,生成物的化学式写在“=”的右边,多种反应物或生成物之间用“+”相连。
②配:
在反应物、生成物的化学式前配上适当的化学计量数,使式子两边每一种元素的原子总数相等。
通常用最小公倍数法配平。
③注:
注明反应条件,通常写在“=”的上方或下方。
“加热”常用“△”表示。
④标:
如果反应物中没有气体,而生成物中有气体产生,那么在气体的化学式右边用“↑”号表示;如果是溶液中发生的反应,反应物中无固体,而生成物中有固体的,那么在固体的化学式右边用“↓”号表示。
⑤查:
检查化学式是否正确,化学方程式是否配平,条件和物质状态是否标注,标注是否恰当。
11.根据化学方程式计算的基本步骤
(1)设未知量x(此时x不带单位,如“设某物质的质量为x克”是错误的);
(2)正确书写有关的化学方程式(别忘了配平);
(3)计算出有关物质的相对分子质量(要乘上配平的系数),写在相应化学式的正下方(包括x);
(4)在有关物质的相对分子质量下面写出已知质量(纯净物质量)和未知量x;
(5)将有关的四个量列成比例式,求出未知量x(此时x要带单位,如x=1克);
(6)简明地写出答案。
第一节:
物质的变化
1、物理变化与化学变化的根本区别:
变化中是否有新的物质生成。
物理变化的实质:
分子本身没变化,分子间的距离发生改变。
化学变化的实质:
构成物质的分子的原子重新组合,构成了新的分子。
2、物理变化与化学变化的联系:
化学变化中一定伴随物理变化,物理变化中不一定有化学变化。
3、常见的化学性质:
可燃性、酸碱性、氧化性、还原性、稳定性、毒性
4、常见的物理性质:
颜色、状态、气味、味道、熔点、沸点、凝固点、密度、硬度、溶解性、挥发性、导电性、导热性等。
5、探究物质变化的基本方法:
观察和实验
6、物质变化的证据:
颜色、沉淀、气体、温度、发光、发热、PH、状态、形状
7、物质变化规律的应用:
①推测物质的性质和用途②寻找发现未知物质③建立物质变化模型。
8、变化和性质的区别:
变化是正在发生的。
(变化特殊字眼:
正在、了、已经、出现等)
性质是本身具有的,不一定在发生。
(性质特殊字眼:
能、会、可以、易、难、具有等)
第二节:
物质的酸碱性
1、酸:
电离时生成的阳离子全部是H+的化合物(酸=H++酸根阴离子)
常见的酸:
盐酸HCl、硫酸H2SO4、硝酸HNO3、碳酸H2CO3、醋酸(CH3COOH)、柠檬酸
2、碱:
电离时生成的阴离子全部是OH-的化合物(碱=金属阳离子(或NH4+)+OH-)
常见的碱:
氢氧化钠NaOH、氢氧化钙Ca(OH)2、氢氧化钡Ba(OH)2、氢氧化钾KOH
3、盐:
金属阳离子(或NH4+)与酸根阴离子结合的化合物(盐=金属阳离子(或NH4+)+酸根阴离子)
4、酸碱指示剂(测酸碱性):
紫色石蕊试液和无色酚酞试液、蓝色石蕊试纸、红色石蕊试纸
①紫色石蕊试液遇酸变红色、遇碱变蓝色②无色酚酞试液遇酸不变色、遇碱变红色
5、酸碱度(PH值表示):
酸性:
PH<7,PH越小酸性越强(酸性溶液稀释后酸性变弱,PH值变大)
中性:
PH=7
碱性:
PH>7,PH越大碱性越强(碱性溶液稀释后碱性变弱,PH值变小)
6、酸碱度(PH值)的测定:
PH试纸(广泛试纸)、PH计。
7、PH试纸使用:
用洁净的玻璃棒蘸取待测溶液滴在PH试纸上,约30秒后,将试纸显示的颜色与标准比色卡对照,确定溶液的PH值。
第三节:
常见的酸
1、酸的通性(H+)
(1)酸能与指示剂反应:
能使紫色石蕊试液变红,不能使无色酚酞试液变色。
(2)酸+(活泼)金属==盐+H2(现象:
冒气泡)
2HCl+Fe==FeCl2+H2H2SO4+Fe==FeSO4+H2
2HCl+Zn==ZnCl2+H2H2SO4+Zn==ZnSO4+H2(实验室制H2原理)
6HCl+2Al==2AlCl3+3H23H2SO4+2Al==Al2(SO4)3+3H2
(3)酸+金属氧化==盐+水(用途:
工业上除铁锈(Fe2O3))
6HCl+Fe2O3==2FeCl3+3H2O3H2SO4+Fe2O3==Fe2(SO4)3+3H2O
(现象:
铁锈逐渐消失,溶液变为黄色)
2HCl+CuO==CuCl2+H2OH2SO4+CuO==CuSO4+H2O
(现象:
黑色的氧化铜消失,溶液变成蓝色)
(4)酸+碱==盐+水
HCl+NaOH==NaCl+H2OH2SO4+2NaOH==Na2SO4+2H2O
2HCl+Ca(OH)2==CaCl2+2H2OH2SO4+Ca(OH)2==CaSO4+2H2O
(农业上用来改良酸性土壤)
2HCl+Cu(OH)2==CuCl2+2H2OH2SO4+Cu(OH)2==CuSO4+2H2O
(现象:
蓝色氢氧化铜固体逐渐消失,溶液变成蓝色)
3HCl+Fe(OH)3==FeCl3+3H2O3H2SO4+2Fe(OH)3==Fe2(SO4)3+6H2O
(现象:
红褐色氢氧化铁固体逐渐消失,溶液变成黄色)
3HCl+Al(OH)3==AlCl3+3H2OH2SO4+Ba(OH)2==BaSO4+2H2O
(治疗胃酸过多)(现象:
出现白色沉淀)
(5)酸+盐==新酸+新盐
HCl+AgNO3==AgCl+HNO3(Cl-检验:
Cl-+Ag+==AgCl)
H2SO4+Ba(NO3)2==BaSO4+2HNO3(SO42-检验:
SO42-+Ba2+==BaSO4)
2HCl+CaCO3==CaCl2+CO2+H2O(实验室制二氧化碳原理)
2HCl+Na2CO3==2NaCl+CO2+H2OH2SO4+Na2CO3==Na2SO4+CO2+H2O
2、盐酸HCl
①无色有刺激性气味的液体(工业盐酸因含杂质Fe3+,呈黄色)
②浓盐酸具有挥发性,挥发出氯化氢气体,打开瓶塞,瓶口出现白雾(白雾为浓盐酸挥发出来的氯化氢气体与水蒸气结合形成的盐酸小液滴)
③浓盐酸敞口放置:
溶液质量减少,溶质质量分数减小。
④用途:
重要化工产品、金属除锈、制造药物、胃酸帮助消化
3、浓硫酸H2SO4
①无色无味、粘稠、油状液体。
②浓硫酸具有很强的腐蚀性
皮肤碰到浓硫酸处理方法:
干布拭去,大量清水冲洗,小苏打溶液冲洗,严重的送医。
③浓硫酸具有脱水性(化学性质)——炭化变黑
④浓硫酸具有吸水性(物理性质)——用做气体干燥剂(不可干燥碱性气体如NH3)
⑤浓硫酸溶于水会放出大量的热
⑥浓硫酸稀释:
将浓硫酸沿杯壁缓慢倒入水中,并不断搅拌。
注意:
切不可将水倒入浓硫酸,否则会因为滴水部位形成局部高温使水沸腾,致使酸液飞溅,造成事故。
⑦浓硫酸敞口放置:
溶液质量增加,溶质质量分数减小。
⑧用途:
重要化工原料、生产化肥、农药、火药、染料、冶炼金属、精练石油、金属除锈,实验室中做气体干燥剂。
4、硝酸:
HNO3
①无色、易挥发、有刺激性气味的液体。
②强氧化性、腐蚀性。
③见光易分解,密封保存在棕色瓶中。
5、几种重要离子(原子团)检验:
(1)Cl-检验:
原理:
Cl-+Ag+==AgCl
具体步骤:
①待测溶液中滴加AgNO3溶液,如无白色沉淀生成,则无Cl-,
如有白色沉淀生成,可能有Cl-
②再滴加稀HNO3溶液,如白色沉淀消失,则无Cl-,
如白色沉淀不消失,则有Cl-。
(2)SO42-检验:
原理:
SO42-+Ba2+==BaSO4
具体步骤:
①待测溶液中滴加Ba(NO3)2溶液,如无白色沉淀生成,则无SO42-
②再滴加稀HNO3溶液,如白色沉淀消失,则无SO42-,
如白色沉淀不消失,则有SO42-。
(3)CO32-检验:
原理:
CO32-+2H+==CO2+H2O
具体步骤:
①待测溶液中滴加稀HCl溶液,如无气泡产生,则无CO32-
如有气泡产生,可能有CO32-
②将产生的气体通入澄清石灰水,如不变浑浊,则无CO32-
如澄清石灰水变浑浊,则有CO32-
(4)NH4+检验:
原理:
NH4++OH-==NH3+H2O
具体步骤:
①待测溶液中滴加NaOH溶液,如无刺激性气体产生,则无NH4+
如有刺激性气体产生,则可能有NH4+
②将产生的气体通入湿润的红色石蕊试纸,如不变蓝,则无NH4+
如变蓝色,则有NH4+
第四节:
常见的碱
1、碱的通性(OH-)(可溶性碱:
NaOH、KOH、Ca(OH)2、Ba(OH)2)
(1)碱能与指示剂反应:
能使紫色石蕊试液变蓝,能使无色酚酞试液变红色。
(2)碱+非金属氧化物==盐+水
2NaOH+SO2==Na2SO3+H2O(吸收SO2)Ca(OH)2+SO2==CaSO3+H2O
2NaOH+CO2==N