精选5份合集湖南省邵阳市学年高一化学下学期期末学业质量监测试题Word文档格式.docx
《精选5份合集湖南省邵阳市学年高一化学下学期期末学业质量监测试题Word文档格式.docx》由会员分享,可在线阅读,更多相关《精选5份合集湖南省邵阳市学年高一化学下学期期末学业质量监测试题Word文档格式.docx(87页珍藏版)》请在冰豆网上搜索。
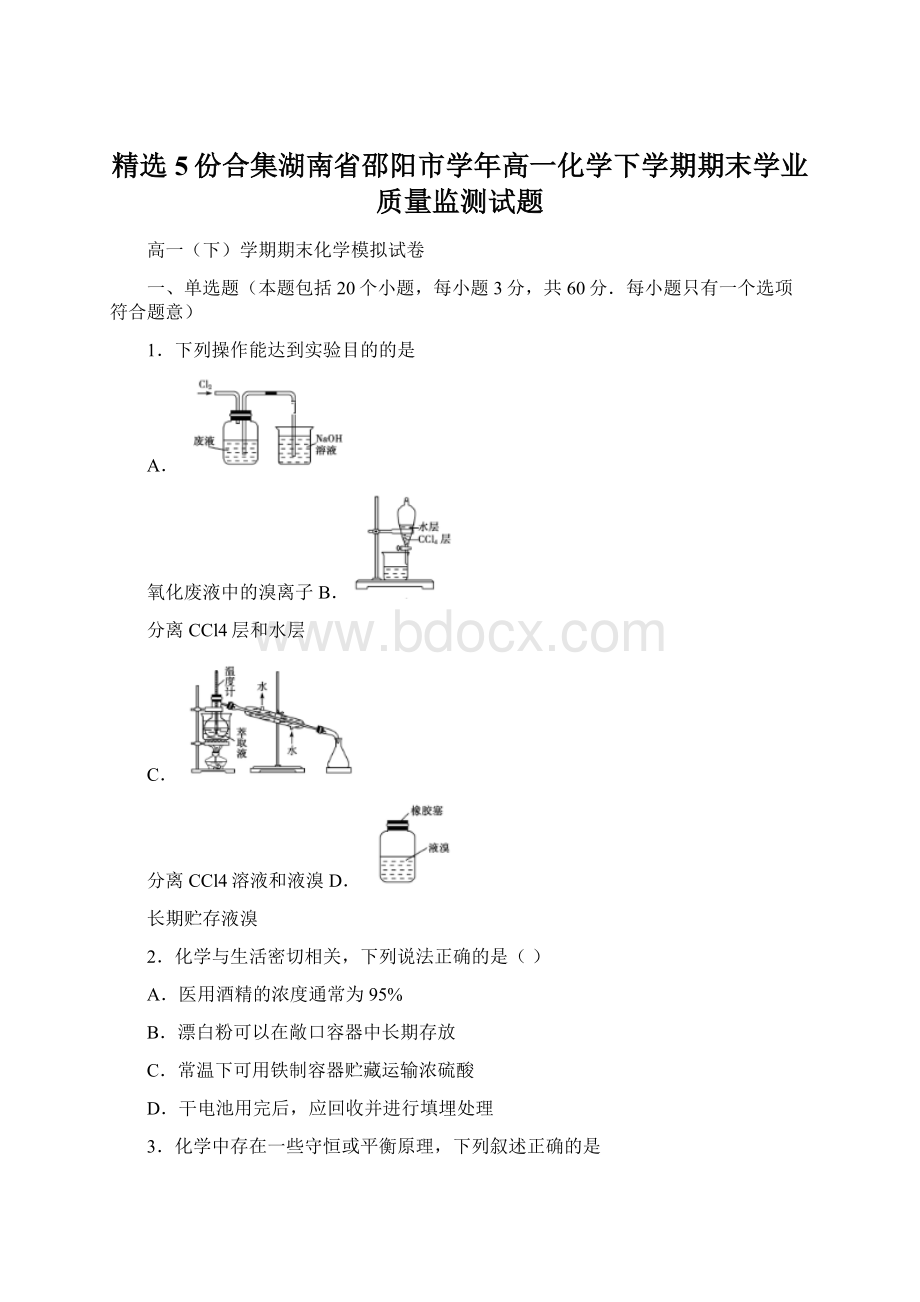
D.根据化学平衡原理,可逆反应的正反应速率在任何时刻一定等于逆反应速率
4.下列离子方程式不正确的是
A.稀硫酸和氢氧化钡溶液反应:
SO42-+Ba2+=
BaSO4↓
B.Cl2和水反应:
Cl2+H2O=
H++Cl-+HClO
C.乙酸乙酯和NaOH溶液反应:
CH3COC2H5+OH-
=CH3COO-
+CH3CH2OH
D.碳酸氢钙溶液和少量的澄清石灰水混合:
HCO3-+Ca2++OH-
=CaCO3↓
+H2O
5.在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:
3A(g)+B(g)=xC(g)+2D(g)。
2min时测得生成0.8molD,0.4molC。
下列判断不正确的是
A.x=1B.2min内A的反应速率为0.3mol·
L-1·
min-1
C.2min时,A的浓度为0.9mol·
L-1D.B的转化率为60%
6.氧化亚铜常用于制船底防污漆。
用CuO与Cu高温烧结可制取
已知反应:
则
的
等于
B.
D.
7.已知金属钠的活泼性非常强,甚至在常温时能和水发生反应2Na+2H2O===2NaOH+H2↑。
现将9.2克钠、7.2克镁、8.1克铝分别放入100克10.95%的盐酸中,同温同压下产生气体的质量比是( )
A.1∶2∶3B.4∶3∶3C.8∶6∶9D.1∶1∶1
8.下列叙述正确的是
A.15g甲基(-CH3)中含有的电子数为9NA
B.标准状况下,2.24L己烷中所含碳原子数为0.6NA
C.0.1molFe与足量稀硫酸反应时,转移电子数为0.3NA
D.由2SO2+O2
2SO3可知,2molSO2与1molO2充分反应生成SO3分子数为2NA
9.已知断裂1molC—H键,要吸收热量414.4kJ;
断裂1molC—C键,要吸收热量347.4kJ;
生成1molC=C键,会放出热量615.3kJ;
生成1molH—H键,会放出热量435.3kJ,某有机物分解的反应可表示为:
若在反应中消耗了1mol乙烷(反应物),则有关该反应的说法正确的是( )
A.该反应放出251.2kJ的热量B.该反应吸收251.2kJ的热量
C.该反应放出125.6kJ的热量D.该反应吸收125.6kJ的热量
10.以下实验能获得成功的是
A.用酸性KMnO4溶液鉴别乙烯和CH2===CH—CH3
B.将铁屑、稀溴水、苯混合制溴苯
C.苯和硝基苯采用分液的方法分离
D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
11.下列关于化学反应速率的说法正确的是( )
A.1L0.1mol•L﹣1盐酸和1L0.1mol•L﹣1硫酸分别与1L2mol•L﹣1NaOH溶液反应速率相
同
B.化学反应速率为0.8mol•L﹣1•s﹣1,其含义是时间为1s时,某物质的浓度是0.8mol•L﹣1
C.0.1mol•L﹣1盐酸和0.1mol•L﹣1硝酸与相同形状和大小的大理石反应的速率相同
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
12.在一定温度下,可逆反应A(气)+3B(气)
2C(气)若达到平衡的标志是
A.C的生成速率与B的生成速率相等
B.A、B、C的浓度不再发生变化
C.单位时间内生成nmolA,同时生成3nmolB
D.A、B、C的分子数之比为1:
3:
2
13.下列有关化学用语使用正确的是
A.甲烷分子的球棍模型:
B.中子数为18的氯原子:
C.NH3的结构式为:
D.乙烯的结构简式:
CH2CH2
14.下列关于化学键和化合物的说法中正确的是( )
A.Na2O2、NaOH、CaCl2三种化合物含有相同的化学键
B.金属元素和非金属元素形成的化合物一定是离子化合物
C.非金属元素组成的化合物一定是共价化合物
D.HCl、H2S溶于水时只破坏了共价键
15.美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。
“纳米车”可以用来运输单个的有机分子。
下列说法正确的是
A.人们用肉眼可以清晰看到“纳米车”的运动
B.“纳米车”诞生说明人类操纵分子的技术进入了一个新阶段
C.C60是一种新型的化合物
D.C60与12C是同位素
16.对于苯乙烯(结构简式为
)有下列叙述:
①不能使酸性KMnO4溶液褪色;
②能使溴的四氯化碳溶液褪色;
③不可溶于水;
④可溶于苯中;
⑤1mol苯乙烯最多能与4molH2发生加成反应;
⑥所有的原子不可能共平面,其中正确的是()
A.②③④⑤B.①②⑤⑥C.②③④⑥D.全部正确
17.我国首次试开采可燃冰圆满成功,下列与可燃冰(CH4·
nH2O)释放气体成分相同的是( )
A.天然气B.水煤气
C.液化石油气D.焦炉煤气
18.下列说法正确的是:
A.工业上是通过电解氯化铝、氯化镁制备金属铝和镁的
B.石油经过减压分馏主要得到C5~C11的汽油制品
C.将重油经过催化裂化可以获取汽油等产品
D.有机玻璃是将普通硅酸盐玻璃中加入一些有机物混合而成
19.(6分)在光照的条件下,将1molCH4与一定量的氯气充分混合,经过一段时间,甲烷和氯气均无剩余,生成CH3Cl、CH2Cl2、CHCl3、CCl4和HCl,若已知生成的二氯甲烷、三氯甲烷、四氯化碳的物质的量分别为Xmol,Ymol,Zmol,该反应中生成HCl的物质的量是
A.(1+X+2Y+3Z)molB.(X+Y+Z)mol
C.(2X+3Y+4Z)molD.(1-X-Y-Z)mol
20.(6分)在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+
O2(g)=SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)=
S2(g)+2H2O(g)△H2
③H2S(g)+
O2(g)=S(g)+H2O(g)△H3
④2S(g)=S2(g)△H4
则△H4的正确表达式为()
A.△H4=2/3(△H1+△H2-3△H3)
B.△H4=2/3(3△H3-△H1-△H2)
C.△H4=3/2(△H1+△H2-3△H3)
D.△H4=3/2(△H1-△H2-3△H3)
二、计算题(本题包括1个小题,共10分)
21.(6分)氨和硝酸都是重要的工业原料。
(1)标准状况下,将500L氨气溶于水形成1L氨水,则此氨水的物质的量浓度为__mol·
L-1(保留三位有效数字)。
工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。
合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2OD.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。
______________
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。
固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·
L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O的物质的量之比为__。
③HNO3的物质的量浓度为__mol·
L-1。
(4)有H2SO4和HNO3的混合溶液20mL,加入0.25mol•L﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C点混合液呈中性)。
则原混合液中H2SO4的物质的量浓度为__mol·
L-1,HNO3的物质的量浓度为__mol·
三、实验题(本题包括1个小题,共10分)
22.(8分)
(1)氨气是化学实验室常需制取的气体。
实验室制取氨气通常有两种方法:
方法一固体氢氧化钙与氯化铵共热
方法二固体氢氧化钠与浓氨水反应
①下面的制取装置图中,方法一应选用装置________(填“A”或“B”,下同),方法二应选用装置________。
②写出加热NH4Cl和Ca(OH)2制取NH3的反应方程式_________。
③在制取后,如果要干燥氨气,应选用的干燥剂是_____,收集氨气的方法是______。
A.浓硫酸B.碱石灰C.五氧化二磷
D.向上排空气法E.排水法F.向下排空气法
④检验是否收集满氨气的方法是____________________________________。
(2)请观察如图装置,回答下列问题:
①负极是_______,发生_______反应(填氧化或还原)。
②正极的电极反应式_______。
③该装置是一种把_______________________的装置,当导线中有0.2mole-发生转移时,求参加氧化反应的物质的物质的量为_______。
四、推断题(本题包括1个小题,共10分)
23.(8分)甲酸乙酯天然存在于蜂蜜、草莓等物质中,是一种重要的食用香精,某兴趣小组通过下述转化关系研究其性质。
(1)A的名称为__________________,D的结构简式为________________。
(2)C、E中官能团名称分别为______________、_______________。
(3)①和④的反应类型分别为______________反应、_______________反应。
(4)①和③两步的化学方程式为
①_____________________________。
③_____________________________。
(5)C的同分异构体的结构式为_________________。
(6)B和E的关系为(填字母代号)_________。
A.同系物B.同分异构体C.同素异形体D.同位素
五、综合题(本题包括1个小题,共10分)
24.(10分)随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)f在元素周期表的位置是_______