硫氮和可持续发展第一单元含硫化合物的性质和应用第1课时二氧化硫的性质和作用学案苏教版必修1Word格式.docx
《硫氮和可持续发展第一单元含硫化合物的性质和应用第1课时二氧化硫的性质和作用学案苏教版必修1Word格式.docx》由会员分享,可在线阅读,更多相关《硫氮和可持续发展第一单元含硫化合物的性质和应用第1课时二氧化硫的性质和作用学案苏教版必修1Word格式.docx(17页珍藏版)》请在冰豆网上搜索。
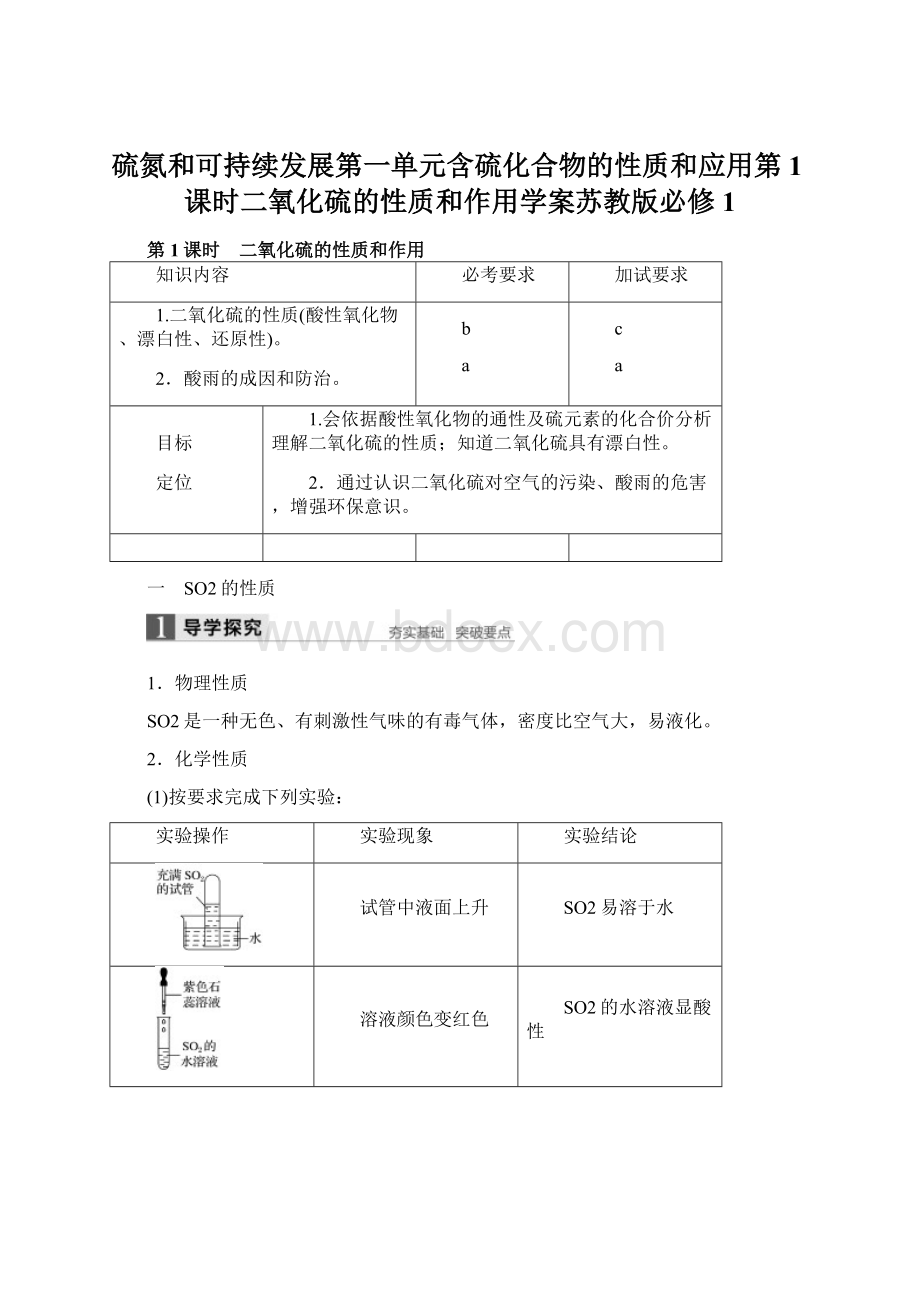
实验操作
实验现象
实验结论
试管中液面上升
SO2易溶于水
溶液颜色变红色
SO2的水溶液显酸性
溶液先变红,振荡后褪色,再加热后,溶液颜色恢复红色
SO2具有漂白性,但生成的化合物不稳定,受热易分解
产生白色沉淀
SO2具有还原性,可被新制氯水氧化成SO
,与Ba2+反应生成BaSO4沉淀
(2)根据以上实验总结SO2的化学性质
①酸性氧化物的通性:
写出下列反应的化学方程式:
a.与H2O反应:
SO2+H2OH2SO3。
b.与CaO反应:
SO2+CaO===CaSO3。
c.与足量的NaOH溶液反应:
SO2+2NaOH===Na2SO3+H2O。
d.NaOH溶液中通入足量SO2的反应:
SO2+NaOH===NaHSO3。
②二氧化硫具有漂白性,能跟某些有色物质(如品红等)化合生成无色物质,但此无色物质不稳定,见光、遇热或长久放置又容易分解,恢复到原来的颜色(与HClO、过氧化氢等漂白原理有本质区别)。
③二氧化硫具有较强的还原性:
可被多种氧化剂(如O2、Cl2、Br2、I2、HNO3、KMnO4、H2O2、Fe3+等)氧化。
a.SO2与O2反应:
2SO2+O2
2SO3;
b.SO2与H2O2反应:
SO2+H2O2===H2SO4;
c.SO2使氯水褪色:
SO2+Cl2+2H2O===H2SO4+2HCl。
归纳总结
SO2的性质
(1)SO2能使酸性KMnO4溶液、溴水褪色,表现出还原性。
SO2能使品红溶液褪色,表现出漂白性。
SO2能使含有酚酞的NaOH溶液褪色,表现出其酸性氧化物的通性。
(2)SO2具有弱氧化性,如:
SO2+2H2S===3S↓+2H2O。
(3)SO2与盐溶液的反应,如:
SO2+2NaHCO3===Na2SO3+H2O+2CO2或SO2+NaHCO3===NaHSO3+CO2。
除去CO2气体中混有的SO2气体,可以选用饱和NaHCO3溶液。
(4)SO2与碱溶液反应,反应产物与用量有关,如:
SO2+Ca(OH)2===CaSO3↓+H2O,2SO2+Ca(OH)2===Ca(HSO3)2。
(5)SO2气体的检验方法是将气体通入品红溶液,溶液褪色,加热,溶液恢复红色。
1.下列关于SO2性质的说法正确的是( )
A.密度比空气小
B.是无色无味的气体
C.可用SO2漂白食物
D.可与NaOH溶液反应
答案 D
2.如图是研究二氧化硫性质的微型实验装置。
现用70%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。
下列说法中错误的是( )
A.紫色石蕊溶液变蓝色
B.品红溶液褪色
C.溴水橙色褪去
D.含酚酞的NaOH溶液红色变浅
答案 A
解析 SO2气体与水反应生成H2SO3,紫色石蕊溶液遇酸变红色,不会变蓝色,故A错误。
二 酸雨的形成及危害
1.空气中的SO2主要来自煤、石油和某些含硫金属矿物的燃烧和冶炼,是大气污染物之一,直接危害人体健康,能形成酸雨。
pH小于5.6的降水叫做酸雨,正常雨水pH约为5.6,这是溶解了CO2的缘故。
2.硫酸型酸雨的形成主要有两条途径:
SO2
反应方程式分别为
途径1:
SO3+H2O===H2SO4。
途径2:
SO2+H2OH2SO3;
2H2SO3+O2===2H2SO4。
3.酸雨的危害
(1)使江河湖泊中的水酸化,导致鱼类难以生存,影响水生生物的繁殖。
(2)使土壤酸化。
酸雨落入土壤中,使其中的钙、镁等营养元素溶出,并迅速流失,导致土壤肥力下降,并被逐渐酸化,使农作物和树木的生长遭到破坏。
(3)酸雨会加速建筑物、桥梁、工业设备、电信电缆、雕塑等的腐蚀。
4.防治措施
(1)调整能源结构,发展清洁能源。
(2)研究煤的脱硫技术,改进燃烧技术,减少SO2的排放。
(3)加强工厂废气的回收处理。
酸雨的形成过程
[提醒] 燃煤脱硫反应:
SO2+CaO
CaSO3;
2CaSO3+O2
2CaSO4。
3.某雨水样品刚采集时测得pH为4.82,放在烧杯中2小时后,再次测得pH为4.68。
以下叙述正确的是( )
A.雨水样品酸度逐渐减小
B.雨水样品酸度没有变化
C.雨水样品继续吸收空气中的CO2
D.雨水样品中的H2SO3逐渐被空气中的氧气氧化成H2SO4
解析 题干中雨水样品的pH为4.82,则为酸雨,而酸雨形成的一个主要原因是排放到空气中的SO2与雨水结合形成酸性物质。
本实验测得雨水的pH变小,即酸性变强,而降雨中CO2已经达到饱和,不可能是吸收CO2的缘故,只能是弱酸H2SO3被氧化成了强酸,有关反应是SO2+H2OH2SO3,2H2SO3+O2===2H2SO4。
4.形成酸雨的原理之一可简示为
含硫燃料
A
B
硫酸
回答下列问题:
(1)A物质的化学式为_____________,B物质的化学式为________________________。
(2)洗涤含SO2的烟气,以下物质可作洗涤剂的是________。
a.Ca(OH)2b.Na2CO3
c.CaCl2d.NaHSO3
(3)利用钠碱循环法可脱除烟气中的SO2,在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____________________________
________________________________________________________________________。
(4)某有色金属冶炼厂排放的废气中含SO2,先用石灰浆吸收SO2,然后利用空气中的氧气将产物继续氧化成石膏(CaSO4·
2H2O)。
写出有关反应的两个化学方程式:
答案
(1)SO2 SO3
(2)ab
(3)SO2+2OH-===SO
+H2O
(4)SO2+Ca(OH)2===CaSO3+H2O,
2CaSO3+O2+2H2O===2CaSO4·
2H2O
1.有关硫的氧化物的叙述不正确的是( )
A.空气中二氧化硫主要来源于煤和石油产品的燃烧
B.二氧化硫与飘尘接触,部分氧化为三氧化硫,危害更严重
C.酸雨中的含硫化合物只有硫的氧化物和硫酸
D.减少大气中SO2污染的主要方法之一是减少含硫化石燃料的燃烧
答案 C
解析 大气中SO2主要来源于煤和石油产品的燃烧,A正确;
SO2与O2在飘尘等催化下可生成SO3,SO3溶于水生成强酸H2SO4,危害更大,B正确;
酸雨中还有硫酸盐,C错;
煤和石油中均含有硫元素,D正确。
2.能证明SO2具有漂白性的是( )
A.酸性KMnO4溶液中通入SO2气体后紫红色消失
B.滴入酚酞的NaOH溶液中通入SO2气体后红色消失
C.品红溶液中通入SO2气体后红色消失
D.溴水中通入SO2气体后橙色消失
解析 酸性KMnO4溶液中通入SO2气体后紫红色消失、溴水中通入SO2气体后橙色消失都是利用了SO2的还原性,是因为MnO
和Br2被SO2还原为Mn2+和Br-而褪色,加入酚酞的NaOH溶液红色消失是因为通入的SO2气体与NaOH反应而使碱性减弱;
只有SO2气体通入品红溶液后红色消失才能证明SO2具有漂白性。
3.下列溶液中通入SO2一定不会产生沉淀的是( )
A.Ba(OH)2B.Ba(NO3)2
C.Na2SD.BaCl2
解析 SO2是酸性氧化物,能与Ba(OH)2溶液反应生成BaSO3沉淀;
H2SO3属于弱酸,不能与BaCl2溶液反应;
H2SO3中S元素呈+4价,因此H2SO3在反应中既可表现酸性,又可表现还原性与氧化性,SO2与Ba(NO3)2、Na2S反应的方程式分别为3SO2+2H2O+Ba(NO3)2===BaSO4↓+2NO↑+2H2SO4,3SO2+2Na2S===3S↓+2Na2SO3。
4.下列溶液能够区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③酸性KMnO4溶液 ④氯水 ⑤品红溶液
A.①②③B.②③④
C.②③④⑤D.①②③④⑤
解析 SO2和CO2都是酸性氧化物,都能与澄清石灰水反应生成不溶性盐,故不能用澄清石灰水区别SO2和CO2。
SO2具有氧化性,能将H2S氧化生成单质S(有淡黄色沉淀生成)。
也具有还原性,能被酸性KMnO4溶液和氯水氧化(溶液褪色),而CO2不具有这些性质。
SO2具有漂白性,能使品红溶液褪色,CO2不具有这一性质,所以可用②③④⑤四种试剂来区别SO2和CO2气体。
5.化石燃料燃烧产生的SO2是形成酸雨的主要原因,下列措施中不能减少酸雨危害的是( )
A.对含硫化石燃料进行脱硫处理
B.研发和使用替代化石燃料的新能源
C.对含SO2废气进行回收和利用
D.将含SO2废气直接排放至高空
解析 A、B、C都可减少二氧化硫的排放,减少酸雨的形成;
而将含SO2废气直接排放至高空,可导致酸雨。
6.用如图装置进行SO2气体性质实验,请回答:
(1)仪器D的名称是________________________。
(2)实验过程中,仪器A中的实验现象是_______________________________________。
(3)写出仪器C中发生氧化还原反应的离子方程式:
_____________________________
答案
(1)U形干燥管
(2)品红溶液褪色
(3)2H2O+SO2+2Fe3+===2Fe2++SO
+4H+
解析
(1)依据形状可知:
装置D中盛放碱石灰的仪器名称是U形干燥管。
(2)二氧化硫具漂白性,能使品红溶液褪色,A中盛放的是品红溶液,所以仪器A中的实验现象是品红溶液褪色。
(3)二氧化硫具有还原性,能被铁离子氧化为硫酸根,离子方程式为2H2O+SO2+2Fe3+===2Fe2++SO
+4H+。
课时作业
[经典基础题]
1.关于SO2的叙述中正确的是( )
A.在有的反应中表现氧化性,在有的反应中表现还原性
B.是酸性氧化物,溶于水得稳定的亚硫酸
C.SO2气体通入NaOH溶液一定得到Na2SO3
D.SO2气体通入BaCl2溶液中,能生成白色沉淀
解析 亚硫酸不稳定,易分解,B项错;
SO2与NaOH反应还可能生成NaHSO3,C项错;
SO2与BaCl2溶液不反应,D项错。
2.下列能使品红溶液褪色的是( )
A.SO2B.BaSO4
C.KClD.CO2
解析 二氧化硫可以与有色物质化合生成无色物质,能使品红溶液褪色而具