高中化学精品学案常见物质的分离提纯文档格式.docx
《高中化学精品学案常见物质的分离提纯文档格式.docx》由会员分享,可在线阅读,更多相关《高中化学精品学案常见物质的分离提纯文档格式.docx(23页珍藏版)》请在冰豆网上搜索。
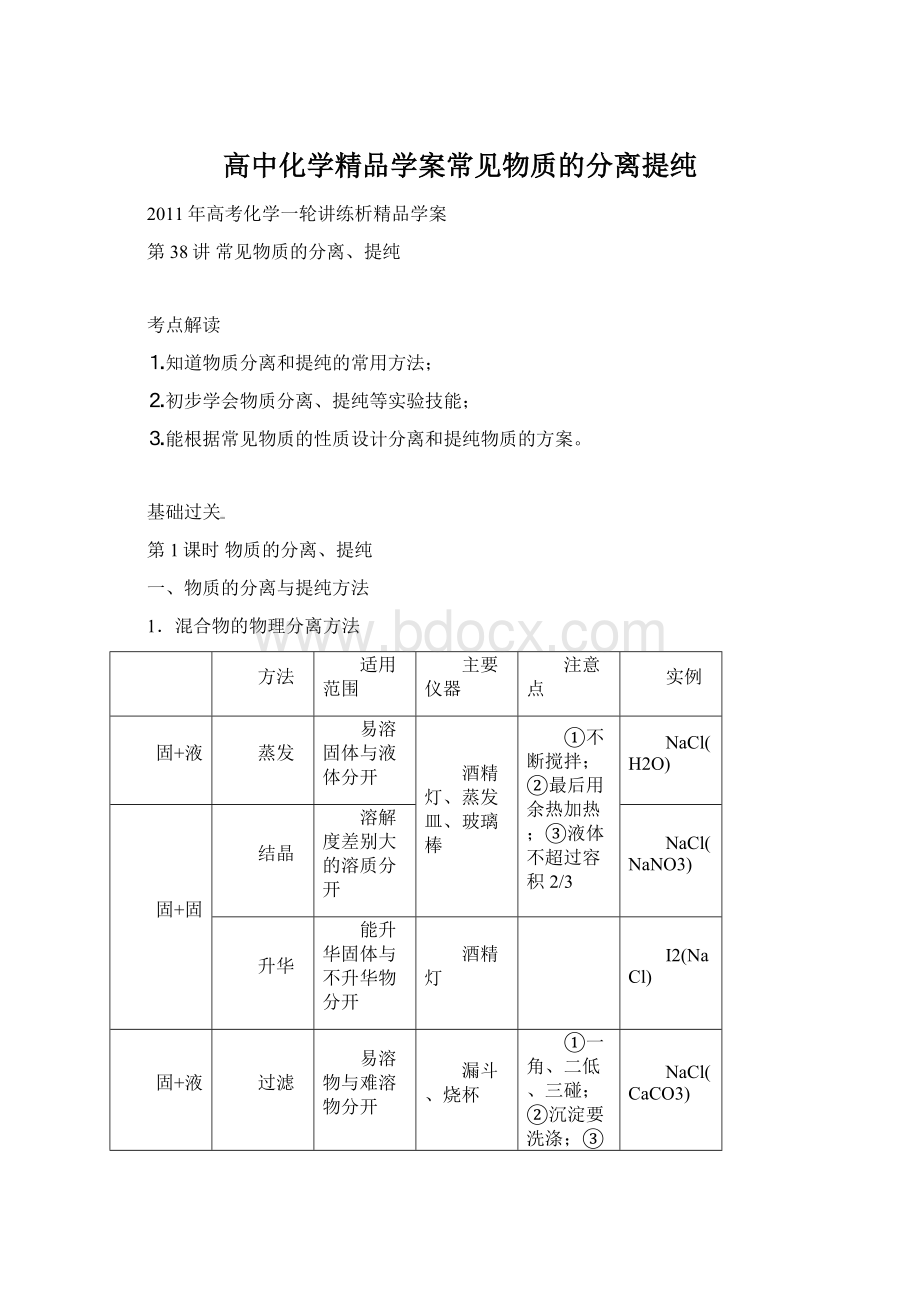
NaCl(NaNO3)
升华
能升华固体与不升华物分开
酒精灯
I2(NaCl)
过滤
易溶物与难溶物分开
漏斗、烧杯
①一角、二低、三碰;
②沉淀要洗涤;
③定量实验要“无损”
NaCl(CaCO3)
液+液
萃取
溶质在互不相溶的溶剂里,溶解度的不同,把溶质分离出来
分液漏斗
①先查漏;
②对萃取剂的要求;
③使漏斗内外大气相通;
④上层液体从上口倒出
从溴水中提取Br2
分液
分离互不相溶液体
乙酸乙酯与饱和Na2CO3溶液
蒸馏
分离沸点不同混合溶液
蒸馏烧瓶、冷凝管、温度计、牛角管
①温度计水银球位于支管处;
②冷凝水从下口通入;
③加碎瓷片
乙醇和水、
I2和CCl4
渗析
分离胶体与混在其中的分子、离子
半透膜
更换蒸馏水
淀粉与NaCl
盐析
加入某些盐,使溶质的溶解度降低而析出
烧杯
用固体盐或浓溶液
蛋白质溶液、
硬脂酸钠和甘油
气+气
洗气
易溶气与难溶气分开
洗气瓶
长进短出
CO2(HCl)
液化
沸点不同气分开
U形管
常用冰水
NO2(N2O4)
附:
常见物质的分离和提纯装置:
如图
2.混合物的化学分离法
热分解法
沉淀分离法
酸碱分离法
水解分离法
氧化还原法
NH4Cl(NaCl)
NaCl(BaCl2)
MgCl2(AlCl3)
Mg2+(Fe3+)
Fe2+(Cu2+)
二、物质的鉴别
物质的检验通常有鉴定、鉴别和推断三类,它们的共同点是:
依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理。
不同点见下表:
检验类型
鉴别
利用不同物质的性质差异,通过实验,将它们区别开来。
鉴定
根据物质的特性,通过实验,检验出该物质的成分,确定它是否是这种物质。
推断
根据已知实验及现象,分析判断,确定被检的是什么物质,并指出可能存在什么,不可能存在什么。
检验方法
①
若是固体,一般应先用蒸馏水溶解
②
若同时检验多种物质,应将试管编号
③
要取少量溶液放在试管中进行实验,绝不能在原试剂瓶中进行检验
④
叙述顺序应是:
实验(操作)→现象→结论→原理(写方程式)
1.常见气体的检验
常见气体
氢气
纯净的氢气在空气中燃烧呈淡蓝色火焰,混合空气点燃有爆鸣声,生成物只有水。
不是只有氢气才产生爆鸣声;
可点燃的气体不一定是氢气
氧气
可使带火星的木条复燃
氯气
黄绿色,能使湿润的碘化钾淀粉试纸变蓝(O3.NO2也能使湿润的碘化钾淀粉试纸变蓝)
氯化氢
无色有刺激性气味的气体。
在潮湿的空气中形成白雾,能使湿润的蓝色石蓝试纸变红;
用蘸有浓氨水的玻璃棒靠近时冒白烟;
将气体通入AgNO3溶液时有白色沉淀生成。
二氧化硫
能使品红溶液褪色,加热后又显红色。
能使酸性高锰酸钾溶液褪色。
硫化氢
无色有具鸡蛋气味的气体。
能使Pb(NO3)2或CuSO4溶液产生黑色沉淀,或使湿润的醋酸铅试纸变黑。
氨气
无色有刺激性气味,能使湿润的红色石蕊试纸变蓝,用蘸有浓盐酸的玻璃棒靠近时能生成白烟。
二氧化氮
红棕色气体,通入水中生成无色的溶液并产生无色气体,水溶液显酸性。
一氧化氮
无色气体,在空气中立即变成红棕色
二氧化碳
能使澄清石灰水变浑浊;
能使燃着的木条熄灭。
SO2气体也能使澄清的石灰水变混浊,N2等气体也能使燃着的木条熄灭。
一氧化碳
可燃烧,火焰呈淡蓝色,燃烧后只生成CO2;
能使灼热的CuO由黑色变成红色。
甲烷
无色气体,可燃,淡蓝色火焰,生成水和CO2;
不能使高锰酸钾、溴水褪色。
乙烯
无色气体、可燃,燃烧时有明亮的火焰和黑烟,生成水和CO2。
能使高锰酸钾溶液、溴水褪色。
乙炔
无色无臭气体,可燃,燃烧时有明亮的火焰和浓烟,生成水和CO2,能使高锰酸钾溶液、溴水褪色。
2.几种重要阳离子的检验
(l)H+:
能使紫色石蕊试液或橙色的甲基橙试液变为红色。
(2)Na+、K+:
用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片)。
(3)Ba2+:
能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸。
(4)Mg2+:
能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。
(5)Al3+:
能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。
(6)Ag+:
能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+。
(7)NH4+:
铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。
(8)Fe2+:
能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。
或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。
2Fe2++Cl2=2Fe3++2Cl-
(9)Fe3+:
能与KSCN溶液反应,变成血红色Fe(SCN)3溶液,能与NaOH溶液反应,生成红褐色Fe(OH)3沉淀。
(10)Cu2+:
蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH溶液反应,生成蓝色的Cu(OH)2沉淀,加热后可转变为黑色的CuO沉淀。
含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成。
3.几种重要的阴离子的检验
(1)OH-:
能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。
(2)Cl-:
能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+。
(3)Br-:
能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸。
(4)I-:
能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;
也能与氯水反应,生成I2,使淀粉溶液变蓝。
(5)SO42-:
能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸。
(6)SO32-:
浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色。
能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。
(7)S2-:
能与Pb(NO3)2溶液反应,生成黑色的PbS沉淀。
(8)CO32-:
能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。
(9)HCO3-:
取含HCO3-盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变浑浊。
或向HCO3-盐酸溶液里加入稀MgSO4溶液,无现象,加热煮沸,有白色沉淀MgCO3生成,同时放出CO2气体。
(10)PO43-:
含磷酸根的中性溶液,能与AgNO3反应,生成黄色Ag3PO4沉淀,该沉淀溶于硝酸。
(11)NO3-:
浓溶液或晶体中加入铜片、浓硫酸加热,放出红棕色气体。
4.几种重要有机物的检验
(1)苯:
能与纯溴、铁屑反应,产生HBr白雾。
能与浓硫酸、浓硝酸的混合物反应,生成黄色的苦杏仁气味的油状(密度大于1)难溶于水的硝基苯。
(2)乙醇:
能够与灼热的螺旋状铜丝反应,使其表面上黑色CuO变为光亮的铜,并产生有刺激性气味的乙醛。
乙醇与乙酸、浓硫酸混合物加热反应,将生成的气体通入饱和Na2CO3溶液,有透明油状、水果香味的乙酸乙酯液体浮在水面上。
(3)苯酚:
能与浓溴水反应生成白色的三溴苯酚沉淀。
能与FeCl3溶液反应,生成紫色溶液。
(4)乙醛:
能发生银镜反应,或能与新制的蓝色Cu(OH)2加热反应,生成红色的Cu2O沉淀。
5.用一种试剂或不用试剂鉴别物质
用一种试剂来鉴别多种物质时,所选用的试剂必须能和被鉴别的物质大多数能发生反应,而且能产生不同的实验现象。
常用的鉴别试剂有FeCl3溶液、NaOH溶液、Na2CO3溶液、稀H2SO4.Cu(OH)2悬浊液等。
不用其他试剂来鉴别一组物质,一般情况从两个方面考虑:
①利用某些物质的特殊性质(如颜色、气味、溶解性等),首先鉴别出来,然后再用该试剂去鉴别其他物质。
归纳多功能试剂
在解化学实验的鉴别题时,如能够快速选用合适的“多功能试剂”,则可大大提高解题速度和质量,对限制试剂种数,特别是需要一种试剂鉴别的题,更具有特殊意义
一、化学试剂中的“多面手"
-----FeCl3溶液
1、在苯酚溶液中,滴人两三滴FeCl3溶液,立即出现紫色。
2、与无色透明的硫氰化钾溶液反应,呈血红色。
3、在FeCl3溶液中加入足量的Fe粉,溶液由棕黄色逐渐变为浅绿色。
4、把H2S气体通入FeCl3溶液,溶液由棕黄色逐渐变为浅绿色,同时溶液也变浑浊。
5、在FeCl3溶液中加入NaI溶液,很快看到有棕色浑浊出现。
6、与AgN03溶液反应生成不溶于稀HN03的白色沉淀。
二、溴水----橙色液体
1、其溶质易被有机溶剂萃取,有机溶剂层颜色加深。
2、能与酚类(如酚酞)发生取代反应生成白色沉淀。
3、能与含双键或三键的不饱和有机物发生加成反应而褪色。
4、能与碱性物质发生反应而褪色,如NaOH,Na2C03溶液等。
5、具有氧化性,能把一些还原性较强的物质氧化,本身褪色,如(H2S、NaI、Na2S03)等。
三、新制的Cu(OH):
悬浊液
1、具有不溶性碱的通性;
加热可分解成CuO黑色沉淀;
遇较强酸溶液能溶解,变为澄清透明的蓝色溶液。
2、具有弱氧化性;
在加热时能够把一CHO氧化成一COOH,而本身被还原为Cu20砖红色沉淀。
3、能与多羟基的物质(如甘油、葡萄等)反应生成绛蓝色溶液。
四、Ba(OH)2——五色透明液体
1.3.5
1、Ba2+的功能:
能与CO32—、P043-、SO32-等生成溶于HCI溶液的白色沉淀;
能与S042-生成不溶于稀盐酸的白色沉淀。
2,4,6
2、OH—的功能:
能与许多金属离子反应生成不溶于水的沉淀;
能与NH4+反应生成NH3;
能使A1(OH)3、A1203溶解。
典型例题
【例1】
(2010天津卷)下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:
Cu+2Fe3+=Cu2++2Fe2+
B.Na2O2与H2O反应制备O2:
Na2O2+H2O=2Na++2OH-+O2↑
C.将氯气溶于水制备次氯酸:
Cl2+H2O=2H++Cl-+ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO
+6H++5H2O2=2Mn2++5O2↑+8H2O
解析:
B中元素不守恒,正确的离子方程式为:
2Na2O2+2H2O==4Na++4OH-+O2;
C中的HClO