原电池与电解池对比金属的电化学腐蚀与防护吸氧腐蚀析氢腐蚀Word文档格式.docx
《原电池与电解池对比金属的电化学腐蚀与防护吸氧腐蚀析氢腐蚀Word文档格式.docx》由会员分享,可在线阅读,更多相关《原电池与电解池对比金属的电化学腐蚀与防护吸氧腐蚀析氢腐蚀Word文档格式.docx(14页珍藏版)》请在冰豆网上搜索。
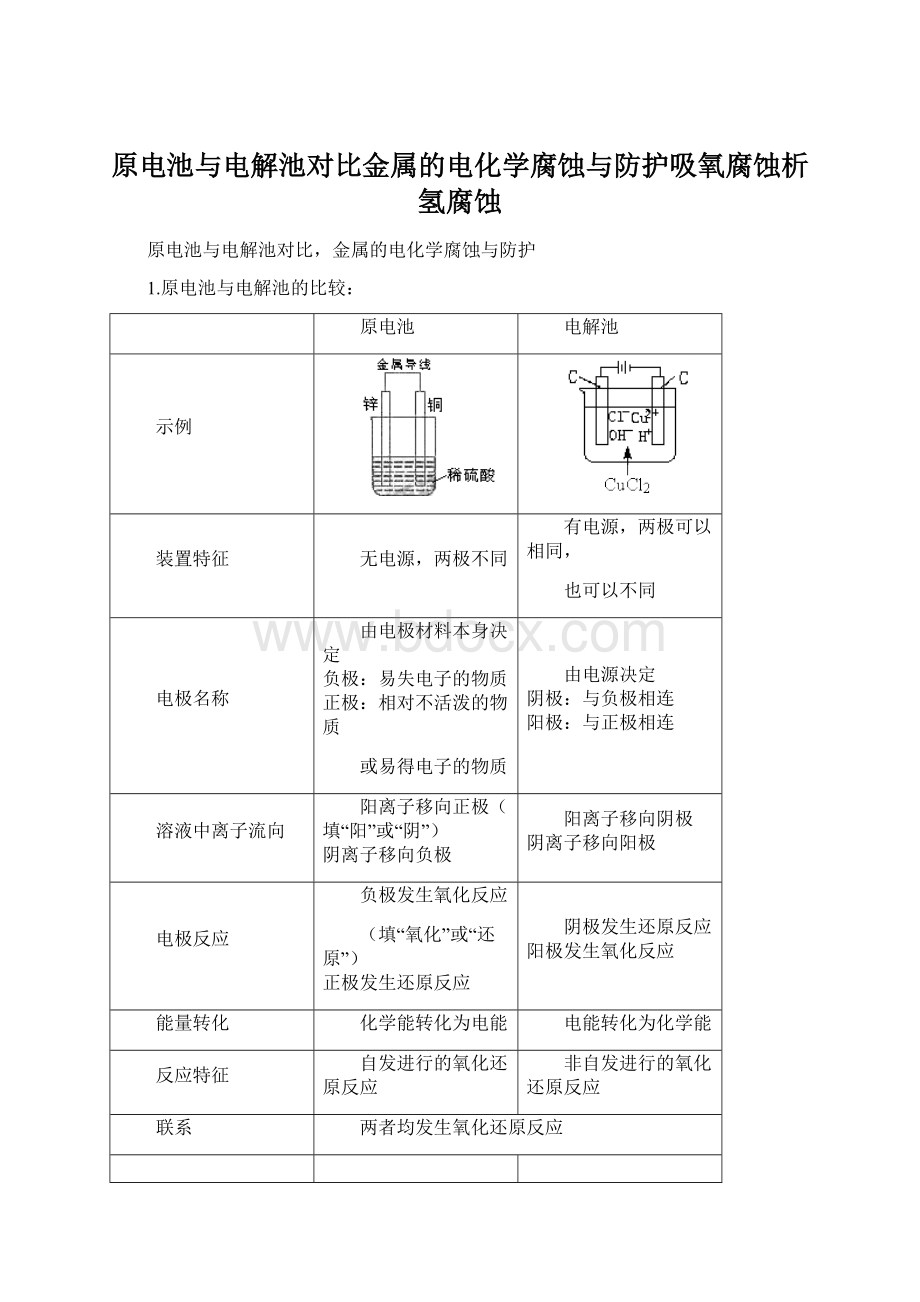
溶液中离子流向
阳离子移向正极(填“阳”或“阴”)
阴离子移向负极
阳离子移向阴极
阴离子移向阳极
电极反应
负极发生氧化反应
(填“氧化”或“还原”)
正极发生还原反应
阴极发生还原反应
阳极发生氧化反应
能量转化
化学能转化为电能
电能转化为化学能
反应特征
自发进行的氧化还原反应
非自发进行的氧化还原反应
联系
两者均发生氧化还原反应
2.金属腐蚀的本质:
金属单质失去电子变为金属阳离子的过程,金属发生氧化反应(填“氧化”或“还原”)。
3.金属腐蚀的类型
(1)金属的化学腐蚀与电化学腐蚀:
类型
化学腐蚀
电化学腐蚀
条件
金属跟非金属单质直接接触
不纯金属或合金跟电解质溶液接触
现象
无电流产生
有微弱电流产生
本质
金属被氧化
金属被氧化,原电池反应
两者往往同时发生,电化学腐蚀更普遍
(2)析氢腐蚀与吸氧腐蚀,以钢铁的腐蚀为例进行分析:
析氢腐蚀
吸氧腐蚀
酸性环境
中性环境或碱性环境
负极反应
Fe-2e-=Fe2+
正极反应
2H++2e-=H2↑
O2+2H2O+4e-=4OH-
总反应式
Fe+2H+=Fe2++H2↑
2Fe+O2+2H2O=2Fe(OH)2
吸氧腐蚀更普遍
注意:
正确判断金属所处环境的酸碱性是辨别金属析氢腐蚀、吸氧腐蚀的关键。
如金属在潮湿的空气或中性溶液中发生吸氧腐蚀;
而在NH4Cl溶液、稀H2SO4等酸性溶液中发生析氢腐蚀。
a.正确判断金属所处环境的酸碱性是辨别金属析氢腐蚀、吸氧腐蚀的关键。
b.生活中铁生锈过程涉及的化学反应有________________________________________________。
4.金属的防护
(1)电化学防护
利用如图装置,可以模拟铁的电化学防护。
为减缓铁的腐蚀:
a.若开关K置于M处,则X应为比铁活泼的金属Zn等,该电化学防护法称为牺牲负极的正极保护法。
或牺牲阳极的阴极保护法。
b.若开关K置于N处,则铁作阴极,铁很难被腐蚀,该电化学防护法为外加电流的阴极保护法。
总结:
如果想利用原电池原理保护某金属,则应该让该金属作______极,找一个比它更活泼的金属材料作_________极。
如果想利用电池池原理保护某金属,则应该让该金属作______极。
(2)改变金属的内部结构,如制成合金、不锈钢等。
(3)加防护层,如在金属表面喷油漆、涂油脂、喷镀或表面钝化等方法。
5.判断金属腐蚀快慢的规律:
(1)金属腐蚀速率的快慢:
电解原理引起的腐蚀>
原电池原理引起的腐蚀>
化学腐蚀>
有防护措施的腐蚀。
注:
原电池原理引起的腐蚀中,活动性不同的两种金属,活动性差别越大,腐蚀速率越_________。
(2)如果金属有防护措施,则防护效果:
电解原理引起的防护>
原电池原理引起的防护>
有物理防护的措施。
例1.(金属的电化学腐蚀:
吸氧腐蚀与析氢腐蚀)
1.用如图所示装置研究电化学腐蚀及防护。
关于图1和图2的叙述正确的是(D)
A.负极反应均是:
Fe-2e→Fe2+B.正极反应均是:
O2+2H2O+4e→4OH-
C.铁均被保护D.图2的灯泡更亮
例2.(金属的电化学防护:
牺牲阳极的阴极保护法、外加电流的阴极保护法)
2.关于钢铁电化学保护两种方法的说法,正确的是(C)
A.牺牲阳极阴极保护法利用的是电解原理
B.外加电流阴极保护法利用的是原电池原理
C.牺牲阳极阴极保护法中钢铁为正极
D.外加电流阴极保护法中钢铁为阳极
例3.(原电池与电解池综合)
3.某课外兴趣小组用下图装置进行实验,
试回答:
(1)若开始时开关K与a连接,则A电极反应式为___________________________。
(2)若开始时开关K与b连接,则A电极反应式为__________________________。
(3)若开始时开关K与b连接,电路中通过0.2NA个电子时,两极共产生______mol气体。
(4)若开关K与b连接,铁和石墨棒互换位置,描述U型管中观察到的现象:
__________________。
3.
(1)O2+4e-+2H2O=4OH-
(2)2Cl--2e-=Cl2↑
(3)0.2
(4)铁电极逐渐溶解,石墨电极附近有气泡产生,U型管底部有白色沉淀产生。
变式训练:
1.铁锅表面覆盖有下列物质时,锈蚀速率最快的是(B)
A.水B.食盐水C.食用油D.酒精
【解析】当形成电化学腐蚀,且铁做原电池的负极材料时,表面覆盖的溶液导电性越强,锈蚀速率越快。
详解:
食用油和酒精为非电解质,不能形成原电池反应,而水的导电性没有食盐水强,所以锈蚀速率最快的是食盐水。
2.如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面图。
下列说法正确的是(D)
A.该电化学腐蚀为析氢腐蚀
B.图中生成铁锈最多的是C区域
C.A区域比B区域更易腐蚀
D.铁闸中的负极的电极反应:
Fe-2e→Fe2+
解:
铁闸在海水中发生吸氧腐蚀,在酸性较强的条件下才发生析氢腐蚀,A错误;
在B处,海水与氧气接触,与Fe最易形成原电池,发生的吸氧腐蚀的程度最大,生成铁锈最多,B错误;
在B处,海水与氧气接触,与Fe最易形成原电池,所以
B区域比A区域更易腐蚀,C错误;
Fe作负极失电子生成亚铁离子,则负极的电极反应为Fe-2e-=Fe2+,D正确。
3.下列与金属腐蚀有关的说法中,不正确的是(D)
A.钢铁在潮湿空气中生锈属于电化学腐蚀
B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀
C.金属腐蚀的本质是金属原子失去电子被氧化的过程
D.铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应
4.在铁的吸氧腐蚀过程中,下列5种变化中可能发生的是(A)
①Fe由+2价转化为+3价,②O2被还原,③产生H2,
④Fe(OH)3失水形成Fe2O3·
nH2O,⑤杂质炭被氧化除去
A.①②④B.①③④C.①②⑤D.①②③⑤
5.镀锌铁在发生析氢腐蚀时,若有0.2mol电子发生转移,下列说法正确的是(B)
①有5.6g金属被腐蚀
②有6.5g金属被腐蚀
③在标准状况下有2.24L气体放出
④在标准状况下有1.12L气体放出
A.①③B.②③C.①④D.②④
【解析】镀锌铁在发生析氢腐蚀时,较活泼的金属锌作负极,较不活泼的金属铁作正极,负极上锌失电子而被腐蚀,正极上氢离子得电子被还原.
根据Zn﹣2e﹣=Zn2+得,腐蚀锌的质量=
=6.5g;
根据2H++2e﹣=H2↑得,生成氢气的体积=
.故选B.
6.下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。
下列说法不正确的
是(C)
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:
【解析】根据装置图判断,左边铁丝发生吸氧腐蚀,右边铁丝发生析氢腐蚀,其电极反应为
左边 负极:
Fe-2e-=Fe2+正极:
O2+4e-+2H2O=4OH-
右边 负极:
a、b处的pH均增大,C错误。
7.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中不正确的是(B)
A.此过程中铜并不被腐蚀B.此过程中正极电极反应式为:
2H++2e→H2↑
C.此过程中电子从Fe移向CuD.此过程中还涉及到反应:
4Fe(OH)2+2H2O+O2→4Fe(OH)3
8.已知a、b、c、d四个金属电极,有关的实验装置、部分实验现象如下:
由此可判断这四种金属的活动性顺序是(B)
A.a>b>c>dB.d>a>b>cC.b>c>d>aD.a>b>d>c
9.滴有酚酞和氯化钠试液的湿润滤纸分别做甲、乙两个实验能发现附近变成红色的电极是(D)
A.a、cB.a、dC.b、cD.b、d
10.关于金属的腐蚀与防护,下列叙述正确的是(B)
A.金属腐蚀就是金属失去电子被还原的过程
B.将需防腐的金属与外加直流电源的负极相连,正极与废铁相连
C.镀锌铁皮发生腐蚀时,负极的电极反应式为:
Fe-2e→Fe2+
D.铁钉在潮湿空气中生锈,是因为直接发生反应:
4Fe+3O2→2Fe2O3
11.为保护地下钢管不受腐蚀,可使它与(C)
①直流电源负极相连,②铜板相连,③锌板相连,④直流电源正极相连。
A.①②B.③④C.①③D.②④
12.下列金属防腐的措施中,属于牺牲阳极的阴极保护法的是(B)
A.水中的钢闸门连接电源的负极
B.地下钢管连接锌板
C.铁件镀铜
D.自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨
【解析】A.水中的钢闸门连接电源的负极时构成电解池装置,负极钢闸门被保护,不属于属于牺牲阳极的阴极保护法,故A错误;
B.地下钢管连接锌板时构成原电池装置,锌板发生氧化反应损失掉,钢管做原电池负极被保护,属于牺牲阳极的阴极保护法,故B正确;
C.铁件镀铜不属于电化学保护法,故C错误;
D.自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨,不属于电化学保护法,故D错误。
13.(2015上海)研究电化学腐蚀及防护的装置如下图所示。
下列有关说法错误的是(D)
A.d为石墨,铁片腐蚀加快B.d为石墨,石墨上电极反应为:
O2+2H2O+4e→4OH-
C.d为锌块,铁片不易被腐蚀D.d为锌块,海水中的氯离子移向铁片
14.钢铁在海水中容易被腐蚀,下图四种装置可用于探究海水对钢铁腐蚀的快慢,其中铁被腐蚀最慢的是(C)
A.
B.
C.
D.
15.分别放置在以下装置(都盛有0.1mol/L的H2SO4溶液)中的四块相同的纯锌片,锌片腐蚀最快的是(C)
ABCD
16.对于铁在海水的腐蚀及防护设计实验如下(烧杯中装的是海水),以下描述正确的是(C)
A.1中的铁被腐蚀得最慢
B.2中的铁被腐蚀得最快
C.3中是通过牺牲阳极的阴极保护法防止铁被腐蚀
D.4中是通过外加电流法防止铁被腐蚀
17.按下图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是(C)
A.E表示生成铜的物质的量B.E表示总反应中消耗水的物质的量
C.F表示生成硫酸的物质的量D.F表示反应生成氧气的物质的量
18.观察如图装置,下列说法正确的是(C)
A.a、b间接电流表,该装置为原电池B.a、b间接直流电源,该装置为电解池
C.a、b间接直流电源,铁可能不易被腐蚀D.a、b间接电流表或接直流电源,铁都可能是负极
【详解】A、如果液体c为乙醇等非电解质,则不符合构成原电池的条件,故A错误;
B、如果液体c为乙醇等非电解质,该电路为断路,不能构成电解池,故B错误;
C、连接直流电源,如果让铁作阴极,按照电解原理,铁不被腐蚀,故C正确;
D、如果接电流表,构成原电池,铁作负极