可逆电池的电动势及其应用_精品文档PPT文档格式.ppt
《可逆电池的电动势及其应用_精品文档PPT文档格式.ppt》由会员分享,可在线阅读,更多相关《可逆电池的电动势及其应用_精品文档PPT文档格式.ppt(101页珍藏版)》请在冰豆网上搜索。
有两个电极和与电极建立电化学平衡的相应电解质电解质4。
有其他附属设备,组成一个完整的电路。
有其他附属设备,组成一个完整的电路常见电池的类型常见电池的类型单液电池单液电池常见电池的类型常见电池的类型双液电池双液电池用素烧瓷分开用素烧瓷分开常见电池的类型常见电池的类型双液电池双液电池用盐桥分开用盐桥分开化学反应可逆原电池电解池组成可逆电池的必要条件组成可逆电池的必要条件能量变化可逆净反应:
作电解池阴极:
阳极作原电池Zn(s)|ZnSO4|HCl|AgCl(s)|Ag(s)组成可逆电池的必要条件组成可逆电池的必要条件净反应金属与其阳离子组成的电极氢电极氧电极卤素电极汞齐电极金属-难溶盐及其阴离子组成的电极金属-氧化物电极氧化-还原电极第一类电极第二类电极第三类电极可逆电极的类型第一类电极的电极反应电极电极反应(还原)第二类电极的电极反应电极电极反应(还原)第三类电极的电极反应电极电极反应(还原)9.2电动势的测定对消法测电动势标准电池对消法测定电动势的原理图对消法测电动势的实验装置工作电源电位计检流计标准电池待测电池正正负负Weston标准电池结构简图标准电池Weston标准电池的反应负极正极净反应中含镉298.15K时为什么在定温度下,含Cd的质量分数在0.050.14之间,标准电池的电动势有定值?
从Hg-Cd相图可知,在室温下,镉汞齐中镉的质量分数在0.050.14之间时,系统处于熔化物和固溶体两相平衡区,镉汞齐活度有定值。
而标准电池电动势只与镉汞齐的活度有关,所以也有定值。
问题RT通常要把标准电池恒温、恒湿存放,使电动势稳定。
标准电池的电动势与温度的关系ET/V=E(293.15K)/V-39.94(T/K-293.15)+0.929(T/K-293.15)2-0.009(T/K-293.15)3+0.00006(T/K-293.15)410-6我国在1975年提出的公式为:
标准电池的温度系数很小9.3可逆电池的书写方法及电动势的取号可逆电池的书写方法可逆电池电动势的取号1.左边为负极,起氧化作用,是阳极;
2.“|”表示相界面,有电势差存在。
“”表示半透膜。
4.要注明温度,不注明就是298.15K;
5.电池的电动势等于右边正极的还原电极电势减去左边负极的还原电极电势右边为正极,起还原作用,是阴极。
要注明物态;
气体要注明压力和依附的惰性金属;
溶液要注明浓度或活度。
可逆电池的书写方法3.“”或“”表示盐桥,使液接电势降到忽略不计
(1)
(2)左氧化,负极右还原,正极净反应或从化学反应设计电池
(1)Zn(s)+H2SO4(aq)H2(p)+ZnSO4(aq)验证:
Zn(s)|ZnSO4(aq)|H2SO4(aq)|H2(p)|Pt净反应:
Zn(s)+2H+Zn2+H2(p)从化学反应设计电池
(2)净反应:
验证:
例如:
Zn(s)|Zn2+|Cu2+|Cu(s)Zn(s)+Cu2+Zn2+Cu(s)DrGm0Cu(s)|Cu2+|Zn2+|Zn(s)Zn2+Cu(s)Zn(s)+Cu2+DrGm0,E0,则Qr0,即电池工作时从环境吸热;
(E/T)p0,则Qr0,即电池工作时向环境放热;
(E/T)p=0,则Qr=0,即电池工作时不与环境换热9.5电动势产生的机理电极与电解质溶液界面间电势差的形成接触电势液体接界电势电池电动势的产生在金属与溶液的界面上,由于正、负离子静电吸引和热运动两种效应的结果,溶液中的反离子只有一部分紧密地排在固体表面附近,相距约一、二个离子厚度称为紧密层;
另一部分离子按一定的浓度梯度扩散到本体溶液中,称为扩散层。
电极与电解质溶液界面间电势差的形成金属表面与溶液本体之间的电势差即为界面电势差。
紧密层和扩散层构成了双电层。
电极表面x扩散双电层模型扩散双电层模型接触电势电子逸出功电子从金属表面逸出时,为了克服表面势垒必须做的功。
逸出功的大小既与金属材料有关,又与金属的表面状态有关。
不同金属相互接触时,由于电子的逸出功不同,相互渗入的电子不同,在界面上电子分布不均匀,由此产生的电势差称为接触电势。
简称液接电势(liquidjunctionpotential)在两个含不同溶质的溶液的界面上,或溶质相同而浓度不同的界面上,由于离子迁移的速率不同而产生的电势差液体接界电势液接电势很小,一般在0.03V以下。
离子扩散是不可逆的,所以有液接电势存在的电池也是不可逆的,且液接电势的值很不稳定。
用盐桥可以使液接电势降到可以忽略不计。
盐桥只能降低液接电势,但不能完全消除。
只有电池反串联才能完全消除Ej,但化学反应和电动势都会改变。
作盐桥的电解质要具备:
常用饱和KCl盐桥,因为K+与Cl-的迁移数相近,当有Ag+时,用KNO3或NH4NO3。
盐桥中盐的浓度要很高,常用饱和溶液。
盐桥的作用盐桥是一个U型的玻璃管,其中充满含有电解质饱和溶液的琼脂的冻胶不与电池中的电解质发生反应作用:
保持电中性和回路,尽量减小并稳定液接电势盐桥连接的两个电解质溶液之间有两个浓KCl溶液与稀溶液的接界且方向相反,两个液体接界电势趋于相互抵消,减小液体接界电势。
电池电动势的产生9.6电极电势和电池的电动势标准电极电势标准氢电极电池电动势的计算规定:
标准氢电极用镀铂黑的金属铂导电氢标还原电极电势阳极,氧化(-)以标准氢电极为阳极,待测电极为阴极,因为为零,所测电动势即为待测电极的氢标还原电极电势。
阴极,还原(+)电池净反应电极电势的大小反映了电极上可能发生反应的次序电极电势越小,越容易失去电子,越容易氧化,是较强的还原剂电极电势越大,越容易得到电子,越容易还原,是较强的氧化剂利用标准电动序,在原电池中,可以判断哪个做正极,哪个为负极。
电势小者氧化为负极在电解池中,可以判断电极上发生反应的次序,阳极上小者先氧化,阴极上大者先还原E增大(非自发电池)(自发电池)电极电势计算通式这是计算电极还原电极电势的Nernst方程电极电势计算通式例如有电极电极的还原反应为电极电势的计算式为0.10.33371.00.2801饱和0.2412氢电极使用不方便,用有确定电极电势的甘汞电极作二级标准电极。
二级标准电极甘汞电极二级标准电极甘汞电极电池反应分别为电池电动势的计算电池电动势的计算电池电动势计算通式净反应电池电动势的计算计算方法1:
注意事项电池电动势的计算1。
电极反应和电池反应都必须物量和电荷量平衡2。
电极电势都必须用还原电极电势,电动势等于正极的还原电极电势减去负极的还原电极电势3。
要注明反应温度,不注明是指298K要注明电极的物态,气体要注明压力,溶液要注明浓度净反应:
两种方法结果相同电池电动势的计算计算方法2:
9.7电动势测定的应用求电解质溶液的平均活度因子求难溶盐的活度积pH的测定*电势pH图及其应用*细胞膜与膜电势*离子选择性电极和化学传感器简介计算实验可测的值已知:
试判断下述反应在标准状态下向哪方进行?
排成电池:
正向进行判断氧化还原的方向和m已知,测定E,可求出g求电解质溶液的平均活度因子根据Debye-Hckel公式对于1-1价电解质:
以对作图已知平均活度因子求标准电极电势截距即为A。
求AgCl(s)的设计电池,使电池反应为求难溶盐的活度积和水解离常数B.求水的设计电池的反应为:
电池电池:
pH的测定标准氢电极使用不方便,用玻璃电极pH定义:
因为单个离子的活度因子无法测量,故该定义也是不严格的pH的操作定义pH计的应用IUPAC推荐了五种标准的缓冲溶液,用来测定未知溶液的pH在保持温度和离子浓度为定值的情况下,将电极电势与pH值的函数关系在图上用一系列曲线表示出来,这种图就称为电势-pH图。
什么叫电势-pH图?
电极电势的数值不但与溶液中离子的浓度有关,而且有的还与溶液的pH值有关。
通常用电极电势作纵坐标,pH值作横坐标,在同一温度下,指定一个浓度,就可以画出一条电势-pH曲线。
*电势pH图及其应用应用于:
1.离子分离,2.湿法冶金,3.金属防腐及解决水溶液中发生的一系列氧化还原反应及平衡问题。
电势-pH图的应用从电势pH图可以清楚地看出各组分生成的条件及稳定存在的范围。
因为它表示的是电极反应达平衡时的状态,所以电势pH图也称为电化学平衡图。
氧电极的电势-pH图对于氢和氧发生氧化还原生成水的反应可以安排成一种燃料电池,电解质溶液的pH值可以在1-14的范围内变动暂时以酸性溶液为例,温度都保持在298K。
氧电极的反应为:
氧电极的电势-pH图设氧气为理想气体,在298K时
(1)当截距为1.229V,斜率为0.05916截距为1.259V,斜率不变,
(2)当如图中绿线所示截距为1.199V,斜率不变,(3)当如图中红线所示可见,氧气压力越高,氧电极的电势也越大。
通常将平行线之上称为氧稳定区,之下称为水稳定区。
氢电极实际上起的是氧化反应,但电极电势仍用的是还原电势。
根据Nernst方程,氢电极的电极电势与pH的函数关系也是一个直线方程,第一项是截距,第二项中斜率也是-0.0592。
设定不同的氢气压力,可以得到截距不同的一组平行线。
氢电极的电势-pH图截距为0V,用蓝线表示H2(pH2)|H2SO4(aq)|O2(pO2)氢电极的电势-pH图氢电极:
H2(pH2)2H+2e-
(1)当
(2)当截距为-0.0592V,斜率不变如图中绿线所示(3)当截距为0.0592V,斜率不变如图中红线所示可见氢气压力越高,电极电势越小。
所以将平行线以下称为氢稳定区平行线以上称为水稳定区。
H2O的电势-pH图因两者的斜率相同,仅是截距不同,所以是一组平行线,平行线之间的距离就是该燃料电池的电动势,其值与pH无关。
将氧电极和氢电极的电势pH图画在同一张图上,就得到了H2O的电势-pH图。
显然,当H2和O2的压力都等于标准压力时,该燃料电池的电动势均为1.229V。
所以总的反应是氧气还原生成水,氢气氧化成氢离子。
从电势-pH图上还可以看出:
氧电极的电势高,氢电极的电势低。
只有氧电极做正极,氢电极做负极,这样组成的电池才是自发电池。
显然,氧气和氢气压力越高,组成的电池电动势越大,反应趋势也越大。
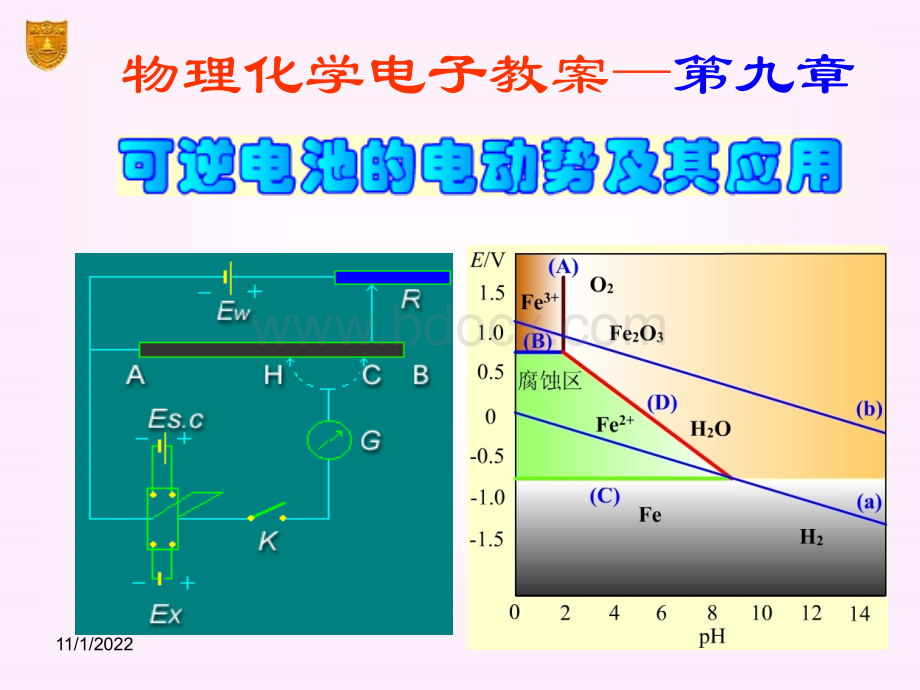
(Ox|Red)/V在在(b)线上发生的反应为线上发生的反应为在在(a)线上发生的反应为线上发生的反应为系统发生的反应为系统发生的反应为电池的电动势为电池的电动势为都用还原电极电势都用还原电极电势该反应不是氧化还原反应,只与溶液pH有关,所以在电势-pH图上是一组垂直于横坐标的垂线。
如(A)垂线铁的各种电势-pH图从热力学求得Fe2O3(s)+6H+2Fe3+3H2O铁的各种电势-pH图随着三价铁离子浓度的不同,pH值也会不同pH值越小,三价铁的浓度越大设三价铁的活度为10-6,则pH=1.37在(A)线的左侧是三价铁离子的稳定区,右侧是三氧化二铁的稳定区。
Fe3+e-Fe2+该反应是氧化还原反应,但与溶液的pH值无关在图上是一组平行于pH轴的水平线,如(B)线三价铁离子活度越大,电极电势越高设a(Fe2+)=a(Fe3+)(B)线以上是三价铁离子稳定区,(B)线以下是二价铁离子的稳定区。
Fe2+2e-Fe(s)