学术干货共聚焦显微镜中荧光团地共定位Word文档格式.docx
《学术干货共聚焦显微镜中荧光团地共定位Word文档格式.docx》由会员分享,可在线阅读,更多相关《学术干货共聚焦显微镜中荧光团地共定位Word文档格式.docx(11页珍藏版)》请在冰豆网上搜索。
在共聚焦显微镜中,样品被记录成含有很多像元的多维阵列数字图像,每个像元代表一个三维像素。
像元的尺寸〔或检测单元〕由物镜的数值孔径、照明波长以与共焦检测针孔直径等决定。
因此,在一个样品中两个荧光探针的共定位,比如发绿光的AlexaFluor488,发橘红色光的Cy3,在图像中就是由含有红色和绿色两者贡献的像素表示〔经常产生各种各样的橘色和黄色〕。
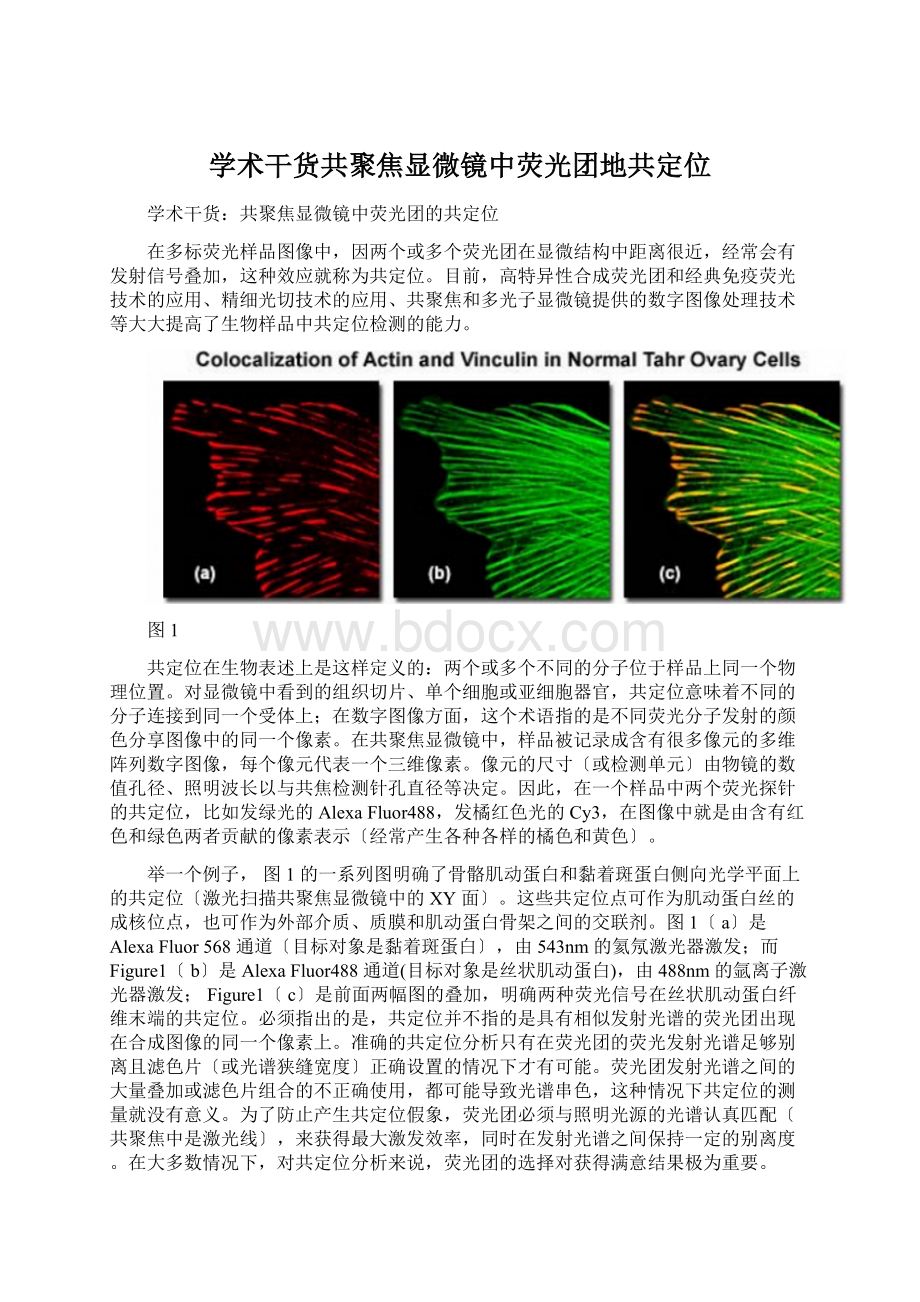
举一个例子,图1的一系列图明确了骨骼肌动蛋白和黏着斑蛋白侧向光学平面上的共定位〔激光扫描共聚焦显微镜中的XY面〕。
这些共定位点可作为肌动蛋白丝的成核位点,也可作为外部介质、质膜和肌动蛋白骨架之间的交联剂。
图1〔a〕是AlexaFluor568通道〔目标对象是黏着斑蛋白〕,由543nm的氦氖激光器激发;
而Figure1〔b〕是AlexaFluor488通道(目标对象是丝状肌动蛋白),由488nm的氩离子激光器激发;
Figure1〔c〕是前面两幅图的叠加,明确两种荧光信号在丝状肌动蛋白纤维末端的共定位。
必须指出的是,共定位并不指的是具有相似发射光谱的荧光团出现在合成图像的同一个像素上。
准确的共定位分析只有在荧光团的荧光发射光谱足够别离且滤色片〔或光谱狭缝宽度〕正确设置的情况下才有可能。
荧光团发射光谱之间的大量叠加或滤色片组合的不正确使用,都可能导致光谱串色,这种情况下共定位的测量就没有意义。
为了防止产生共定位假象,荧光团必须与照明光源的光谱认真匹配〔共聚焦中是激光线〕,来获得最大激发效率,同时在发射光谱之间保持一定的别离度。
在大多数情况下,对共定位分析来说,荧光团的选择对获得满意结果极为重要。
在图2中,对AlexaFluor染料家族的光谱叠加作了比拟,这在共定位实验中是很有用的。
为了比拟,所有的发射光谱都做了归一化,叠加区域用灰色阴影显示。
在图2(a)中,绿色荧光染料AlexaFluor488和橙黄色荧光染料AlexaFluor555在峰波长处显示很明显的别离,人眼也很容易能够区分。
然而,光谱叠加〔灰色阴影区域〕明确在AlexaFluor555的发射峰上很明显有Alexa
Fluor488的发射光谱〔用一条黑线标示,从发射峰到横坐标〕。
当AlexaFluor
488的荧光发射强度明显比AlexaFluor555的荧光发射强时,荧光信号这么高程度的串色使得荧光探针的别离很难。
很多因素都会导致这种情况发生,比如荧光团标的物浓度的巨大差异。
因此,在共定位实验中,这些探针的组合就应该防止,或只有当图像在多通道共焦模式采集下才可以使用,这样可以降低或消除串色。
图2
AlexaFluor探针之间的光谱叠加程度会随着探针发射峰之间的距离增加而下降,如Figure2(b)所示。
在这种情况下,AlexaFluor488和深红色染料Alexa
Fluor633与Figure2(a)比拟,重叠区域明显降低。
这两种染料人眼都很容易区分,光谱重叠程度低在共定位实验中可使串色最小化,如每个探针的浓度相似的话,应该可以产生较好的结果〔注意:
深红色的荧光染料AlexaFluor633在低浓度时通过显微镜目镜很难观察到〕。
AlexaFluor633可被红色氦氖激光器的633nm线最有效的激发,也可被黄色氦氖激光器的594nm激发。
或许,在Alexa
Fluor染料发射的可见光区域,最好的光谱别离是AlexaFluor488和AlexaFluor
647的结合〔图中未显示〕。
实际上,在这些染料之间没有光谱重叠,即使样品含有过量的AlexaFluor488,应该也没有串色。
具有这些特点的荧光探针是共聚焦显微镜分析共定位的理想选择。
在共聚焦显微镜中,测定共定位的能力受限于光学系统的分辨率与用于照明样品的入射光波长。
宽场荧光和共聚焦显微镜理论分辨率约为200nm,但在实际上,由于各种原因这个数降到400nm和600nm之间,原因包括显微镜光路未完全对准、光学折射率波动、光学像差与样品制备的不适宜。
然而,对于一个已经完全调好的共聚焦显微镜来说,两个荧光分子是否连接到同一个目标对象上,或者它们是否认位在同一个器官上受光学分辨率影响。
共定位的许多实验是围绕高特异性的合成探针和抗体进展的,标记目标是容易区分的局部的、明确的细胞结构。
对于厚度小于5μm的样品,比如贴壁细胞或很薄的组织切片,在常规的宽场荧光显微镜下,定量的共定位分析一般是可以的。
然而,对于厚样品,图像应以具有一定轴向尺寸的光学切片来记录,来分析看起来共定位的荧光团是否真正位于同一个侧向焦平面上,或在Z轴上他们是否彼此叠加。
厚样品的荧光团共定位分析应通过获得薄的光学切片来进展,可用激光扫描共聚焦显微镜、或转盘共聚焦显微镜或多光子显微镜。
多光子显微镜经常用单个近红外激光,在物镜焦点处的特定区域激发双标样品的两个荧光团。
这些技术将荧光发射局限在仅位于焦平面上的荧光团,这样大大降低了光漂白和背景噪音。
共定位的软件分析
样品中荧光团共定位的程度是通过比拟一幅图上每个像素位置的颜色值测定的。
分析的第一步就是要显示进展共定位测量的图,一般以两个独立通道的合成图显示。
当分析多标样品时,在一次计算中,只能处理两种伪彩,但所有伪彩排列之后都可以配对用于共定位分析。
由于传统上使用氩离子激光器、氪-氩离子激光器与氦氖激光器,这些激光器能够有效地激发在蓝色和绿色区域有强烈吸收的荧光团,因此选择红绿颜色对作为共聚焦荧光颜色。
此外,人眼对绿色和红色色调更为敏感。
图像的共定位分析一般经常用散点图表示〔scatterplot〕,这个图将两套数据关联起来。
散点图以二维图的形式描述了一幅图或一个感兴趣区域每个像素处一个通道对另一个通道的强度值〔见图3和图4〕。
作图时其中一个通道〔通常是绿色〕作为x轴,而另一个通道〔通常是红色〕作图时作为y轴,在横坐。
标和纵坐标上强度围是0∼4095.因此,合成图的每个像素点都有一对强度值。
分析每一对强度值产生的分布图案,能够识别荧光团的共定位、区分背景、串色、光漂白等。
图3
图3描述了共聚焦的三个合成图〔伪彩为红色和绿色〕,以与对应的散点图,三个样品荧光团共定位的程度不同。
每个通道中强度很低的像素位于靠近散点图的〔0,0〕处,而越亮的像素分散得越远。
在连接红色通道和绿色通道的散点图中,纯的红色和绿色的像素点往往会团聚在轴位置。
而共定位的像素〔如果有的话〕看起来是彩色的,具有黄色和橙色的色调〔取决于共定位的程度〕,落在y=x位置附近,也就是散点图的右上角。
图3a显示的样品为鼠脑冠状位海马切片,用AlexaFluor488标记神经纤维,AlexaFluor568标记神经胶质原纤维酸性蛋白,GFAP。
在图3b中,印度麂鹿皮肤成纤维细胞用AlexaFluor568染色,标记对象是黏着斑蛋白,同时用Alexa
Fluor488与鬼笔环肽作用,标记对象是纤维状的肌动蛋白。
而表达了荧光蛋白DsRed和EYFP的兔肾上皮细胞,定位在核上,在图3c中描述。
相关的散点图直接位于样品图像的面,例如图3d是图3a的散点图,两个通道共定位的程度在每个散点图的左下角用白色字母和数字表示。
图3a共定位程度相对较小〔只有百分之几〕,在图3b和图3c中共定位程度逐渐增加,共定位系数分别是30%和85%。
共聚焦显微镜与配件制造商提供的软件可对荧光团共定位进展散点图分析。
图4显示了一系列分析图,这个图是印度麂鹿皮肤成纤维细胞,用AlexaFluor568染色〔标记对象是黏着斑蛋白,红色通道〕,同时用AlexaFluor488染色〔标记对象是纤维状肌动蛋白,绿色通道〕。
在散点图中选择一个感兴趣区域进展分析,在图4a中用白颜色的长方形为这个感兴趣区域设定了信号的阈值,大多数共定位分析软件都可以进展这种功能分析。
感兴趣区域的水平边界和竖直边界应该排除背景信号,背景沿着散点图的x轴和y轴团簇。
只有被包括在所选择区域边界的像素信号才能进展共定位分析。
样品上重叠的像素区域很容易转变成共定位二元阈值像(图4b),这个图还可以和共聚焦图叠加在一起,做一个共定位map.图4c显示的共定位map图用白颜色显示了共定位区域,对大多数软件这个颜色很容易变成其他颜色,相对于原来的伪彩,比照度更高一些。
图4
正如上面所讨论的,在共聚焦图中对荧光团共定位的定量测定,可通过散点图和感兴趣区域的信息获得。
从整个散点图的信息,可获得很多变量值。
Pearson′s系数就是用于分析整个散点图的诸多变量中的一个,为描述两幅图之间重叠程度,在识别一幅图像和另一幅图像的匹配程度上,Pearson′s,R(r)系数是标准技术之一。
Pearson′s相关系数根据下面方程计算:
S1
是第一个通道每个像素的强度值,而
S2
是第二个通道每个像素的强度值。
S1(average)和S2(average)分别是第一个通道和第二个通道平均像素强度值。
在Pearson′s系数里,原始像素强度值减去平均像素强度值。
结果,系数值围从-1到1,-1表示图像的像素之间完全没有重叠,而1表示完美的图像重叠。
Pearson′s相关系数只解释了两个图像之间形状的相似性,而与图像像素强度值无关。
然而,当把这个系数值应用到共定位分析时,潜在的负值难以解释,需要用另一种方法解释结果。
用于计算另一相关系数的较简单的技术,需要去掉原始像素强度值和平均像素强度值这个差减项。
正式定义为Overlap系数〔R〕,这个值围从0到1,在图像分析中对强度变化不敏感。
Overlap系数定义为:
分子是两个通道强度的乘积和,只有当同一个像素的两个通道值与共定位相关时,分子才会给出一个很有意义的值〔两个通道的像素强度值都大于0〕。
因此,方程〔2〕的分子与共定位的像素数成正比。
同理,Overlap方程的分母正比于图像两个通道组分的像素数,而不考虑共定位是否存在〔注意:
组分定义为通道1和通道2红颜色和绿颜色的图或像素阵列〕。
Overlap系数的一个主要优点就是对一个图像上各种组分的信号强度差相对不敏感,信号强度差经常是由荧光团的浓度差、光漂白、量子效率变化与非等效的电子通道设置等产生的。
使用Overlap系数最重要的缺点是:
通道之间组分像素数比例会强烈影响Overlap系数值。
为了减少这种依赖性,Overlap系数分成两个不同的子系数,看k
(1)和k
(2),以两个独立的参量来表达共定位的程度。
Overlap系数k
(1)和k
(2)描述了通道之间强度的差异,k
(1)对通道2〔绿色信号〕强度差敏感,而k
(2)线性依赖于通道1像素的强度值。
因此,现在描述的方程能够说明重叠度,也能解释颜色通道之间的强度差异。
在图像的共定位区域,为了估计其中一个颜色通道对整个共定位荧光的贡献,定义了另外一套共定位系数m
(1)和m
(2)。
共定位系数m
(1)用于描述通道1对共定位区域的贡献,而共定位系数m
(2)用于描述通道2对共