高考化学一轮复习 课时22 原电池及其应用考点过关Word文档下载推荐.docx
《高考化学一轮复习 课时22 原电池及其应用考点过关Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《高考化学一轮复习 课时22 原电池及其应用考点过关Word文档下载推荐.docx(19页珍藏版)》请在冰豆网上搜索。
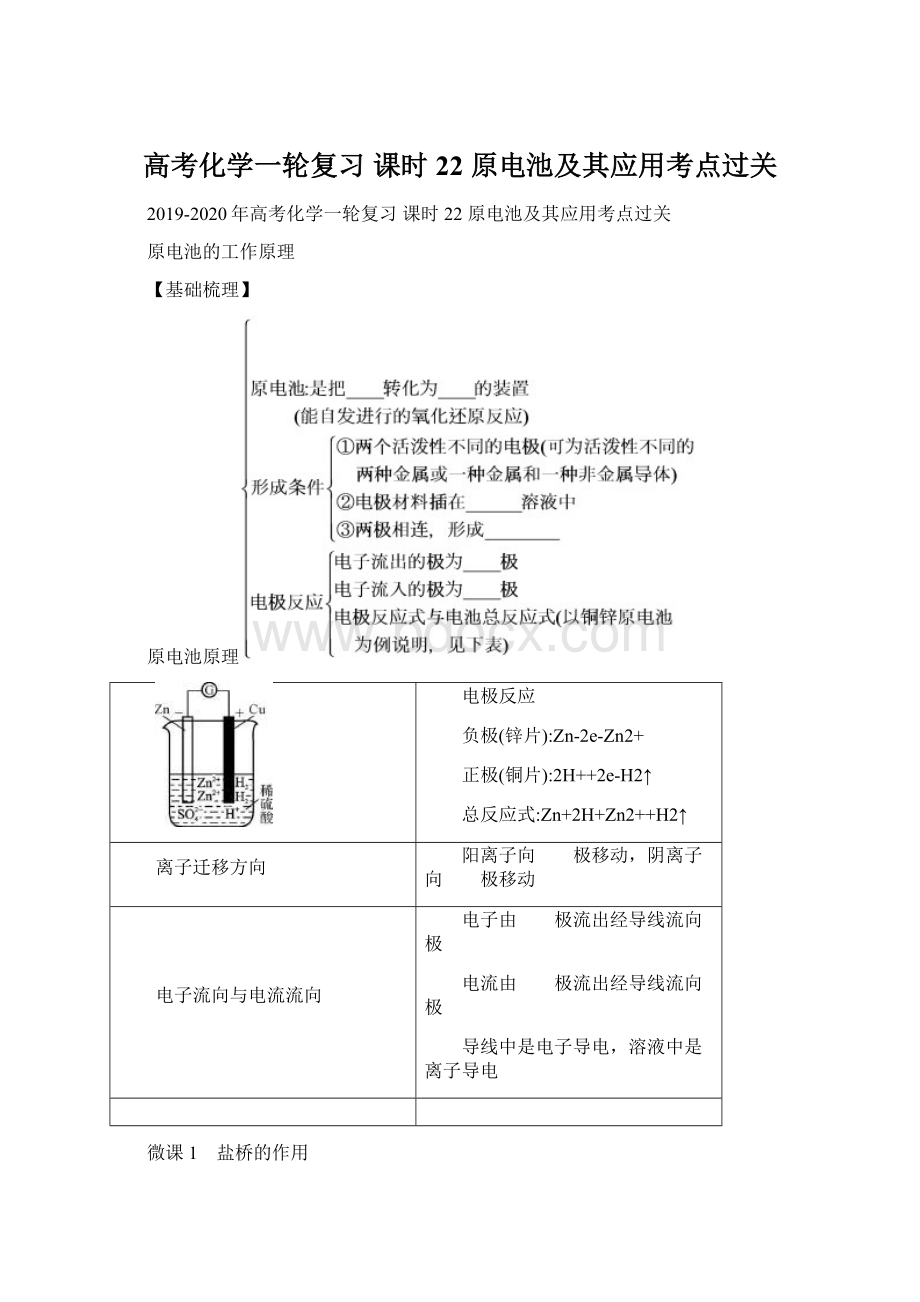
盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。
(2)盐桥的作用:
①连接内电路,形成闭合回路;
②平衡电荷,使原电池不断产生电流;
③使能量利用转化更高效。
2.单池原电池和盐桥原电池的对比
比较图1和图2两装置:
电极、电极反应、总反应、反应现象都相同。
不同点:
图1中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高。
图2中Zn和CuSO4溶液在两个池子中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长。
【典型例题】
一、原电池的工作原理
某小组为研究电化学原理,设计如右图装置。
下列叙述不正确的是( )
A.a、b不连接时,只有锌片上有气泡逸出
B.a和b用导线连接时,铜片上发生的反应为2H++2e-H2↑
C.a和b是否用导线连接,装置中所涉及的化学反应都相同
D.a和b用导线连接或接直流电源,锌片都能溶解
[答案] D
[解析] a、b不连接时,锌置换出氢气,所以锌片上有气泡逸出;
a和b用导线连接时,构成原电池,负极锌失去电子溶解,正极铜片上发生还原反应:
2H++2e–H2↑;
a和b是否用导线连接,装置中所涉及的化学反应都是锌置换出H2;
若a直接与外电源的负极相连时,锌片被保护。
某小组为研究原电池原理,设计如下图装置,下列叙述正确的是( )
A.装置Ⅰ,铜片上有O2逸出
B.装置Ⅰ,锌片溶解,发生还原反应
C.装置Ⅱ,电池反应为Zn+Cu2+Zn2++Cu
D.装置Ⅱ,外电路中,电子从铜电极流向锌电极
[答案] C
[解析] 装置Ⅰ是原电池,Zn为负极,发生氧化反应,铜为正极,铜片上有氢气逸出,无氧气逸出,所以A、B项错误;
装置Ⅱ也是原电池,Zn为负极,锌片溶解,生成锌离子发生氧化反应,铜为正极,Cu2++2e-Cu,装置Ⅱ外电路中,电子从锌电极流向铜电极。
二、原电池的设计
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)能量之间可以相互转化:
电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。
设计两种类型的原电池,探究其能量转化效率。
限选材料:
ZnSO4(aq),FeSO4(aq),CuSO4(aq);
铜片,铁片,锌片和导线。
①完成原电池的甲装置示意图(见右图),并作相应标注。
要求:
在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(2)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在
(1)的材料中应选 作阳极。
[答案]
(1)① ②电极逐渐溶解
③甲 甲可以避免Zn与Cu2+的接触,提高电池效率,提供稳定电流。
而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能
(2)Zn
[解析] ①带盐桥的原电池甲可以设计锌铜原电池(或铁铜原电池、锌铁原电池),由于外电路中电子从左移向右,说明左边烧杯中电极的金属性较强,则左、右两边烧杯中电极材料及电解质溶液可以为锌片和硫酸锌溶液、铜片和硫酸铜溶液(或者铁片和硫酸亚铁溶液、铜片和硫酸铜溶液,锌片和硫酸锌溶液、铁片和硫酸亚铁溶液);
②金属活动性:
Zn>
Fe>
Cu,则原电池乙中铜片作正极,锌片或铁片作负极,工作一段时间后,负极金属逐渐溶解;
③甲、乙两种原电池都能将化学能转化为电能,其中带有盐桥的原电池甲中的负极金属锌(或铁)和硫酸铜没有直接接触,二者不会直接发生置换反应,化学能不会转化为热能,几乎全部转化为电能;
而原电池乙中的负极金属锌(或铁)和硫酸铜直接接触发生置换反应,部分化学能会转化为热能,化学能不能全部转化为电能。
控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。
下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流表读数为零时,反应达到化学平衡状态
D.电流表读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
[解析] 由图示结合原电池原理分析可知,Fe3+得电子变成Fe2+被还原,I-失去电子变成I2被氧化,所以A、B正确;
电流表读数为零时Fe3+得电子速率等于Fe2+失电子速率,反应达到平衡状态;
D项在甲中溶入FeCl2固体,平衡2Fe3++2I-2Fe2++I2向左移动,I2被还原为I-,乙中石墨为正极,D不正确。
三、比较金属的活泼性大小
有A、B、C、D、E五块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀硫酸溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀硫酸溶液中,电流由D→导线→C;
③A、C相连后,同时浸入稀硫酸溶液中,C极产生大量气泡;
④B、D相连后,同时浸入稀硫酸溶液中,D极发生氧化反应;
⑤用惰性电极电解含B离子和E离子的溶液,E先析出。
据此,判断五种金属的活动性顺序是( )
A.A>
B>
C>
D>
E B.A>
E
C.C>
A>
ED.B>
[答案] B
[解析] 金属与稀硫酸溶液组成原电池,活泼金属为负极,失去电子发生氧化反应,较不活泼的金属为正极,H+在正极表面得到电子生成H2,电子运动方向由负极→正极,电流方向则由正极→负极。
在题述原电池中,①A>
B,②C>
D,③A>
C,④D>
B,⑤B>
E。
综上可知,金属活动性:
有A、B、C、D四种金属,做如下实验:
①将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;
②将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈;
③将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。
据此判断它们的活动性由强到弱的顺序是( )
D B.C>
B
C.D>
CD.A>
C
[解析] ①A与B用导线连接后浸入电解质溶液中会构成原电池,B不易腐蚀,说明B为原电池的正极,金属活动性:
B;
②A、D与等物质的量浓度的盐酸反应,D比A反应剧烈,金属活动性:
A;
③根据置换反应规律,Cu不能置换出B,说明金属活动性:
Cu;
Cu能置换出C,说明金属活动性:
Cu>
C。
则四种金属活动性的排列顺序是D>
原电池正、负极的判断方法
(1)由组成原电池两极的电极材料判断:
如果两极是由活泼性不同的金属作电极时,一般情况下相对活泼的金属是负极,活泼性较弱的金属是正极(要注意特殊条件,如Mg-Al-NaOH,Al才是负极;
Al-Cu-浓硝酸,Cu才是负极);
如果是由金属和非金属导体(或金属氧化物导体)作电极,金属是负极,非金属导体(或金属氧化物导体)是正极。
(2)根据氧化还原反应判定:
发生氧化反应(或在该电极处失电子)的电极为负极;
发生还原反应(或在该电极处得电子)的电极为正极。
(3)根据电子或电流的流向判定:
电子流出或电流流入的电极为负极,反之为正极。
(4)根据原电池里电解质溶液中离子的流动方向判断:
阳离子移向的电极为正极,阴离子移向的电极为负极。
(5)根据原电池的两极发生的现象判断:
溶解或质量减轻的电极为负极,有气体或金属析出的电极为正极(此规则具有相当的局限性,它只适用于一些非常常规的原电池的电极判定,如Al-Cu-稀硫酸)。
【小结】
常见的化学电源
1.一次电池——干电池
(1)NH4Cl、ZnCl2和淀粉作电解质溶液
负极:
正极:
2N+2e-2NH3↑+H2,2MnO2+H2Mn2O3+H2O
电池总反应:
Zn+2MnO2+2NH4ClZnCl2+Mn2O3+2NH3↑+H2O
(2)碱性锌锰干电池(电解质:
KOH)
负极(Zn):
Zn+2OH--2e-Zn(OH)2
正极(MnO2):
2MnO2+2H2O+2e-2MnOOH+2OH-
Zn+2MnO2+2H2O2MnOOH+Zn(OH)2
2.常见的燃料电池
(1)燃料电池是利用氢气、天然气、甲醇等燃料与氧气或空气进行 反应时释放出来的化学能直接转化成电能的一类 。
(2)一般的燃料电池大多是可燃性物质(主要是可燃性气体或蒸气)与氧气及电解质溶液共同组成的原电池,虽然可燃性物质与氧气在不同的电极反应,但其总反应式应该是可燃物在氧气中燃烧。
以氢氧燃料电池为例:
氢氧燃料电池
电池总反应式:
2H2+O22H2O
酸性
负极反应式
正极反应式
碱性
乙醇-氧气燃料电池(正极反应式与氢氧燃料电池正极反应式相同,下面只需写出负极反应式即可)
① (碱性介质)
② (酸性介质)
3.二次电池(可充电电池)
铅蓄电池(负极:
;
;
电解质:
H2SO4溶液)的充放电过程:
Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(l)
①放电过程
( 反应)
总反应:
②充电过程(是放电反应的逆过程)
阴极:
(接电源的 极, 反应)
阳极:
微课2 有机物燃料电池的电极反应式的书写方法
以乙醇(碱性)燃料电池为例:
(1)首先写出C2H5OH的燃烧化学方程式,以确定转移的电子数。
C2H5OH+3O22CO2+3H2O
由O2可推出转移的电子数为12e-
(2)在负极C2H5OH为失电子的还原性物质,故负极电极反应书写的步骤如下:
(3)正极反应:
在碱性条件下,O2为正极反应的得电子物质,故正极电极反应书写的步骤如下:
【巩固训练】
1.甲烷燃料电池(铂为两极,正极通入O2和CO2,负极通入甲烷)
(1)酸性电解质(电解液为H2SO4溶液)
;
总反应方程式:
。
(2)碱性电解质(电解液为KOH溶液)
2.甲醇燃料电池
(2