第二章非金属及其化合物第一节碳硅及无机非金属材料Word格式.docx
《第二章非金属及其化合物第一节碳硅及无机非金属材料Word格式.docx》由会员分享,可在线阅读,更多相关《第二章非金属及其化合物第一节碳硅及无机非金属材料Word格式.docx(19页珍藏版)》请在冰豆网上搜索。
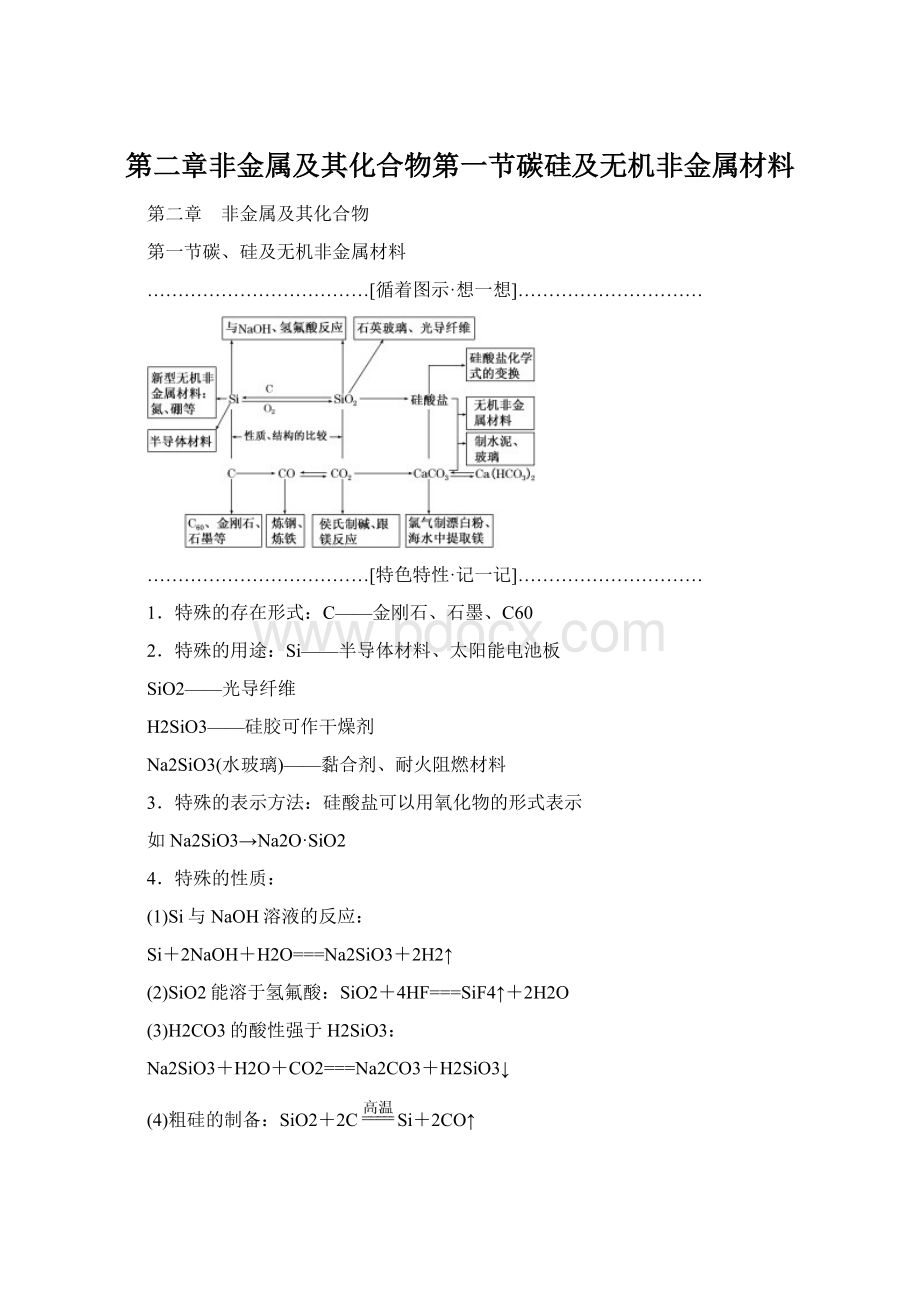
(4)粗硅的制备:
SiO2+2CSi+2CO↑
考点一应用广泛的非金属单质——碳、硅
[教材知识层面]
1.碳、硅元素的原子结构与存在
碳
硅
原子结构示意图
在元素周期表中的位置
第二周期ⅣA族
第三周期ⅣA族
单质的结构
金刚石:
空间网状结构
石墨:
层状结构
晶体硅:
与金刚石类似的空间网状结构
元素在自然界中的存在形式
既有游离态又有化合态
只有化合态
2.碳、硅单质的性质
(1)碳、硅的物理性质和用途(用短线连接起来):
(提示:
①—c,②—a,③—e,④—b,⑤—d)
(2)碳、硅的化学性质:
①碳单质的化学性质——还原性。
a.与O2的反应(用化学方程式表示):
O2不足:
2C+O2点燃,2CO;
O2充足:
C+O2点燃,CO2。
b.与其他物质的反应(用化学方程式表示):
与CuO反应:
2CuO+C高温,2Cu+CO2↑(可用于金属的冶炼);
与CO2反应:
CO2+C高温,2CO;
与水蒸气反应:
C+H2O(g)高温,CO+H2(制水煤气);
与浓硫酸反应:
C+2H2SO4(浓)△,CO2↑+2SO2↑+2H2O。
②硅的化学性质——还原性。
a.与氢氟酸反应的化学方程式:
Si+4HF===SiF4↑+2H2↑;
b.与NaOH溶液反应的化学方程式:
Si+2NaOH+H2O===Na2SiO3+2H2↑;
c.与O2反应:
Si+O2△,SiO2。
[高考考查层面]
命题点1 硅单质的特性
非金属的一般规律
硅的特性
硅还原性强于碳
2C+SiO2Si+2CO↑
非金属与强碱溶液反应一般不产生H2
硅可与强碱溶液反应产生H2:
非金属一般不与非氧化性酸反应
Si+4HF===SiF4↑+2H2↑
一般非金属单质为绝缘体
硅为半导体,常用于电子部件
[典题示例]
判断下列描述的正误(正确的打“√”,错误的打“×
”)。
(1)(2013·
广东高考)高温下用焦炭还原SiO2制取粗硅。
( )
(2)单质硅是将太阳能转变为电能的常用材料。
(3)(2011·
山东高考)单质硅常用作半导体材料和光导纤维。
(4)(2011·
山东高考)硅在自然界中只以化合态的形式存在。
(5)硅的化学性质不活泼,常温下不与任何物质反应。
答案:
(1)√
(2)√ (3)×
(4)√ (5)×
命题点2 硅的工业制法
1.制取粗硅
工业上,用焦炭在电炉中还原二氧化硅得到含有少量杂质的粗硅。
SiO2+2CSi+2CO↑。
2.粗硅提纯
(1)Si+2Cl2SiCl4,
SiCl4+2H2Si+4HCl。
(2)Si+3HClSiHCl3+H2,
SiHCl3+H2Si+3HCl。
3.注意问题
(1)用焦炭还原SiO2,产物是CO而不是CO2。
(2)粗硅中含碳等杂质,与Cl2反应生成的SiCl4中也含CCl4等杂质,经过分馏提纯SiCl4后,再用H2还原,得到高纯度硅。
1.半导体工业中,有一句行话:
“从沙滩到用户”,即由SiO2制取Si。
制取过程中不涉及的化学反应是( )
A.2C+SiO2Si+2CO↑
B.SiO2+2NaOH===Na2SiO3+H2O
C.Si+2Cl2SiCl4
D.SiCl4+2H2Si+4HCl
解析:
选B 工业制取纯硅的工艺流程为:
SiO2粗硅SiCl4纯硅,该工艺流程中不涉及SiO2与NaOH溶液的反应。
2.制备硅半导体材料必须先得到高纯硅。
三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
(1)写出由纯SiHCl3制备高纯硅的化学方程式为____________________________
________________________________________________________________________。
(2)整个制备过程必须严格控制无水无氧。
SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式为______________________________________;
H2还原SiHCl3过程中若混入O2,可能引起的后果是__________________________
(1)H2还原SiHCl3得到Si和HCl。
(2)SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,依据原子守恒,判断另一物质是H2。
因H2还原SiHCl3的反应条件是高温(1357K),若混入O2,则H2与O2混合加热可能发生爆炸,同时,O2也可能氧化SiHCl3。
(1)SiHCl3+H2Si+3HCl
(2)SiHCl3+3H2O===H2SiO3↓+3HCl↑+H2↑ 氧气与氢气混合,可能引起爆炸;
氧气可能会氧化SiHCl3
[考点达标层面]
1.硅作为一种新型能源被广泛开发利用,关于其有利因素的下列说法中,你认为不正确的是( )
A.硅燃烧产物对环境产生的污染,容易得到有效控制
B.从Si(s)+O2(g)SiO2(s) ΔH=-858.6kJ·
mol-1可知,硅燃烧放出的热量多
C.自然界中硅的储量丰富,可以从自然界直接获得单质硅
D.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一
选C 自然界中的硅是以化合态的形式存在,故不能从自然界中直接获得单质硅。
2.在①浓硝酸 ②水 ③浓硫酸 ④氢氟酸 ⑤氢氧化钠溶液中,能与单质硅起化学反应的是( )
A.①② B.②④
C.④⑤D.③④
选C Si与水、浓H2SO4、浓HNO3均不发生反应,但Si能与氢氟酸、NaOH溶液反应放出H2。
考点二性质迥异的氧化物——二氧化硅和二氧化碳
二氧化硅与二氧化碳的比较
(1)物理性质:
①熔、沸点:
SiO2的熔、沸点比CO2的熔、沸点高。
②溶解性:
CO2可溶于水,SiO2不溶于水。
(2)化学性质:
物质
二氧化硅
二氧化碳
化学性质
与水反应
不反应
CO2+H2OH2CO3
与酸反应
只与氢氟酸反应:
与碱(NaOH)溶液反应
SiO2+2NaOH===Na2SiO3+H2O(盛碱液的试剂瓶用橡胶塞)
CO2少量:
CO2+2NaOH===Na2CO3+H2O
CO2足量:
CO2+NaOH===NaHCO3
与盐反应
如与Na2CO3反应:
SiO2+Na2CO3Na2SiO3+CO2↑
如与Ca(ClO)2反应:
Ca(ClO2)+CO2+H2O===CaCO3↓+2HClO
与碱性氧化物反应
如与CaO反应:
SiO2+CaOCaSiO3
如与Na2O反应:
CO2+Na2O===Na2CO3
(3)主要用途:
CO2:
制饮料、碳酸盐,干冰用作制冷剂。
SiO2:
作光导纤维,制光学仪器、电子部件,水晶可制作饰品。
命题点 含硅化合物的特性
一般规律
含硅化合物的特性
酸性氧化物一般与水反应生成相应酸
SiO2不溶于水,不与水反应
酸性氧化物一般不与酸发生复分解反应
“较强酸制较弱酸”是复分解反应的一般规律,H2CO3酸性强于H2SiO3
Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓
以下反应不能说明酸性的强弱
Na2CO3+SiO2Na2SiO3+CO2↑
CaCO3+SiO2CaSiO3+CO2↑
H2SiO3
无机酸一般易溶于水
硅酸难溶于水
硅酸盐
大多数硅酸盐难溶于水
常见的可溶性硅酸盐为Na2SiO3,水溶液俗称水玻璃
1.指出下列反应中SiO2所表现的化学性质或作用,在A~E选项中选择正确答案填入括号内。
①SiO2+2NaOH===Na2SiO3+H2O( )
②SiO2+Na2CO3Na2SiO3+CO2↑( )
③SiO2+2CSi+2CO↑( )
④SiO2+3CSiC+2CO↑( )
⑤SiO2+4HF===SiF4↑+2H2O( )
A.作为玻璃的成分被消耗而使玻璃被腐蚀
B.氧化性
C.酸性氧化物的通性
D.将挥发性的酸酐从其盐中置换出来
E.未参加氧化还原反应
①C ②D ③B ④E ⑤A
2.下列说法正确的是( )
A.在粗硅的制取中发生2C+SiO22CO↑+Si,硅被还原,所以碳的还原性强于硅的还原性
B.盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2Na2SiO3+CO2↑可知,硅酸的酸性强于碳酸
选C 选项A、D的反应在高温下均生成了气体,使平衡正移,致使反应能顺利进行,但不能说明C、Si的还原性强弱,也不能说明H2SiO3与H2CO3酸性的强弱,故错误;
NaOH能与玻璃成分中的SiO2反应生成Na2SiO3而使瓶塞粘在一起。
由SiO2制取H2SiO3的过程为:
SiO2Na2SiO3H2SiO3。
1.(2015·
西安质检)下列关于SiO2和CO2的叙述中不正确的是( )
A.都是共价化合物
B.SiO2可用于制光导纤维,干冰可用于人工降雨
C.都能溶于水且与水反应生成相应的酸
D.都是酸性氧化物,都能与强碱溶液反应
选C SiO2和CO2中都只含有共价键,均为共价化合物,A项正确;
干冰升华吸热,可用于人工降雨,B项正确;
SiO2不溶于水且与水不反应,C项错误;
SiO2与强碱溶液反应生成硅酸盐,CO2与强碱溶液反应生成碳酸盐或碳酸氢盐,D项正确。
2.如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。
将所选答案的编号填入下表内相应的空格内(如果不需要外加试剂,则对应答案栏可不填写)。
可供选择的试剂:
A.盐酸 B.氢氧化钠溶液 C.氧气
D.水 E.二氧化碳
可选用的操作:
①水洗;
②加热;
③高温灼烧;
④过滤;
⑤结晶。
粉末状混合物
选择的试剂
选用的操作
(1)
CaCO3(SiO2)
(2)
SiO2(NaHCO3)
(3)
SiO2(Fe2O3)
(4)
SiO2(H2SiO3)